食管癌放化疗模式优化与标志物探索,免疫联合化疗助力小细胞食管癌长生存
“食管癌文献月评”系列由【百济医学部】与【肿瘤资讯】共同推出,旨在分享食管癌领域的最新研究进展,更好助力临床诊疗。近期,一项发布于Ann Surg Oncol的研究,探索了扩展CROSS研究标准后,食管癌患者对新辅助放化疗的治疗反应,并发现不同的病理亚型与疗效相关;而另一项发表于J Transl Med的研究则探讨了肿瘤相关巨噬细胞样细胞与食管癌放化疗预后的关系。免疫联合化疗在消化道肿瘤治疗中已成为一种趋势,Thorac Cancer上的一项病例报告显示,免疫联合化疗在小细胞食管癌中展示了优效且持久的疗效。下面将以上几项研究整理成文,以飨读者。
扩展CROSS研究标准后,食管癌患者对新辅助放化疗的治疗反应:全国多中心队列分析
研究背景
将食管癌患者新辅助放化疗后手术研究(CROSS)的纳入标准拓展后,可以提高食管癌患者的治疗预后,这项全国队列研究评估了拓展标准对病理完全缓解(pCR)和手术结局的影响。
研究方法
从荷兰上消化道癌症审计的全国数据库中收集2009~2017年间接受治疗的食管癌患者数据。局部晚期食管癌(CT1/N+或cT2-4a/N0-3/M0)患者按照CORSS方案治疗。CROSS(n=1942)和拓展的CROSS(e-CROSS,n=1359)分别代表患者符合原CORSS纳入标准和拓展后的CROSS 标准。主要终点为总体pCR(ypT0N0);次要终点为局部食管pCR(ypT0),根治性手术切除率,术后并发症和死亡率。
研究结果
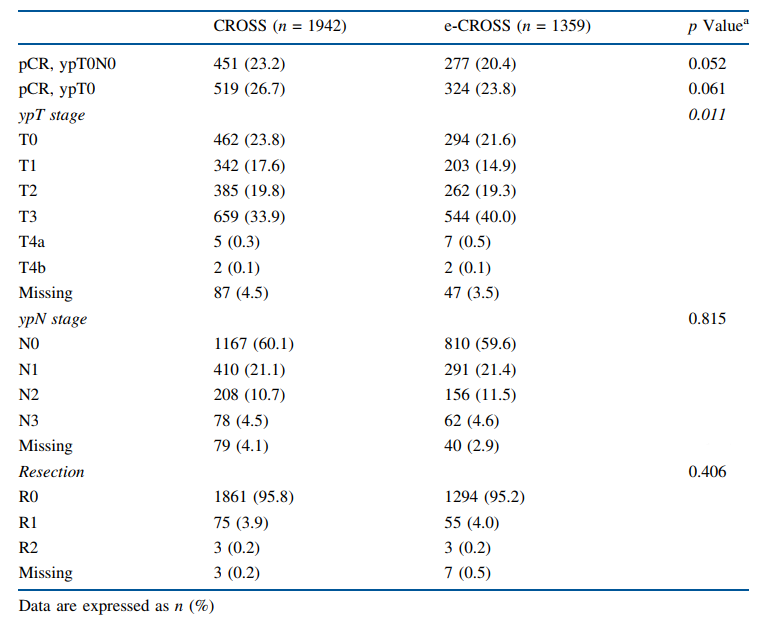
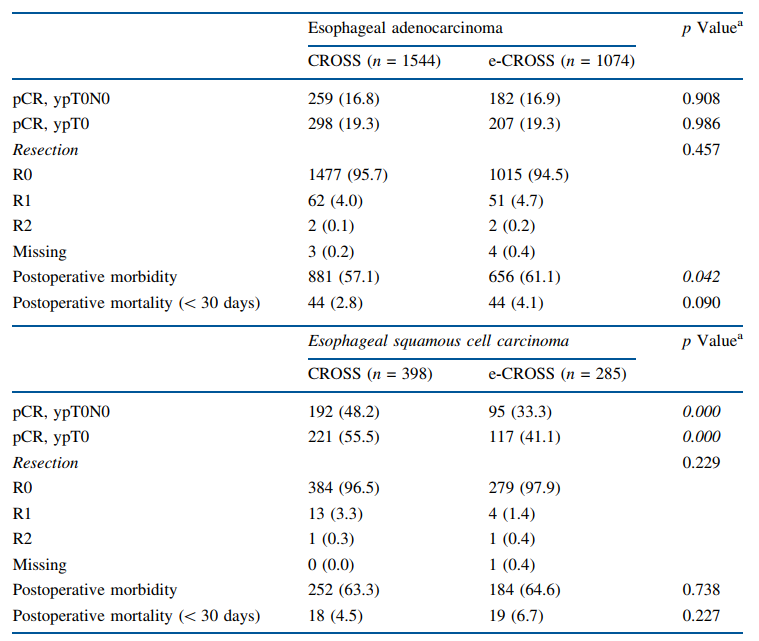
总体而言,CROSS和e-CROSS的总体和局部pCR率没有差异,尽管观察到一定的趋势(23.2% vs 20.4%,P=0.052;26.7% vs 23.8%,P=0.061)(表1)。在进行组织学分层时,在鳞状细胞癌中CROSS组的pCR率高于e-CROSS组(48.2% vs 33.3%,P=0.000),但在腺癌中并无此趋势(16.8% vs 16.9%,P=0.908)(表2)。两组的根治性手术并无差异。术后死亡率(3.2% vs 4.6%,P=0.037)和并发症率(58.3% vs 61.8%,P=0.048)在e-CROSS组更高。
研究结论
在常规临床实践中扩展CROSS研究的纳入标准接受新辅助放化疗对于pCR率和根治手术没有影响,但其与术后死亡率和并发症提高相关。值得一提的是,不同的病理亚型与疗效相关。因此,在后续研究中,应该考虑真实世界中哪类患者可以从中最大获益。
肿瘤相关巨噬细胞样细胞与食管癌放化疗的预后
研究背景
肿瘤相关巨噬细胞样细胞(CAMLs)是在多种恶性实体肿瘤的血液循环中发现的多核基质细胞。CAML大小的差异与较差的无进展生存(PFS)和总生存(OS)相关。但尚未有研究在食管癌中评价过其临床价值。
研究方法
为了评估这一临床价值,研究者进行了为期2年的前瞻性试点研究,纳入最新诊断的接受放化疗的Ⅰ~Ⅲ期(n=32)食管癌患者。在放化疗前(BL)、治疗2周后(T1)和放化疗结束后的第一次可用标本中(T2),连续监测CAML的大小。
研究结果
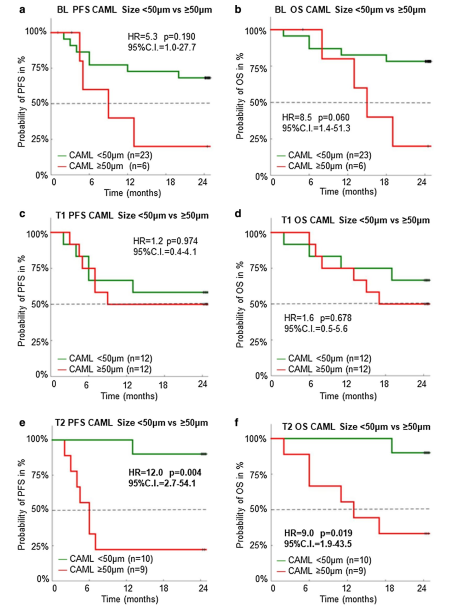
研究者分析了整个研究过程中的所有患者样本,在88%(n=28/32)的患者样本中发现了CAML,在治疗前的样本中敏感性为76%(n=22/29)。在放化疗结束时,CAMLs<50μm患者的2年PFS和OS较CAMLs≥50μm的患者更好,PFS(HR=12.0;95%CI=2.7~54.1,P=0.004)和OS(HR=9.0,95%CI=1.9~43.5,P=0.019)(图1)。
研究结论
在放化疗过程中微创方法监测CAML大小这一标志物,可用于食管癌预后的预测;需要进一步的研究治疗前CAML对于风险人群的诊断价值。
PD-1单抗联合化疗在小细胞食管癌中展示了优效且持久的疗效:病例报告
病例介绍
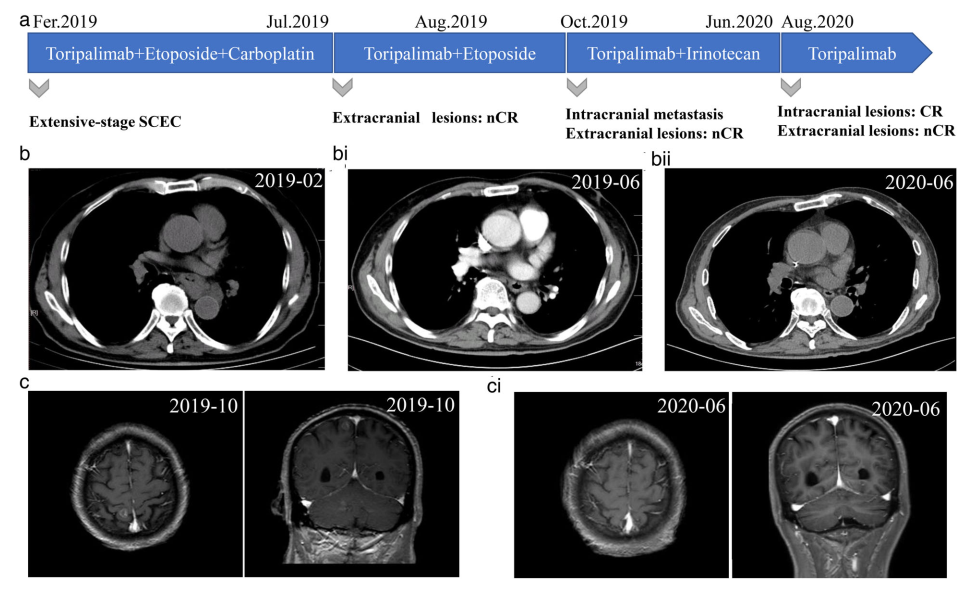
患者男,73,于2019年2月因复发性头痛和胸骨后疼痛入院。胃镜检查显示食管黏膜糜烂和隆起,活检标本病理结果证实小细胞癌诊断。免疫组化(IHC)染色示CK(+)、CgA(−)、Syn(+)、CD56(+)、P40(−)、CD20(−)、CD3(−)、Ki67(80%+)。CT扫描显示肝脏、肺和多个淋巴结转移。诊断结果为食管和贲门的广泛性小细胞癌。
活检样本进行全外显子组测序和IHC分析。MDM2扩增,PD-L1阳性表达(1.83%),肿瘤突变负荷为2.99 Muts/Mb。自2019年2月至7月期间,行6周期特瑞普利单抗(PD-1单抗;D5,240mg)联合依托泊苷(D1~5,100mg)/卡铂(D1,450mg)治疗。
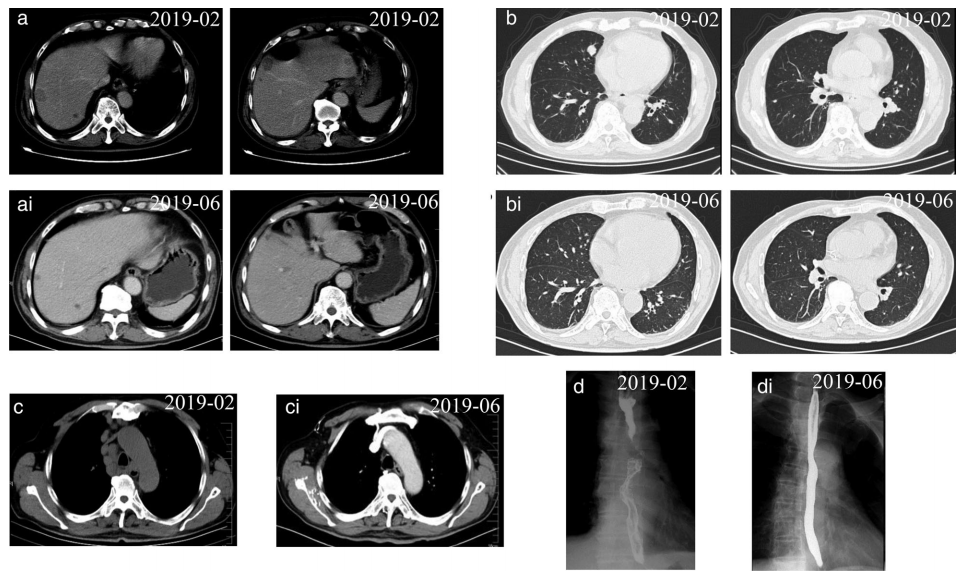
增强CT未见肝脏转移灶明显强化,纵隔4R区淋巴结及肺转移灶完全消失。钡餐造影显示食管壁光滑。复查胃镜示食管病变完全消除,呈瘢痕样改变。患者获得了接近完全缓解(nCR)(图2)。随后给予特瑞普利单抗(D4,240mg)联合依托泊苷(D1~4,100mg)维持治疗。不幸的是,于2019年10月发现颅内转移。因此,立即给予特瑞普利单抗(D2,240mg)加伊立替康(D1,300mg)4周期,并进行1疗程的脑转移放疗。2020年6月,颅内病变达到完全缓解(CR),颅外病变达到nCR。随后给予特瑞普利单抗(240mg)治疗。目前,该患者的总生存(OS)已经超过19个月(图3),目前情况稳定,没有任何严重的不良反应。
病例讨论
除手术和化疗外,小细胞食管癌患者缺少治疗选择,预后很差,既往研究显示,这类患者的中位OS仅为11.1个月。而该例患者使用免疫治疗联合化疗,显示出更有效且持久的获益(OS>19个月)。免疫治疗联合化疗对于小细胞食管癌可能是一种合理选择。此外,该发现需要良好设计的临床研究来进一步证实。
免疫检查点抑制剂(ICIs)是近十年来第一类为小细胞肺癌患者带来预后改善的药物。在IMpower 133 和CASPIAN研究中,小细胞肺癌患者的OS显著改善,且耐受性良好,ICIs成为小细胞肺癌患者的一线标准治疗。此外,在消化道肿瘤中,免疫治疗联合化疗也成为趋势,该病例虽然PD-L1表达低,但是OS仍超过19个月,超过小细胞食管癌研究中的中位生存(一项例1176例小细胞食管癌病例的研究显示中位OS为11.1个月)。尽管这个病例具有一定的偶然性,但仍提示免疫治疗联合化疗是小细胞食管癌的潜在治疗选择。
参考文献
[1] Wang HH, de Heer EC, Hulshoff JB, et al. Effect of Extending the Original CROSS Criteria on Tumor Response to Neoadjuvant Chemoradiotherapy in Esophageal Cancer Patients: A National Multicenter Cohort Analysis. Ann Surg Oncol 2020 Nov 28.
[2] Gironda DJ, Adams DL, He J, et al. Cancer associated macrophage-like cells and prognosis of esophageal cancer after chemoradiation therapy. J Transl Med 2020 Nov 4;18(1):413.
[3] Ren W, Wu P, Tian J, et al. Anti-PD-1 therapy plus chemotherapy showed superior and durable survival benefit in a patient with small cell esophageal cancer: A case report. Thorac Cancer 2020 Nov 11.