CDE拟突破性疗法认定:DS-8201a治疗HER2阳性胃或食管胃结合部腺癌
2020年12月23日,国家药品监督管理局药品审评中心(NMPA CDE)公示第一三共/阿斯利康的靶向HER2抗体偶联药物trastuzumab deruxtecan(DS-8201a或T-DXd)拟突破性疗法资格,适应证为单药用于既往接受过一种或一种以上治疗方案的HER2阳性局部晚期或转移性胃或食管胃结合部(GEJ)腺癌成人患者的治疗;此次突破性疗法的纳入是基于其关键性Ⅱ期DESTINY-Gastric01研究。

关于DESTINY-Gastric01研究
该研究是一项开放、随机的Ⅱ期临床试验,入组标准为:年龄≥20,ECOG评分0~1分,局部晚期或转移性HER2阳性胃或胃食管结合部腺癌,经包括氟尿嘧啶类、铂类、曲妥珠单抗的两种治疗方案治疗后出现疾病进展。按照2:1随机分组,分别给予DS-8201a(6.4mg/kg,每3周1次)或临床医师选择的化疗(紫杉醇或伊立替康单药)。主要研究终点:客观缓解率(ORR);次要研究终点:总生存(OS)、中位反应持续时间(DOR)、无进展生存(PFS)、疾病控制率(DCR)和安全性等。
2017年11月至2019年5月,日本48个临床研究中心和韩国18个临床研究中心参与了该研究,共188例患者随机入组,187例患者接受了治疗,DS-8201a组125例vs化疗组62例。两组基线特征平衡。
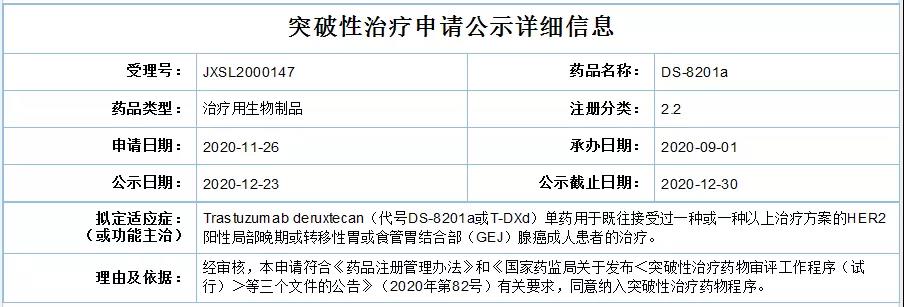
研究结果显示,DS-8201a组ORR为51%,化疗组ORR仅为14%;两组确认的客观缓解分别为43%vs12%。
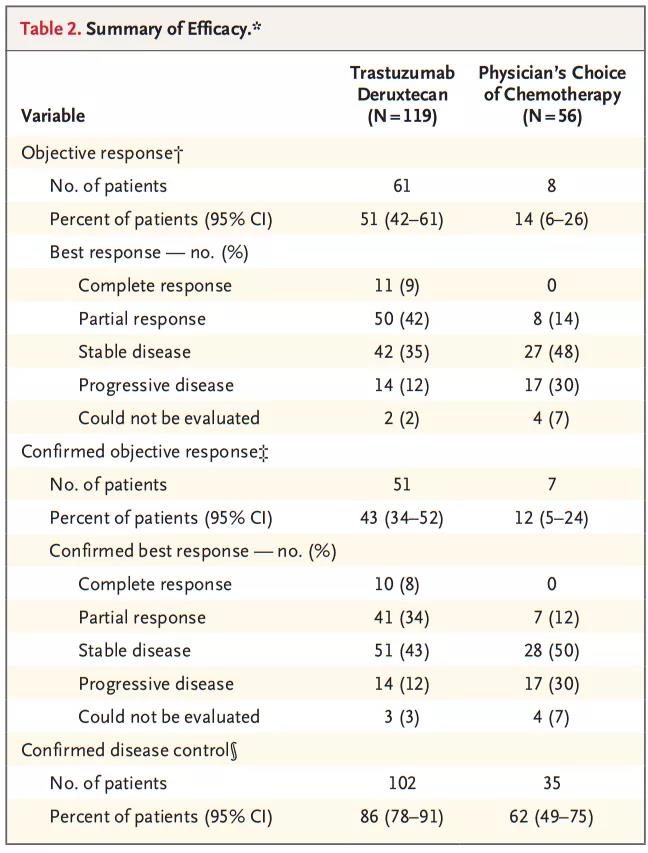
DS-8201a组与化疗组确认的DOR分别为11.3个月vs3.9个月,DCR分别为86%vs62%;两组的中位PFS分别为5.6个月(95%CI,4.3~6.9)vs3.5个月(95%CI,2.0~4.3)(HR=0.47);中位OS分别为12.5个月vs8.4个月(HR=0.59;P=0.01),与化疗相比,DS-8201a降低死亡风险41%;12个月总生存率分别为52.1%和28.9%。
最常见的≥3级不良事件为中性粒细胞减少(DS-8201a组为51%,化疗组为24%)、贫血(38%vs23%)和白细胞计数下降(21%vs11%)。共有12例患者发生DS-8201a相关间质性肺病或肺炎。DS-8201a组出现1例药物相关性死亡(由于肺炎);在化疗组中无药物相关性死亡发生。
关于DS-8201a
DS-8201a由第一三共和阿斯利康合作开发,是一种抗体-药物偶联剂,由一种人源化单克隆抗HER2抗体曲妥珠单抗、可水解的四肽连接链和细胞毒性拓扑异构酶Ⅰ抑制剂DXd组成。其可选择性地与肿瘤细胞表面的HER2受体结合,引起抗体依赖性细胞毒作用(ADCC),使DS-8201a内吞进入细胞。细胞内的溶酶体酶切断多肽链并释放出负载的DXd,抑制拓扑异构酶I的活性,进而引发DNA损伤和细胞凋亡。