阿帕替尼联合卡培他滨治疗晚期食管癌效果观察
前言
食管癌是临床常见消化道恶性肿瘤之一,在我国的发病率位于第6位,死亡率位于第4位[1,2]。食管癌早期症状不典型,因此在确诊时大部分患者已为晚期,错过了最佳手术治疗时机。放疗为目前治疗晚期食管癌的主要方式,其中放化疗联合治疗效果更佳[3,4,5]。然而化疗药物通常不良反应大,不适合身体耐受力差的患者。
卡培他滨作为新型氟尿嘧啶衍生物,其不良反应低,生物利用度高,且患者依从性好。同时,研究表明,小分子靶向药物阿帕替尼治疗晚期食管癌具有确切疗效,且不良反应轻[6,7,8]。本研究观察阿帕替尼联合卡培他滨方案对晚期食管癌患者的临床疗效,并对不良反应进行分析,现总结报道如下。
资料与方法
图片
▶ 一般资料
纳入标准:(1)经病理组织学确诊为晚期转移性食管癌,至少有1个可测量转移性病灶;(2)年龄≥18岁;(3)预计生存期≥3个月;(4)患者知情同意。排除标准:(1)无法吞咽、慢性腹泻和肠梗阻,明显影响药物吸收和服用;(2)合并肝、肾及造血系统疾病,无法耐受放疗;(3)在本研究的治疗开始前1年中患有其他器官肿瘤;(4)对研究药物过敏;(5)妊娠及哺乳期妇女。
按照纳入和排除标准,选取2017年6月至2018年2月来我院就诊的晚期食管癌患者101例,采用随机指趾表法将其分为观察组(51例)和对照组(50例)。
观察组中,男性28例,女性23例;年龄(62±6),年龄范围38~75岁;鳞状细胞癌38例,腺癌13例。对照组中,男性27例,女性23例;年龄(63±7),年龄范围39~79岁;鳞状细胞癌40例,腺癌10例。两组患者性别、年龄、肿瘤类型等一般资料比较,差异均无统计学意义(均P>0.05),具有可比性。本研究经我院伦理委员会批准,所有患者均知晓研究内容并签署知情同意书。
▶ 治疗方法
放射治疗:本研究所用放疗设备为6 MV/15 MV-X线(批号CL2300C/D-137,美国瓦里安公司),放射源设为6 MV-X线。放疗前患者取仰卧位,并予以固定。根据肿瘤体积设计靶体积,以此为基础范围向外扩展0.5 cm,在放射区域内选定4个三维适形野进行放疗,每次2 Gy,每周5次。药物治疗:对照组在放疗时联合卡培他滨,卡培他滨剂量为1 000 mg/次,口服,2次/d;观察组在对照组的基础上口服阿帕替尼,剂量为500 mg/d,餐后30 min服用,每28 d为1个疗程,连续服用4个疗程。如患者在治疗过程中出现阿帕替尼引起的Ⅲ~Ⅳ级不良反应时,可适当减量或暂停给药,治疗结束后复查或给予电话随访。
▶ 评价标准
疗效评价:采用实体瘤疗效评价标准(RECIST),以CT或磁共振成像(MRI)判断目标病灶,肿瘤病灶基线以可测量病灶为准,将疗效分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。总有效率(ORR)以CR+PR计算;疾病控制率(DCR)以CR+PR+SD计算。不良反应评价:采用世界卫生组织(WHO)抗肿瘤药物不良反应评价标准,分为0~Ⅳ级。无进展生存(PFS)时间是指患者从随机分组开始到PD或死亡或末次随访时间。
▶ 随访
所有患者自放疗之日起开始随访,随访截至2019年2月,采用电话及门诊方式随访,观察并记录患者的疗效、生存时间及不良反应发生情况。
▶ 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料符合正态分布,用均数±标准差(±s)表示,组间比较采用t检验;计数资料的比较采用χ2检验;等级资料的比较采用秩和检验;采用Kaplan-Meier法进行生存分析,并进行log-rank检验。以P<0.05为差异有统计学意义。
结果
▶ 两组患者近期疗效比较
观察组CR 7例(33.3%),PR 29例(56.9%),SD 5例(9.8%),DCR为98.0%(50/51),ORR为90.2%(46/51);对照组CR 9例(18.0%),PR 27例(54.0%),SD 13例(26.0%),PD 1例(2.0%),DCR为92.0%(46/50),ORR为72.0%(36/50);观察组ORR高于对照组,差异有统计学意义(χ2=5.473,P=0.019)。
▶ 两组患者不良反应比较
两组患者白细胞减少、中性粒细胞减少、血小板减少、贫血、蛋白尿、高血压发生情况比较,差异均无统计学意义(均P>0.05)(表1)。
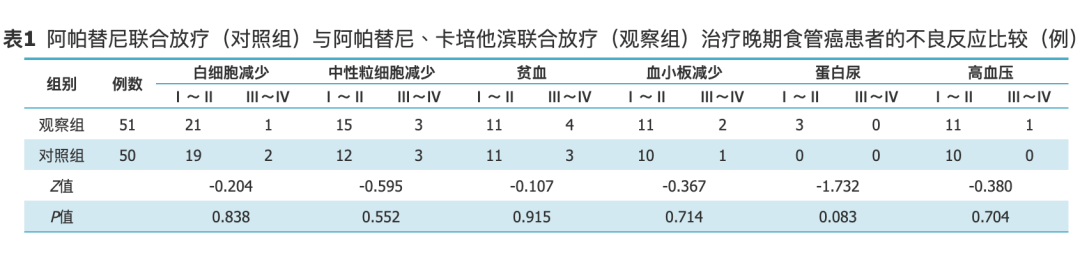
表1.阿帕替尼联合放疗(对照组)与阿帕替尼、卡培他滨联合放疗(观察组)治疗晚期食管癌患者的不良反应比较(例)
▶ 两组患者PFS时间比较
随访截至2019年2月,随访率100.0%。观察组中位PFS时间为18.49个月(95% CI 15.35~25.03),对照组为13.33个月(95% CI 10.36~18.24),差异有统计学意义(χ2=5.995,P<0.01)(图1)。
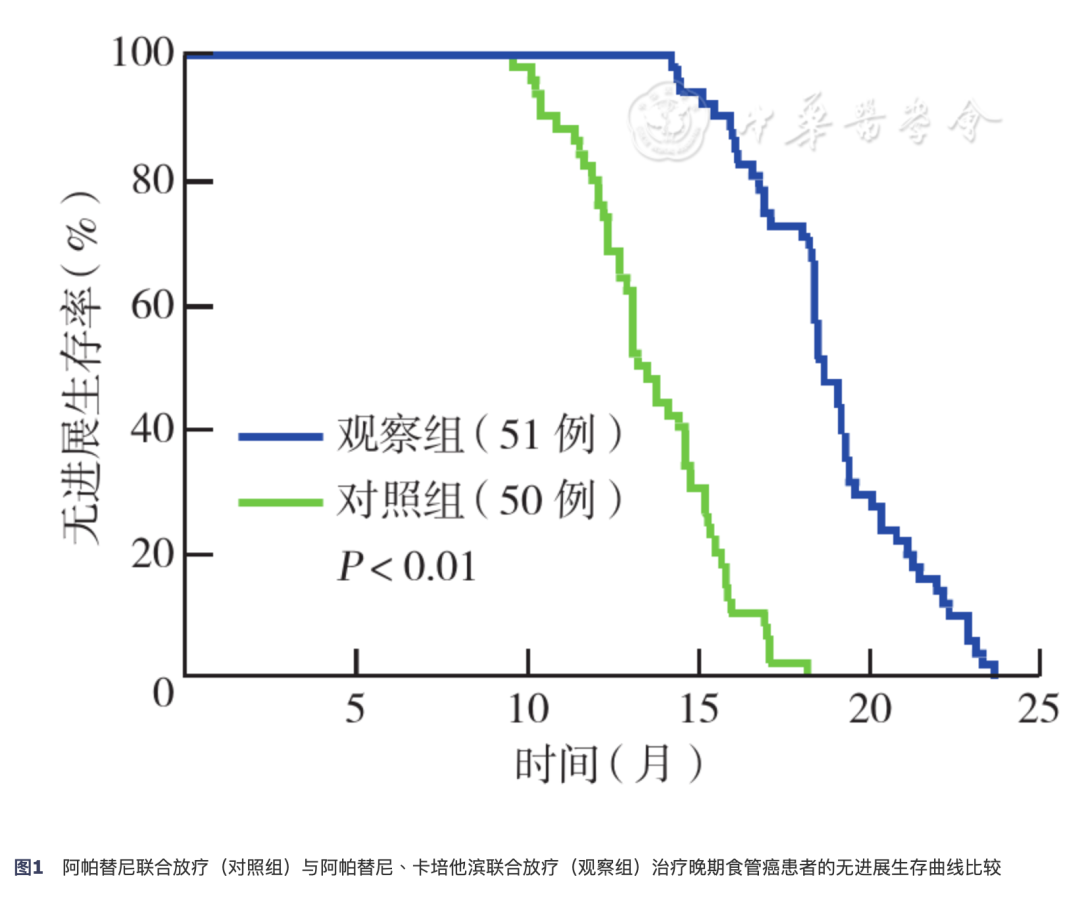
图1.阿帕替尼联合放疗(对照组)与阿帕替尼、卡培他滨联合放疗(观察组)治疗晚期食管癌患者的无进展生存曲线比较
讨论
食管癌发病率男性多于女性,发病年龄多在40岁以上,早期以食物下咽哽噎、胸骨刺痛为主要临床症状,其症状常不明显,70%~80%的患者在确诊时已经出现肿瘤局部浸润或远处转移,以致错过手术治疗最佳时机[9,10]。食管癌的主要病理类型是鳞状细胞癌,对放疗具有中度敏感性,因此放疗是治疗晚期食管癌有效方式,然而单独使用的疗效不佳,临床常使用同步放化疗以增强治疗效果。卡培他滨的患者依从性和生物利用度较好,且不良反应发生率低于顺铂、氟尿嘧啶等化疗药物。
张定富等[11]将晚期食管癌患者分为单纯放疗组和卡培他滨联合放疗组,发现联合放疗组治疗有效率高于单纯放疗组(P<0.05),肿瘤标志物水平低于单纯放疗组(P<0.05),因此本研究采用放疗联合卡培他滨作为对照组。阿帕替尼作为一种新型的小分子酪氨酸激酶抑制剂,已在晚期胃癌的治疗中取得了较好的效果,并被批准用于治疗晚期胃癌或胃-食管结合部腺癌[12],在其他癌症中的临床试验也正在开展。因此本研究使用阿帕替尼与卡培他滨联合用药,探讨其在晚期食管癌中的疗效。
本研究结果显示,观察组ORR、PFS时间均高于对照组,表明阿帕替尼联合卡培他滨及放疗治疗晚期食管癌的效果优于放疗联合卡培他滨。阿帕替尼能影响肿瘤细胞的生长,其通过与血管内皮生长因子受体(VEGFR)家族中的VEGFR-2(KDR/Flk-1)结合,竞争性抑制血管内皮生长因子(VEGF)与VEGFR-2结合,阻断VEGFR-2的自动磷酸化,影响肿瘤血管生成过程中VEGFR介导的信号转导通路,从而隔断肿瘤组织生长所依赖的氧气和营养[13]。在细胞实验中,安改丽等[14]研究指出阿帕替尼与传统肿瘤化疗药物联用可起到增强效果的作用,对食管癌细胞株的抑制作用高于两药单用的效果,与本研究结论一致。
本研究显示,两组患者血液学不良反应多为Ⅰ~Ⅱ级,Ⅲ~Ⅳ级极少见。观察组曾出现3例轻度蛋白尿,适量减少阿帕替尼剂量后症状消失,出现1例Ⅲ~Ⅳ级高血压患者,适当降压处理后血压平稳,表明阿帕替尼与卡培他滨联用不会增加患者的不良反应。阿帕替尼作为一种靶向化疗药物,可以减少对正常组织器官的杀伤作用,但是在使用阿帕尼替治疗时,仍然要密切关注患者不良反应,如高血压、蛋白尿、手足综合征及骨髓抑制等[15]。
总之,阿帕替尼联合卡培他滨治疗晚期食管癌疗效确切,患者PFS时间延长,不良反应发生率低,适合在临床上推广使用。
参考文献
[1]陈万青,郑荣寿,张思维,等. 2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1): 1-8. DOI: 10.11735/j.issn.1004-0242.2016.01.A001.
ChenWQ, ZhengRS, ZhangSW,et al. Report of cancer incidence and mortality in China,2012[J]. China Cancer,2016,25(1): 1-8. DOI: 10.11735/j.issn.1004-0242.2016.01.A001.
[2]LiH, JiangC, WuD,et al. The prognostic and clinicopathologic characteristics of CD147 and esophagus cancer:a meta-analysis[J]. PLoS One,2017,12(7): e0180271. DOI: 10.1371/journal.pone.0180271.
[3]魏祯瑶,韩波.局部晚期食管癌放化疗综合治疗新进展[J].现代肿瘤医学,2016,24(20): 3319-3322. DOI: 10.3969/j.issn.1672-4992.2016.20.041.
WeiZY, HanB. New progress in locally advanced esophageal cancer comprehensive therapy[J]. Modern Oncology,2016,24(20): 3319-3322. DOI: 10.3969/j.issn.1672-4992.2016.20.041.
[4]TakebayashiK, TsubosaY, MatsudaS,et al. Comparison of curative surgery and definitive chemoradiotherapy as initial treatment for patients with cervical esophageal cancer[J]. Dis Esophagus,2017,30(2): 1-5. DOI: 10.1111/dote.12502.
[5]ShapiroJ, van LanschotJJB, MCCMH,et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer(CROSS):long-term results of a randomised controlled trial[J]. Lancet Oncol,2015,16(9): 1090-1098. DOI: 10.1016/S1470-2045(15)00040-6.
[6]LiJ, QinS, XuJ,et al. Randomized,double-blind,placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol,2016,34(13): 1448-1454. DOI: 10.1200/JCO.2015.63.5995.
[7]ShepardG, ArrowsmithER, MurphyP,et al. A phase Ⅱ study with lead-in safety cohort of 5-fluorouracil,oxaliplatin,and lapatinib in combination with radiation therapy as neoadjuvant treatment for patients with localized HER2-positive esophagogastric adenocarcinomas[J]. Oncologist,2017,22(10): 1152-e98. DOI: 10.1634/theoncologist.2017-0186.
[8]帖晓静,申凤乾,屈福莲,等.阿帕替尼联合替吉奥二线治疗复发转移食管癌疗效的初探[J].中国肿瘤生物治疗杂志,2017,24(11): 1315-1319. DOI: 10.3872/j.issn.1007-385x.2017.11.013.
TieXJ, ShenFQ, QuFL,et al. Preliminary exploration about efficacy of apatinib plus S-1 to remedy the patients with recurrent and metastatic esophageal cancer as the 2nd line therapy[J]. Chinese Journal of Cancer Biotherapy,2017,24(11): 1315-1319. DOI: 10.3872/j.issn.1007-385x.2017.11.013.
[9]王庭丰,吕进,周国志.卡铂、紫杉醇新辅助化疗对食管癌患者心脏功能的影响[J].山东医药,2016,56(6): 7-9. DOI: 10.3969/j.issn.1002-266X.2016.06.002.
WangTF, LyuJ, ZhouGZ,et al. Effects of carboplatin combined with paclitaxel in neoadjuvant chemotherapy on cardiac function of patients with esophageal cancer[J]. Shandong Medical Journal,2016,56(6): 7-9. DOI: 10.3969/j.issn.1002-266X.2016.06.002.
[10]GuptaB, KumarN. Worldwide incidence,mortality and time trends for cancer of the oesophagus[J]. Eur J Cancer Prev,2017,26(2): 107-118. DOI: 10.1097/CEJ.0000000000000249.
[11]张定富,吴秋芳,戈长征.卡培他滨同步放疗治疗晚期食管癌对患者生活质量的影响[J].癌症进展,2017,15(2): 166-168. DOI: 10.11877/j.issn.1672-1535.2017.15.02.18.
ZhangDF, WuQF, GeCZ,et al. Effect of capecitabine concurrent chemoradiotherapy on the quality of life of patients with advanced esophageal cancer[J]. Oncology Progress,2017,15(2): 166-168. DOI: 10.11877/j.issn.1672-1535.2017.15.02.18.
[12]秦叔逵,李进.阿帕替尼治疗胃癌的临床应用专家共识[J].临床肿瘤学杂志,2015,20(9): 841-847. DOI: 1009-0460(2015)09-0841-07.
QinSK, LiJ. Expert consensus on the clinical application of apatinib in the treatment of gastric cancer[J]. Chin Clin Oncol,2015,20(9): 841-847. DOI: 1009-0460(2015)09-0841-07.
[13]宋东,杨晓玲,冯慧晶,等.低剂量阿帕替尼治疗晚期恶性肿瘤的安全性及有效性分析[J].肿瘤研究与临床,2019,31(7): 469-473. DOI: 10.3760/cma.j.issn.1006-9801.2019.07.009.
SongD, YangXL, FengHJ,et al. Safety and efficacy analysis of low-dose apatinib in treatment of advanced malignant tumors [J]. Cancer Research and Clinic,2019,31(7): 469-473. DOI: 10.3760/cma.j.issn.1006-9801.2019.07.009.
[14]安改丽,李旭,黄尚科,等.阿帕替尼联合顺铂对食管癌ECA109细胞抑制作用及机制探讨[J].陕西医学杂志,2017,46(2): 148-151. DOI: 10.3969/j.issn.1000-7377.2017.02.004.
AnGL, LiX, HuangSK,et al. Study on the inhibitory effect of apatinib combined with cisplatin on ECA109 cells of esophageal carcinoma and its mechanism[J]. Shaanxi Medical Journal,2017,46(2): 148-151. DOI: 10.3969/j.issn.1000-7377.2017.02.004.
[15]李春杏,高玲燕,郑丽,等.阿帕替尼对晚期实体恶性肿瘤疗效和安全性Meta分析[J].中华肿瘤防治杂志,2018,25(15): 1113-1122. DOI: 10.16073/j.cnki.cjcpt.2018.15.014.
LiCX, GaoLY, ZhengL,et al. Meta-analysis of the effectiveness and safety of apatinib for advanced solid malignant tumor[J]. Chin J Cancer Prev Treat,2018,25(15): 1113-1122. DOI: 10.16073/j.cnki.cjcpt.2018.15.014.