肿瘤相关成纤维细胞的代谢重编程及其对肿瘤代谢重编程的调节
肿瘤相关成纤维细胞的代谢重编程及其对肿瘤代谢重编程的调节
司桂凡1*,周春仙2*,朱诗国1
Metabolic reprogramming of cancer-associated fibroblasts and its regulation to cancer cell repro-gramming
SI Guifan1*, ZHOU Chunxian2*, ZHU Shiguo1
作者单位
上海中医药大学基础医学院 1. 免疫学与病原生物学教研室;2. 病理教研室,上海 201203
基金项目
上海市自然科学基金(编号:19ZR1457500)
AUTHORS FROM
1. Department of Immunology and Pathogenic Biology; 2. Department of Pathology, School of Basic Medical Sciences, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
GRANT
Natural Science Foundation of Shanghai(No. 19ZR1457500)
[摘要]
肿瘤微环境中往往是缺氧状态且营养匮乏,因而肿瘤需要通过改变代谢以适应营养匮乏的环境。肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs),作为肿瘤微环境的主要成分对肿瘤的生长有重要影响。研究显示,CAFs能够通过自身发生代谢重编程,生成营养物质来维持肿瘤的生长;同时,CAFs能够调节肿瘤细胞的代谢重编程以适应肿瘤微环境。本文将就CAFs的代谢重编程以及对肿瘤细胞代谢重编程的调节作用作一综述,并讨论其可能的机制,以期为肿瘤治疗的靶点提供一些新的方向。
[关键词]肿瘤;癌相关成纤维细胞;肿瘤微环境;代谢重编程
[ABSTRACT]
The tumor microenvironment is hypoxic and nutrient-deficient, which makes the metabolism of the tumor change to adapt to the nutrient-deficient environment. Cancer-associated fibroblasts(CAFs), a major component in tumor microen-vironment, are regarded to play an important role in tumor growth. Study shows that the metabolism in CAFs can be reprogrammed and provide nutrients to cancer cells, thus support tumor growth. Meanwhile, CAFs regulate the metabolic reprogramming of cancer cells to adapt to the tumor microenvironment. This review summarizes the metabolic reprogramming of CAFs and the mechanisms of its regulation to cancer cell reprogramming. It will provide novel targets for the tumor therapy.
[Key words]Neoplasms; Cancer-associated fibroblasts; Tumor microenvironment; Metabolic reprogramming
肿瘤由肿瘤细胞及其所属的微环境组成,在微环境和遗传因素的环境选择压力诱导下,肿瘤内部发生进化,同时在基因型支配下,肿瘤的代谢特性发生适应性的改变,这一过程被称为代谢重编程[1]。研究显示,肿瘤的微环境往往存在营养匮乏的情况,因而肿瘤细胞为了维持其增殖能力会对其自身以及其微环境的代谢进行重编程[2]。代谢重编程是恶性肿瘤的标志。肿瘤的代谢重编程不仅发生在肿瘤细胞内,同样也发生在肿瘤微环境中。肿瘤微环境的代谢重编程同样被认为是癌症的标志之一,也是肿瘤研究的重要方向。
肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)是微环境的主要成分[3-4]。由于肿瘤细胞往往处于低氧和营养匮乏的环境中,因此肿瘤细胞以合成代谢为主,而CAFs则以分解代谢为主;有研究进一步提示肿瘤细胞的合成代谢与CAFs的分解代谢是耦合的,CAFs的分解代谢可为肿瘤细胞的生长提供重要的代谢物质[5-6]。肿瘤细胞与其CAFs相互促进代谢重编程,建立了一种共生关系。
1
CAFs代谢重编程
在肿瘤细胞的影响下,CAFs发生了代谢重编程。如三阴性乳腺癌(triple negative breast cancer,TNBC)细胞向其CAFs提供整合素-&β;4(整联蛋白 β 4,ITGB4)蛋白,ITGB4过表达则会诱导CAFs发生线粒体自噬进而增加其糖酵解水平[7]。YAN等[8]则揭示了另一种机制,乳腺癌细胞通过向CAFs传送微RNA(microRNA,miRNA),从而刺激CAFs中糖酵解相关基因[如己糖激酶2(hexokinase-2,HK2)、乳酸脱氢酶A(lactate dehydrogenase A,LDHA)和乳酸脱氢酶B(lactate dehydrogenase B,LDHB)等]以及葡萄糖转运载体[如溶质载体家族2成员1(solute carrier family 2 member 1,SLC2M1)、SLC16M1、SLC16M3和SLC1M5等]的表达,使CAFs对葡萄糖和谷氨酰胺分解水平上升,而其分解代谢产生的营养物质可以用于促进肿瘤生长。
上述研究提示,肿瘤细胞促进了CAFs的代谢重编程。此外,本研究总结了CAFs对于葡萄糖、氨基酸和脂质等营养物质的代谢特点以及这些代谢物质和肿瘤细胞之间的作用关系(图1)。
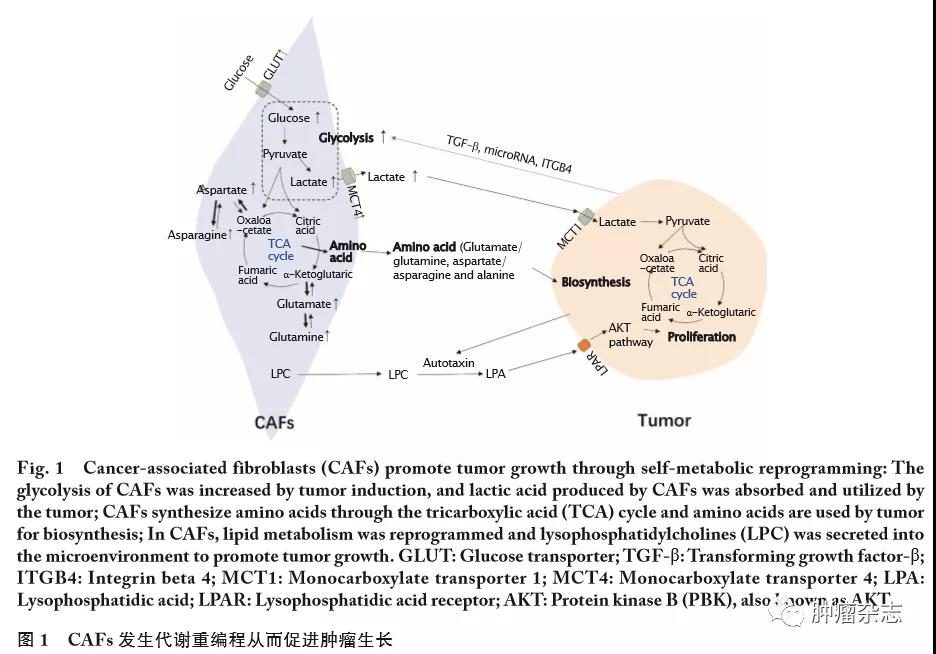
1.1
反向“Warburg效应”
在肿瘤细胞内,即使是有氧条件下,其糖酵解也十分活跃,表现为葡萄糖摄取增高,乳酸分泌增加,此现象被称为“Warburg效应”,又称“有氧糖酵解”。CAFs则会在肿瘤细胞的影响下,产生类似的有氧糖酵解现象,被称为“反向Warburg效应”[9]。CAFs的“反向Warburg效应”主要体现为葡萄糖代谢转变的特点。在正常的组织和细胞中,葡萄糖的代谢方式是氧化磷酸化;而与正常成纤维细胞相比,CAFs的代谢方式发生变化显著,其从氧化磷酸化向有氧糖酵解方向转变。ZHANG等[10]研究发现,与正常成纤维细胞相比,CAFs低水平表达三羧酸(tricarboxylic acid,TCA)循环的限速酶——异柠檬酸脱氢酶3&α;(isocitrate dehydrogenase 3&α;,IDH3&α;);IDH3&α;的低表达使CAFs的氧化磷酸化水平降低,从而转变为有氧糖酵解状态;另一方面,IDH3&α;的低表达使低氧诱导因子1&α;(hypoxia inducible factor 1&α;,HIF1&α;)在常氧条件下的稳定性增加,从而促进CAFs的糖酵解。BECKER等[11]研究同样发现,乳腺癌CAFs的糖酵解限速酶丙酮酸激酶(pyruvate kinase,PKM)和LDHA基因的启动子呈现低甲基化,从而导致PKM和LDHA表达水平升高。PKM和LDHA分别催化磷酸烯醇丙酮酸生成丙酮酸和丙酮酸转化为乳酸的过程,因而乳腺癌的CAFs表现出高度糖酵解。
CAFs糖酵解产生的乳酸被输出到细胞外,被肿瘤细胞吸收利用,从而促进肿瘤生长。FIASCHI等[12]研究发现,人前列腺癌(prostatic cancer,PCa)细胞可诱导其CAFs高表达葡萄糖转运蛋白1(glucose transporter 1,GLUT1)和单羧酸转运蛋白4(monocarboxylate transporter 4,MCT4),从而导致CAFs的葡萄糖摄取和乳酸输出水平增加;相反,PCa细胞接触CAFs后,PCa细胞的代谢被重编程,GLUT1表达减少,而MCT1表达增加,使得PCa细胞通过MCT1摄入乳酸的水平增加。因而,PCa细胞的生长不依赖于葡萄糖,而是通过利用CAFs生成的乳酸来支持其TCA循环、合成代谢和细胞增殖。抑制肿瘤细胞中的MCT1水平,即可阻断乳酸穿梭作用,使肿瘤的生长受到抑制。这项研究也体现了CAFs的糖酵解对肿瘤生长的意义,并描述了CAFs与肿瘤细胞之间乳酸穿梭的现象。
乳酸穿梭是指乳酸通过细胞膜上的MCT穿梭于肿瘤细胞与CAFs之间,CAFs通过MCT4输出乳酸,而肿瘤细胞通过MCT1输入乳酸[13]。WU等[14]在鼻咽癌中也观察到乳酸穿梭的现象,该研究发现抑制其CAFs中MCT4的表达水平后,鼻咽癌细胞的增殖、侵袭和集落形成能力均显著下降。另有研究发现,TNBC间质细胞高表达MCT4的患者预后较差[15]。上述研究均提示,阻断肿瘤细胞与CAFs间的乳酸穿梭可以抑制肿瘤的生长。
另一方面,也有研究发现肿瘤细胞通过“Warburg效应”生成的乳酸被CAFs利用[16],从而进一步促进肿瘤进展。PATEL等[17]研究发现,乳腺癌的CAFs吸收并利用了乳腺癌细胞产生的乳酸。研究认为这一现象一方面减少了CAFs对葡萄糖的吸收利用,从而使更多的葡萄糖供给乳腺癌细胞;另一方面乳酸进入CAFs后被氧化生成丙酮酸,丙酮酸被乳腺癌细胞吸收,并通过TCA循环,参与生物合成,为乳腺癌细胞提供能量,并促进肿瘤细胞生长。虽然研究结论有差异,但是依然反映了CAFs与肿瘤细胞之间存在乳酸穿梭现象,体现了CAFs与肿瘤细胞间的糖代谢相互联系及相互协调作用。
1.2
氨基酸代谢
氨基酸是肿瘤生长发育所必需的重要营养物质,很多研究表明CAFs可以通过TCA循环合成肿瘤细胞生长所需的氨基酸。
谷氨酰胺作为重要的碳源和氮源,在肿瘤的合成代谢中发挥着关键作用[18],降低肿瘤微环境中谷氨酰胺的水平则会影响肿瘤细胞的生存能力[19]。一般情况下,CAFs可以适应谷氨酰胺缺乏的环境,并帮助肿瘤细胞应对谷氨酰胺缺失的情况。研究发现,PCa的CAFs中低表达p62[20],而LINARES等[21]的研究则在PCa中发现,敲除p62基因的CAFs能够抵抗谷氨酰胺的缺乏,维持PCa细胞的生长。在p62基因缺失的CAFs中,天冬酰胺合酶(asparagine synthase,ASNS)和丙酮酸羧化酶(pyruvate carboxylase,PC)的表达量上升。ASNS可介导天冬氨酸合成天冬酰胺,而PC则介导了丙酮酸生成草酰乙酸的过程,是丙酮酸进入TCA循环的途径。ASNS和PC表达上升表明TCA循环增强,其中间产物的衍生物天冬氨酸和天冬酰胺水平增加。p62缺失的CAFs产生的天冬氨酸和天冬酰胺,为PCa细胞的生长提供了氮源,从而维持PCa细胞在谷氨酰胺缺失环境下的生存。
除了生成其他氨基酸作为氮源,CAFs还能够直接合成谷氨酰胺,为肿瘤细胞提供营养。YANG等[22]在对卵巢癌研究中观察到,谷氨酰胺匮乏时,卵巢癌CAFs自身可以利用乳酸、天冬氨酸和天冬酰胺作为碳源和氮源来合成谷氨酰胺。此外,卵巢癌细胞可以增强其CAFs利用不同营养合成谷氨酰胺的能力。在谷氨酰胺缺失时,卵巢癌细胞生成的谷氨酸会被其CAFs吸收,并通过谷氨酰胺合成酶(glutamate-ammonia ligase,GLUL)生成谷氨酰胺。而CAFs生成的谷氨酰胺则被卵巢癌细胞吸收利用,以应对肿瘤微环境的营养匮乏,进而促进卵巢癌的发展。这一过程也体现了CAFs的谷氨酰胺合成代谢与癌细胞的谷氨酰胺分解代谢是相互串联的。
另有研究发现,人皮肤鳞癌细胞及其CAFs之间也存在氨基酸代谢的串联现象。天冬氨酸和谷氨酸通过天冬氨酸/谷氨酸转运体——溶质载体家族1成员3(solute carrier family 1 membrane 3,SLC1A3)通道在人皮肤鳞癌细胞和其CAFs之间进行交换。癌细胞来源的谷氨酸进入CAFs,一方面谷氨酸通过CAFs的TCA循环生成天冬氨酸,CAFs生成的天冬氨酸进入人皮肤鳞癌细胞用于生物合成,维持细胞增殖;另一方面肿瘤细胞来源的谷氨酸在CAFs内形成谷胱甘肽(glutathione,GSH)来平衡细胞的氧化还原状态,促进细胞外基质(extracellular matrix,ECM)重构[23]。
由此可见肿瘤细胞与CAFs之间形成氨基酸代谢藕联,一方面可以应对肿瘤微环境中营养匮乏的现象;另一方面,肿瘤可以更高效、快速地利用氨基酸来促进肿瘤的生长发展。
1.3
脂质代谢
如同葡萄糖和氨基酸,CAFs的脂质代谢也发生了改变。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)中的胰腺星状细胞(pancreatic stellate cells,PSCs)在被活化的过程中经历了脂质代谢转变,细胞内脂质体发生重塑。PSCs在被活化的过程中中性脂质消失,细胞内的溶血磷脂水平急剧上升。在这一过程中,溶血磷脂酰胆碱类(lysophosphatidylcholines,LPCs)大量分泌到肿瘤微环境中,一部分直接被PDAC细胞吸收利用,用于膜脂的形成;另一部分LPC由PDAC细胞分泌的自分泌运动因子(autotaxin,ATX)水解生成溶血磷脂酸(lysophosphatidic acid,LPA),通过LPA受体(lysophosphatidic acid receptor,LPAR)激活PDAC细胞的蛋白激酶B(protein kinase B,PBK,又称AKT)通路[24]。ATX/LPA/LPAR这一信号通路对肿瘤的生长、增殖和代谢都产生影响,是肝癌、非小细胞肺癌、卵巢癌、胰腺癌和甲状腺癌等众多肿瘤的潜在治疗靶点[25]。
GONG等[26]对结直肠癌(colorectal cancer,CRC)迁移功能的研究也证明了,其CAFs经历了脂质体代谢重编程。CAFs中由于脂肪酸合酶(fatty acids synthase,FASN)表达增加,生成更多的脂肪酸被CRC细胞吸收,从而促进CRC细胞的迁移能力。
2
CAFs对肿瘤细胞代谢重编程的调节作用
CAFs不仅自身发生代谢重编程,同时也在肿瘤细胞代谢重编程的过程中发挥着重要作用。CAFs通过多种方式调节肿瘤细胞的代谢:(1)直接分泌细胞因子;(2)或参与ECM的形成;(3)或通过细胞外囊泡(extracellular vesicles,EVs)这一介质,传递信息和营养,进而触发肿瘤细胞内的信号通路;(4)或调节肿瘤细胞的代谢酶活性对肿瘤进行代谢重编程;(5)或提供线粒体;(6)或增加肿瘤氧化性(图2)。
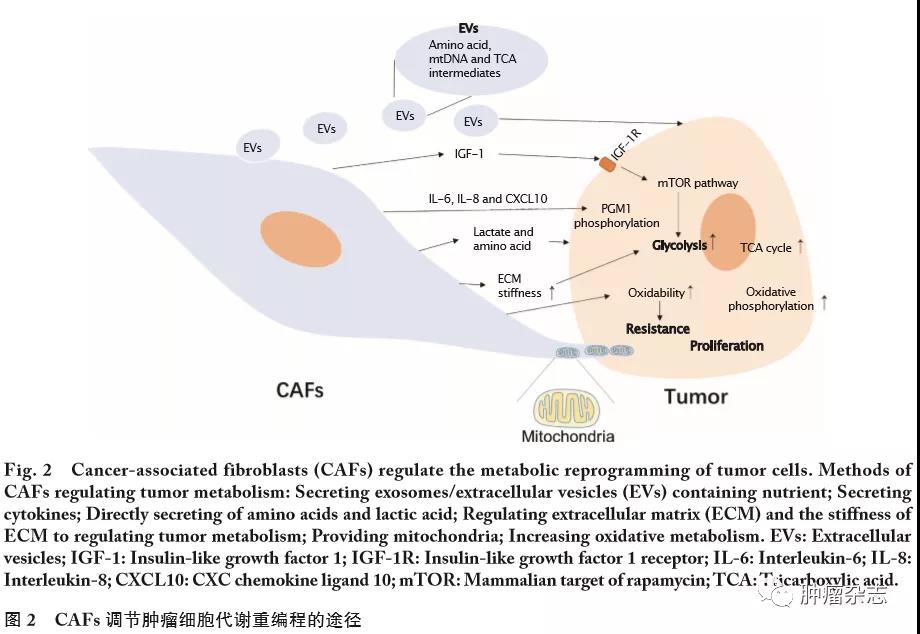
2.1
直接输出营养物质
前文提及CAFs通过分解代谢生成营养物质,营养物质被肿瘤细胞吸收利用,从而维持肿瘤的生长,目前已研究报道证实了这一现象。SOUSA等[27]在PDAC中观察到,PSCs细胞受癌细胞刺激发生自噬,自噬的PSCs细胞输出丙氨酸为癌细胞提供能量,从而缓解了PDAC细胞对葡萄糖和谷氨酰胺来源的碳需求,减少了PDAC对葡萄糖和血清来源营养素的依赖。MISHRA等[28] 在研究中发现,在PCa来源的CAFs中RAS蛋白激活因子样3(RAS protein activator like 3,RASAL3)即RAS抑制剂的启动子高甲基化,导致RASAL3表达水平低。因此沉默RASAL3表达将有助于RAS通路的激活,进而刺激CAFs通过内吞作用将白蛋白转运至溶酶体降解并释放谷氨酰胺。CAFs生成的谷氨酰胺被PCa细胞吸收后,增加PCa细胞的TCA循环的通量,增强线粒体功能和ATP生成,促进肿瘤生长。
2.2
EVs
CAFs不仅直接分泌营养物质到微环境中,还通过介质向肿瘤转移营养物质。EVs介导肿瘤微环境各成分之间的细胞间通讯。外泌体是一种直径为30~100 nm的EVs。CAFs通过外泌体向营养缺乏的肿瘤细胞提供氨基酸等营养物质,使肿瘤细胞在营养缺乏的条件下进行中心碳代谢,从而促进肿瘤生长[29]。在ACHREJA等[30]对PDAC细胞的研究同样发现,其CAFs分泌的外泌体中含有大量的氨基酸(丝氨酸、甘氨酸、丙氨酸和谷氨酸等)、TCA循环中间产物(柠檬酸、&α;-酮戊二酸、琥珀酸和苹果酸等)以及丙酮酸等营养物质,能够在肿瘤微环境营养匮乏时维持肿瘤的生长。PDAC的CAFs来源的外泌体会被肿瘤细胞在24 h内迅速内化,外泌体内的营养物质提供了35%的TCA循环中间产物增加肿瘤的TCA循环通量。
除了提供营养物质,CAFs来源的EVs还可向肿瘤细胞提供线粒体基因组。在耐药的乳腺癌中,CAFs完整的线粒体基因组(mitochondrial DNA,mtDNA)包装在EVs中,通过EVs这一中介转移到乳腺癌细胞内。CAFs来源的mtDNA能够在乳腺癌细胞内完整表达,并增加肿瘤氧化磷酸化水平和线粒体代谢水平,增加肿瘤的氧化性,进一步使肿瘤产生耐药性,以及肿瘤干细胞的自我更新潜能增加[31]。
2.3
线粒体
线粒体功能的改变显著调节了肿瘤的代谢[18],出人意料的是CAFs可将自身的线粒体提供给肿瘤细胞。ZHANG等[32]的研究在体内和体外都观察到成纤维细胞向口腔鳞状细胞癌输出线粒体。IPPOLITO等[33]在PCa中观测到其CAFs的线粒体通过胞质桥(cytoplasmic bridges)单向的转移到PCa细胞的现象。然而这些研究都没有阐述CAFs来源的线粒体在肿瘤细胞内的功能和影响。
2.4
直接靶向代谢相关信号通路
靶向代谢酶是调节肿瘤细胞代谢的直接且重要的途径。卵巢癌细胞通过转化生长因子&β;(transforming growth factor-&β;,TGF-&β;)诱导其CAFs分泌白细胞介素6(interleukin-6,IL-6)、IL-8和趋化因子10(chemokine 10,CXCL10)等细胞因子;而CAFs分泌的这些细胞因子诱导卵巢癌细胞的葡萄糖磷酸变位酶1(phosphoglucomutase 1,PGM1)磷酸化,从而促进卵巢癌细胞的糖原分解代谢,糖酵解和戊糖磷酸途径的增加,导致卵巢癌的增殖、侵袭和早期转移[34]。
在头颈鳞癌(head and neck squamous cell carcinomas,HNSCC)的研究中发现,在HNSCC细胞生成的乳酸的影响下,其CAFs分泌大量的肝细胞生长因子(hepatocyte growth factor,HGF)。CAFs分泌的HGF,反之诱导HNSCC细胞的糖酵解的关键酶(己糖激酶Ⅱ和磷酸果糖激酶)的上调,从而促进HNSCC细胞发生糖酵解[35]。
除了影响代谢途径的关键酶,CAFs也可影响肿瘤细胞中代谢相关的信号通路。TOMMELEIN等[36]报道提示,对CRC行术前放射治疗(preoperative radiotherapy,RT)会诱导CAFs分泌胰岛素样生长因子1(insulin-like growth factor 1,IGF-1);IGF-1与CRC细胞上IGF-1受体结合后,可激活CRC细胞内的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,引起葡萄糖摄取和乳酸盐释放,增加CRC细胞通道蛋白SLC7A11(solute carrier family 7,membrane 11)表达,促进CRC细胞对谷氨酰胺吸收。通过这一过程CRC对RT治疗的抵抗性增强。
2.5
ECM
ECM是细胞感应的重要信号来源,对细胞的增殖、分化、侵袭转移和耐药都有重要的影响[37]。ECM能够调节肿瘤细胞的代谢[38]。在肿瘤发生的过程中,CAFs通过分泌与基质重构相关的酶[39],从而介导ECM的形成[40]。在人皮肤鳞癌细胞中,其CAFs促进ECM的硬化,而ECM的硬化可激活鳞癌细胞中Yes相关蛋白(Yes-associated protein,YAP)/转录共激活因子PDZ结合基序(transcriptional co-activator with PDZ-binding motif,TAZ)通路,并诱导YAP下游基因谷氨酰胺酶(glutaminase,GLS1)、LDHA和SLC1A3的表达,从而激活肿瘤细胞的糖酵解途径和谷氨酰胺代谢途径;并且ECM的硬化诱导鳞癌细胞和其CAFs进行氨基酸交换,促进肿瘤的增殖[23]。
2.6
氧化还原状态
肿瘤的氧化还原状态往往处于失衡状态,表现为活性氧水平的增高,这对肿瘤的耐药和免疫耐受均有重要意义。
BROEKGAARDEN等[41]在小鼠PDAC细胞的异种移植瘤模型中,与注射单纯的PDAC细胞的肿瘤相比,PDAC细胞和CAFs共同植入的肿瘤,其氧化状态增加,并且对奥沙利铂的耐药性明显增加,半数抑制浓度(half maximal inhibitory concentration,IC50)增加了1.5倍。线粒体复合物Ⅰ的抑制剂二甲双胍能够抑制细胞的氧化水平。对PDAC和CAFs共植入的PDAC模型使用二甲双胍抑制其氧化水平后,其耐药性显著降低,IC50值降低50%。这体现了CAFs的存在增加了肿瘤的氧化性,使肿瘤产生耐药性。在小鼠体内治疗时,用二甲双胍抑制肿瘤模型的氧化水平,肿瘤对奥沙利铂和光动力疗法治疗的敏感性增加。
3
靶向CAFs代谢重编程是肿瘤治疗的新策略
肿瘤要生存必须面对营养匮乏的肿瘤微环境,CAFs则协助肿瘤应对营养匮乏,维持肿瘤的生长、转移和耐药[6]。CAFs一方面在肿瘤细胞的诱导下发生代谢重编程,使有氧糖酵解增加,产生大量的代谢产物,生成营养物质为肿瘤提供能量和营养,维持肿瘤的生物合成;另一方面,肿瘤细胞需要代谢重编程应对肿瘤微环境的营养压力,CAFs通过各种方式参与并促进肿瘤代谢重编程的进行。
目前有越来越多的研究关注肿瘤代谢方向,其中CAFs对肿瘤代谢重编程的调节是重要方向,并且具有研究价值[42]。众多的研究表明,CAFs的存在诱导了肿瘤的代谢重编程,促进肿瘤对营养匮乏的适应性,并维持肿瘤的发生和发展[28]。较多体内研究也表明,抑制CAFs和肿瘤细胞之间的物质交换,如乳酸穿梭[7]和氨基酸交换[22],能够显著抑制肿瘤的生长。同时,CAFs的代谢重编程也导致了临床上患者对药物的耐受性[41]。
然而,现阶段的研究基本还停留在基础研究层面,临床研究方面的资料尚缺乏;但依然能够看出CAFs的代谢调节作用是一个潜在的治疗靶点,笔者认为代谢调节作用必将进一步引起研究者更广泛的关注。
更多《肿瘤》杂志文章,请访问以下网址:
https://navi.cnki.net/knavi/JournalDetail?pcode=CJFD&pykm=ZZLL
参考文献
[1]FAUBERT B, SOLMONSON A, DEBERARDINIS RJ. Metabolic reprogramming and cancer progression[J]. Science, 2020, 368(6487):eaaw5473.
[2]ZHANG W, BOUCHARD G, YU A, et al. GFPT2-expressing cancer-associated fibroblasts mediate metabolic reprogramming in human lung adenocarcinoma [J]. Cancer Res, 2018, 78(13):3445-3457.
[3]VON AHRENS D, BHAGAT TD, NAGRATH D, et al. The role of stromal cancer-associated fibroblasts in pancreatic cancer [J]. J Hematol Oncol, 2017, 10(1):76.
[4]BUCHSBAUM RJ, OH SY. Breast cancer-associated fibroblasts: Where we are and where we need to go [J]. Cancers(Basel), 2016, 8(2):19.
[5]AVAGLIANO A, GRANATO G, RUOCCO MR, et al. Metabolic reprogramming of cancer associated fibroblasts: The slavery of stromal fibroblasts[J]. Biomed Res Int, 2018, 2018:6075403.
[6]WU D, ZHUO L, WANG X. Metabolic reprogramming of carcinoma-associated fibroblasts and its impact on metabolic heterogeneity of tumors[J]. Semin Cell Dev Biol, 2017, 64:125-131.
[7]SUNG JS, KANG CW, KANG S, et al. ITGB4-mediated metabolic reprogramming of cancer-associated fibroblasts[J]. Oncogene, 2020, 39(3):664-676.
[8]YAN W, WU X, ZHOU W, et al. Cancer-cell-secreted exosomal mir-105 promotes tumour growth through the MYC-dependent metabolic reprogramming of stromal cells[J]. Nat Cell Biol, 2018, 20(5):597-609.
[9]PAVLIDES S, WHITAKER-MENEZES D, CASTELLO-CROS R, et al. The reverse Warburg effect: Aerobic glycolysis in cancer associated fibroblasts and the tumor stroma[J]. Cell Cycle, 2009, 8(23):3984-4001.
[10]ZHANG D, WANG Y, SHI Z, et al. Metabolic reprogramming of cancer-associated fibroblasts by IDH3&α; downregulation[J]. Cell Rep, 2015, 10(8):1335-1348.
[11]BECKER LM, O’CONNELL JT, VO AP, et al. Epigenetic reprogramming of cancer-associated fibroblasts deregulates glucose metabolism and facilitates progression of breast cancer[J]. Cell Rep, 2020, 31(9):107701.
[12]FIASCHI T, MARINI A, GIANNONI E, et al. Reciprocal metabolic reprogramming through lactate shuttle coordinately influences tumor-stroma interplay[J]. Cancer Res, 2012, 72(19):5130-5140.
[13]ROY A, BERA S. CAF cellular glycolysis: Linking cancer cells with the microenvironment[J]. Tumour Biol, 2016, 37(7):8503-8514.
[14]WU X, ZHOU Z, XU S, et al. Extracellular vesicle packaged LMP1-activated fibroblasts promote tumor progression via autophagy and stroma-tumor metabolism coupling[J]. Cancer Lett, 2020, 478:93-106.
[15]WITKIEWICZ AK, WHITAKER-MENEZES D, DASGUPTA A, et al. Using the “reverse Warburg effect” to identify high-risk breast cancer patients: Stromal MCT4 predicts poor clinical outcome in triple-negative breast cancers[J]. Cell Cycle, 2012, 11(6):1108-1117.
[16]BHAGAT TD, VON AHRENS D, DAWLATY M, et al. Lactate-mediated epigenetic reprogramming regulates formation of human pancreatic cancer-associated fibroblasts[J]. Elife, 2019, 8:e50663.
[17]PATEL BB, ACKERSTAFF E, SERGANOVA IS, et al. Tumor stroma interaction is mediated by monocarboxylate metabolism[J]. Exp Cell Res, 2017, 352(1):20-33.
[18]AHN CS, METALLO CM. Mitochondria as biosynthetic factories for cancer proliferation[J]. Cancer Metab, 2015, 3(1):1.
[19] LEONE RD, ZHAO L, ENGLERT JM, et al. Glutamine blockade induces divergent metabolic programs to overcome tumor immune evasion[J]. Science, 2019, 366(6468):1013-1021.
[20]VALENCIA T, KIM JY, ABU-BAKER S, et al. Metabolic reprogramming of stromal fibroblasts through p62-mTORC1 signaling promotes inflammation and tumorigenesis[J]. Cancer Cell, 2014, 26(1):121-135.
[21]LINARES JF, CORDES T, DURAN A, et al. ATF4-induced metabolic reprograming is a synthetic vulnerability of the p62-deficient tumor stroma[J]. Cell Metab, 2017, 26(6):817-829.e6.
[22]YANG L, ACHREJA A, YEUNG TL, et al. Targeting stromal glutamine synthetase in tumors disrupts tumor microenvironment-regulated cancer cell growth[J]. Cell Metab, 2016, 24(5):685-700.
[23]BERTERO T, OLDHAM WM, GRASSET EM, et al. Tumor-stroma mechanics coordinate amino acid availability to sustain tumor growth and malignancy[J]. Cell Metab, 2019, 29(1):124-140.e10.
[24]AUCIELLO FR, BULUSU V, OON C, et al. A stromal lysolipid-autotaxin signaling axis promotes pancreatic tumor progression[J]. Cancer Discov, 2019, 9(5):617-627.
[25]KAFFE E, MAGKRIOTI C, AIDINIS V. Deregulated lysophosphatidic acid metabolism and signaling in liver cancer[J]. Cancers(Basel), 2019, 11(11):1626.
[26]GONG J, LIN Y, ZHANG H, et al. Reprogramming of lipid metabolism in cancer-associated fibroblasts potentiates migration of colorectal cancer cells[J]. Cell Death Dis, 2020, 11(4):267.
[27]SOUSA CM, BIANCUR DE, WANG X, et al. Pancreatic stellate cells support tumour metabolism through autophagic alanine secretion[J]. Nature, 2016, 536(7617):479-483.
[28]MISHRA R, HALDAR S, PLACENCIO V, et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming[J]. J Clin Invest, 2018, 128(10):4472-4484.
[29]ZHAO H, YANG L, BADDOUR J, et al. Tumor microenvironment derived exosomes pleiotropically modulate cancer cell metabolism[J]. Elife, 2016, 5:e10250.
[30]ACHREJA A, ZHAO H, YANG L, et al. Exo-MFA-A 13C metabolic flux analysis framework to dissect tumor microenvironment-secreted exosome contributions towards cancer cell metabolism[J]. Metab Eng, 2017, 43(Pt B):156-172.
[31]SANSONE P, SAVINI C, KURELAC I, et al. Packaging and transfer of mitochondrial DNA via exosomes regulate escape from dormancy in hormonal therapy-resistant breast cancer[J]. Proc Natl Acad Sci U S A, 2017, 114(43):E9066-E9075.
[32]ZHANG Z, GAO Z, RAJTHALA S, et al. Metabolic reprogramming of normal oral fibroblasts correlated with increased glycolytic metabolism of oral squamous cell carcinoma and precedes their activation into carcinoma associated fibroblasts[J]. Cell Mol Life Sci, 2020, 77(6):1115-1133.
[33]IPPOLITO L, MORANDI A, TADDEI ML, et al. Cancer-associated fibroblasts promote prostate cancer malignancy via metabolic rewiring and mitochondrial transfer[J]. Oncogene, 2019, 38(27):5339-5355.
[34]CURTIS M, KENNY HA, ASHCROFT B, et al. Fibroblasts mobilize tumor cell glycogen to promote proliferation and metastasis[J]. Cell Metab, 2019, 29(1):141-155.e9.
[35]KUMAR D, NEW J, VISHWAKARMA V,et al. Cancer-associated fibroblasts drive glycolysis in a targetable signaling loop implicated in head and neck squamous cell carcinoma progression[J]. Cancer Res, 2018, 78(14):3769-3782.
[36]TOMMELEIN J, DE VLIEGHERE E, VERSET L, et al. Radiotherapy-activated cancer-associated fibroblasts promote tumor progression through paracrine IGF1R activation[J]. Cancer Res, 2018, 78(3):659-670.
[37]ZANCONATO F, CORDENONSI M, PICCOLO S. YAP and TAZ: A signalling hub of the tumour microenvironment[J]. Nat Rev Cancer, 2019, 19(8):454-464.
[38]SULLIVAN WJ, MULLEN PJ, SCHMID EW,et al. Extracellular matrix remodeling regulates glucose metabolism through TXNIP destabilization[J]. Cell, 2018, 175(1):117-132.e21.
[39]PICKUP MW, MOUW JK, WEAVER VM.The extracellular matrix modulates the hallmarks of cancer[J]. EMBO Rep, 2014, 15(12):1243-1253.
[40]CHEN X, SONG E. Turning foes to friends: Targeting cancer-associated fibroblasts[J]. Nat Rev Drug Discov, 2019, 18(2):99-115.
[41]BROEKGAARDEN M, ANBIL S, BULIN AL, et al. Modulation of redox metabolism negates cancer-associated fibroblasts-induced treatment resistance in a heterotypic 3D culture platform of pancreatic cancer[J]. Biomaterials, 2019, 222:119421.
[42]NAJAFI M, MORTEZAEE K, MAJIDPOOR J. Stromal reprogramming: A target for tumor therapy[J]. Life Sci, 2019, 239:117049.