G蛋白偶联受体30对子宫内膜癌细胞增殖及凋亡的影响及其机制探讨
G蛋白偶联受体30对子宫内膜癌细胞增殖及凋亡的影响及其机制探讨
叶 佳1,瞿秋婵2,张 阳1,马锦琪1,沈 梅1, 张金伟1
Effects of G protein-coupled receptor 30 on proliferation and apoptosis of endometrial carcinoma cells and its possible mechanism
YE Jia1, QU Qiuchan2, ZHANG Yang1, MA Jinqi1, SHEN Mei1, ZHANG Jinwei1
作者单位
1. 南京医科大学附属无锡人民医院妇产科,江苏 无锡 214023;2. 南通大学附属妇幼保健院妇产科,江苏 南通 226000
基金项目
1. 无锡市卫生计生委科研项目(编号:Q201709)
2. 无锡市卫生计生委妇幼健康科研项目(编号:FYKY201705、FYKY201807、FYKY201905)
3. 南通市科技计划项目(编号:YYZ17025)
AUTHORS FROM
1. Department of Obstetrics and Gynecology, Affiliated Wuxi People’s Hospital of Nanjing Medical University, Wuxi 214023, Jiangsu Province, China; 2. Department of Obstetrics and Gynecology, Nantong Maternity and Child Health Care Hospital, Nantong University, Nantong 226000, Jiangsu Province, China
GRANT
1. Scientific Research Project of Wuxi Health and Family Planning Commission(No. Q201709)
2. Maternal and Child Health Research Project of Wuxi Health and Family Planning Commission(No. FYKY201705; FYKY201807; FYKY201905)
3. Nantong Science and Technology Program(No. YYZ17025)
[摘要]
目的:研究G蛋白偶联受体30( G protein-coupled receptor 30,GPR30)对子宫内膜癌细胞增殖及凋亡能力的影响,并探讨其可能的作用机制。
方法:将靶向GPR30的shRNA(shRNA-GPR30)或携带有GPR30全基因的慢病毒(LV-GPR30)分别导入子宫内膜癌Ishikawa和KLE细胞中,构建沉默GPR30和过表达GPR30的细胞株,然后用蛋白质印迹法检测转染效率。采用CCK-8法检测沉默或过表达GPR30对子宫内膜癌细胞增殖能力的影响,采用FCM法检测沉默或过表达GPR30对子宫内膜癌细胞凋亡能力的影响。采用实时荧光定量PCR及蛋白质印迹法检测沉默或过表达GPR30对内质网应激标志蛋白葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)和内质网应激的未折叠蛋白反应信号通路关键分子蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)、肌醇需求酶1(inositol-requiring enzyme 1,IRE1)、活化转录因子6(activating transcription factor 6,ATF6)的表达水平变化。
结果:GPR30分别在Ishikawa和KLE细胞中被沉默或过表达。沉默GPR30后,子宫内膜癌细胞的增殖能力下降,凋亡率升高(P 值均<0.01);过表达GPR30后,子宫内膜癌细胞的增殖能力增强,凋亡率降低(P 值均<0.01)。沉默GPR30可下调子宫内膜癌细胞中GRP78、PERK、IRE1和ATF6的表达水平,过表达GPR30可上调子宫内膜癌中GRP78、PERK、IRE1和ATF6的表达(P值均<0.01)。
结论:沉默GPR30可抑制子宫内膜癌细胞的增殖能力,促进细胞凋亡;过表达GPR30可促进子宫内膜癌细胞的增殖能力,并抑制细胞凋亡。推测该机制可能与内质网应激途径的未折叠蛋白反应有关。
[关键词]子宫内膜肿瘤;内质网应激;未折叠蛋白质应答;G蛋白偶联受体30;葡萄糖调节蛋白78
[ABSTRACT]
Objective: To investigate the effects of G protein-coupled receptor 30(GPR30) on the proliferation and apoptosis of human endometrial cancer cells, and to explore its possible mechanism.
Methods: ShRNA targeted GPR30(shRNA-GPR30) and lentivirus carrying GPR30(LV-GPR30) were used to transfected or infected into endometrial cancer cells, respectively. GPR30 silenced and overexpressed cells were constructed to detect the transfection efficiency by Western blotting. The effect of silencing or overexpression GPR30 on the proliferation of endometrial carcinoma cells was detected by CCK-8 method. The effects of GPR30 silence or overexpression on the apoptosis of endometrial cancer cells were detected by flow cytometry. The expressions of endoplasmic reticulum stress marker glucose-regulated protein-78(GRP78) and the key molecules including protein kinase R-like endoplasmic reticulum kinase(PERK), inositol-requiring enzyme 1(IRE1), and activating transcription factor 6(ATF6) in unfolded protein reactive signaling pathway in the two endometrial cancer cells with GPR30 silence or overexpression were detected by real-time fluorescence quantitative PCR and Western blotting.
Results: GPR30 was silenced and overexpressed in Ishikawa and KLE cells transfected with shRNA-GPR30 and infected with LV-GPR30, respectively. After GPR30 was silenced, the proliferative capacity of endometrial cancer cells was decreased and the apoptosis was increased(all P < 0.01). On the contrary, after GPR30 was overexpressed, the proliferative capacity of endometrial cancer cells was increased and the apoptosis was decreased(all P < 0.01). GPR30 silencing could down-regulate the expressions of GRP78, PERK, IRE1, and ATF6 in endometrial cancer cells(all P < 0.01), while the overexpressing GPR30 could up-regulate the expressions of GRP78, PERK, IRE1, and ATF6 in endometrial cancer cells(all P < 0.01).
Conclusion: Silencing GPR30 can inhibit the proliferation of endometrial cancer cells and promote apoptosis. Overexpression of GPR30 can promote the proliferation of endometrial cancer cells and inhibit apoptosis. The mechanism may be related to the unfolded protein response in endoplasmic reticulum stress pathway.
[Key words]Endometrial neoplasms; Endoplasmic reticulum stress; Unfolded protein response; G protein-coupled receptor 30; Glucose-regulated protein 78
中国子宫内膜癌发病率占女性生殖系统恶性肿瘤的第2位,且逐年上升,有赶超宫颈癌的趋势,对女性健康有严重危害。无孕激素拮抗的雌激素长期作用可增加患子宫内膜癌的风险,但雌激素致子宫内膜癌的确切机制仍不十分清楚[1]。
G蛋白偶联受体30(G protein-coupled receptor 30,GPR30)作为一种新型的雌激素受体,在子宫内膜癌组织中表达水平高于正常的子宫内膜。雌二醇激活GPR30后可促进子宫内膜癌细胞增殖和侵袭,提示GPR30与子宫内膜癌的发生和发展相关[2],但GPR30致子宫内膜癌的机制尚不明了。本课题组前期研究发现,GPR30亚定位于子宫内膜癌Ishikawa细胞的内质网中[3],而内质网应激可以诱发肿瘤的发生、发展及治疗抗拒性[4]。本课题组研究还发现子宫内膜癌组织中GPR30和内质网应激标志蛋白葡萄糖调节蛋白78(glucose-regulated protein-78,GRP78)的表达水平均高于正常增殖期组织、增生不伴不典型增生组织和不典型性增生组织,其阳性表达程度与子宫内膜恶性程度有关;GPR30与GRP78的表达在内膜癌组织中呈正相关,初步提示两者间存在共表达的交互或调节作用[5]。
为进一步探讨GPR30是否可能通过内质网应激途径对子宫内膜癌细胞发挥作用,本研究通过构建沉默及过表达GPR30的子宫内膜癌细胞株,观察GPR30对子宫内膜癌细胞增殖和凋亡能力的影响,并初步探讨其作用机制。
1 材料与方法
1.1
细胞及试剂
人子宫内膜癌Ishikawa细胞和KLE细胞购自复旦IBS细胞资源中心。DMEM/F12培养液、胎牛血清(fetal bovine serum,FBS)和Opti-MEM培养液购自美国Gibco公司。靶向GPR30的3条shRNA(shRNA-GPR30-1、shRNA-GPR30-2、shRNA -GPR30-3)及其阴性对照shRNA(shRNA-negative control,shRNA-NC)、GPR30过表达慢病毒(LV-GPR30)和对照空载体病毒(Vector)购自上海瑞鹿生物技术有限公司。脂质体转染试剂LipofectAMINE™ 2000和TRIzol试剂购自美国Invitrogen公司。质粒抽提试剂框购自美国OMEGA公司。RIPA蛋白裂解液购自基尔顿生物科技(上海)公司。BCA蛋白定量试剂框和实时荧光定量PCR试剂框购自美国Thermo Fisher公司。反转录试剂框购自加拿大Fermentas公司。PCR引物由生工生物工程(上海)股份有限公司设计并合成。CCK-8试剂框购自美国SAB公司。兔抗人GPR30多克隆抗体、兔抗人GRP78多克隆抗体、兔抗人蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)多克隆抗体、兔抗人肌醇需求酶1(inositol-requiring enzyme 1,IRE1)多克隆抗体和兔抗人活化转录因子6(activating transcription factor 6,ATF6)多克隆抗体购自美国Abcam公司。鼠抗人GAPDH单克隆抗体购自美国CST公司。辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗兔IgG和羊抗鼠IgG和AnnexinⅤ-FITC细胞凋亡检测试剂框购自上海碧云天生物技术有限公司。
1.2
方法
1.2.1
细胞培养
Ishikawa细胞(雌激素受体&α;和&β;阳性、高分化)和KLE细胞(雌激素受体&α;和&β;阴性、低分化)用含10 % FBS、1%双抗(青链霉素混合液)的DMEM/F12培养液,置于37 ℃、CO2体积分数为5%的培养箱中进行培养,每2 d更换1次培养液。当细胞融合率为70%~80%时,用0.25%胰蛋白酶消化并传代。细胞均贴壁生长。
1.2.2
GPR30 shRNA转染Ishikawa和KLE细胞
将Ishikawa细胞以4×105个/孔的密度接种于6孔板中,培养24 h待贴壁细胞达70%~80%的融合度时,按照脂质体转染试剂框LipofectAMINE™ 2000操作说明书将GPR30 sh RNA转染入Ishikawa细胞。实验分为对照组(Control)、阴性对照组(shRNA-NC)和shRNA-GPR30组(shRNA-GPR30-1、shRNA-GPR30-2和shRNA -GPR30-3)。3条靶向GPR30的shRNA序列见表1。转染6 h后将无血清的Opti-MEM培养液弃去,更换为含10 % FBS的完全培养液,继续培养24 h后收集各组细胞并提取总RNA,48 h后收集各组细胞并提取总蛋白。采用蛋白质印迹法验证干扰效率。同法处理KLE细胞。筛选出敲减效率较高的shRNA-GPR30-1和shRNA-GPR30-2进行后续实验。

1.2.3
GPR30过表达慢病毒感染Ishikawa和KLE细胞
将Ishikawa细胞以2×105个/孔的密度接种于6孔板中,培养24 h待贴壁细胞达70%~80%的融合度时,进行慢病毒感染。实验分为对照组(Control)、空载组(Vector)和 GPR30过表达组(LV-GPR30)。感染后24 h,换无病毒的培养液,继续培养24 h。利用嘌呤霉素抗性筛选病毒感染的阳性细胞,37 ℃培养1周,直至没有感染病毒的细胞被嘌呤霉素杀光。慢病毒感染并稳定传2~3代后,提取细胞总RNA和总蛋白,采用蛋白质印迹法对感染效率进行验证。同法处理KLE细胞。
1.2.4
CCK-8法检测GPR30对子宫内膜癌细胞增殖能力的影响
将处于对数生长期的细胞,在显微镜下计数后制成3×104个细胞/mL的细胞悬液。分别取100 µL细胞悬液接种至96孔培养板,每种细胞每块板接种3个复孔,3×103个细胞/孔。以100 µL培养液作为空白对照,37 ℃培养过夜。Ishikawa细胞和KLE细胞分别分组如下:对照组(Control)、阴性对照组(shRNA-NC)、shRNA-GPR30-1组(shRNA-GPR30-1)、shRNA-GPR30-2组(shRNA-GPR30-2)、空载组(Vector)、GPR30过表达组(LV-GPR30)。分别在处理24、48、72 h后,按1∶10体积比例混合CCK-8和无血清必需基本培养液,每孔100 µL加入待测孔中,置于37 ℃、CO2体积分数为5%的培养箱中孵育1 h;用酶联免疫检测仪(北京普朗新技术有限公司产品)测定450 nm波长处各孔细胞D值。
1.2.5
FCM法检测GPR30对子宫内膜癌细胞凋亡的影响
将对数生长期的细胞用胰蛋白酶消化后,以5×105个细胞/孔的密度接入6孔板中。分组处理同1.2.4节,48 h后检测细胞凋亡。按照AnnexinⅤ-FITC细胞凋亡检测试剂框说明书操作,简要步骤如下:收集各组细胞,取(5~10)×104个重悬的细胞,1 000×g离心5 min,弃上清液,加入195 μL AnnexinⅤ-FITC结合液重悬细胞;加入5 μL AnnexinⅤ-FITC,4 ℃避光孵育15 min;加入5 μL碘化丙啶(propidium iodide,PI)染色液,4 ℃避光孵育5 min。同时以不加AnnexinⅤ-FITC及PI的一管作为阴性对照。随后用流式细胞仪(美国BD公司产品)检测,AnnexinⅤ-FITC为绿色荧光,对应BD流式细胞仪的FL1检测通道;PI为红色荧光,对应BD流式细胞仪的FL2检测通道。
1.2.6
实时荧光定量PCR检测GPR30对子宫内膜癌细胞中GRP78、PERK、IRE1和ATF6 mRNA表达的影响
TRIzol法提取各组细胞(分组处理同1.2.4节)总RNA,按反转录试剂框说明书步骤提取cDNA。按照实时荧光定量PCR试剂框说明书步骤行PCR,PCR扩增条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 45 s,共40个循环。PCR引物序列见表2,分别检测各组细胞中GPR30、GRP78、PERK、IRE1、ATF6和GAPDH(内参照)mRNA的表达水平。以2-&δ;Ct法处理数据,以此表示mRNA的相对表达量。

1.2.7
蛋白质印迹法检测GPR30对子宫内膜癌细胞GRP78、PERK、IRE1和ATF6蛋白表达的影响
收集各组细胞(分组处理同1.2.4节),加入RIPA裂解液4 ℃充分裂解后,提取细胞总蛋白;经BCA蛋白定量试剂框进行蛋白定量。配制10% PAGE胶,行蛋白电泳:每孔上样量为25 μg蛋白,电泳条件为80 V 20 min,后转为120 V 60 min。电泳后,将分离条带半干式转移至PVDF膜,转膜条件为25 V 30 min;转模后用5%脱脂奶粉于室温下封闭PVDF膜1 h;分别加入一抗[兔抗人GPR30多克隆抗体(体积稀释比例为1∶1 000)、兔抗人GRP78多克隆抗体(体积稀释比例为1∶200)、兔抗人PERK多克隆抗体(体积稀释比例为1∶500)、兔抗人IRE1多克隆抗体(体积稀释比例为1∶500)、兔抗人ATF6多克隆抗体(体积稀释比例为1∶300)、鼠抗人GAPDH单克隆抗体(内参照)(体积稀释比例为1∶2 000)],4 ℃孵育过夜;用TBST洗膜3次,每次5 min;加入二抗[HRP标记的羊抗兔或抗鼠IgG(体积稀释比例为1∶1 000)],37 ℃孵育1 h;TBST洗涤3次,每次5 min。化学发光仪(美国Bio-Rad公司产品)显影,获得目的条带。应用Image J软件分析条带灰度值,以目的条带与内参GAPDH条带的灰度值之比反映蛋白相对表达。
1.2.8
统计学方法
采用SPSS 23.0统计软件对所得数据进行统计学分析。所有实验均孤立重复3次,计量资料以 ¡À s表示。多组间差异比较采用单因素方差分析,组间两两比较采用LSD-t检验。假设检验为双侧检验,检验水准&α;=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1
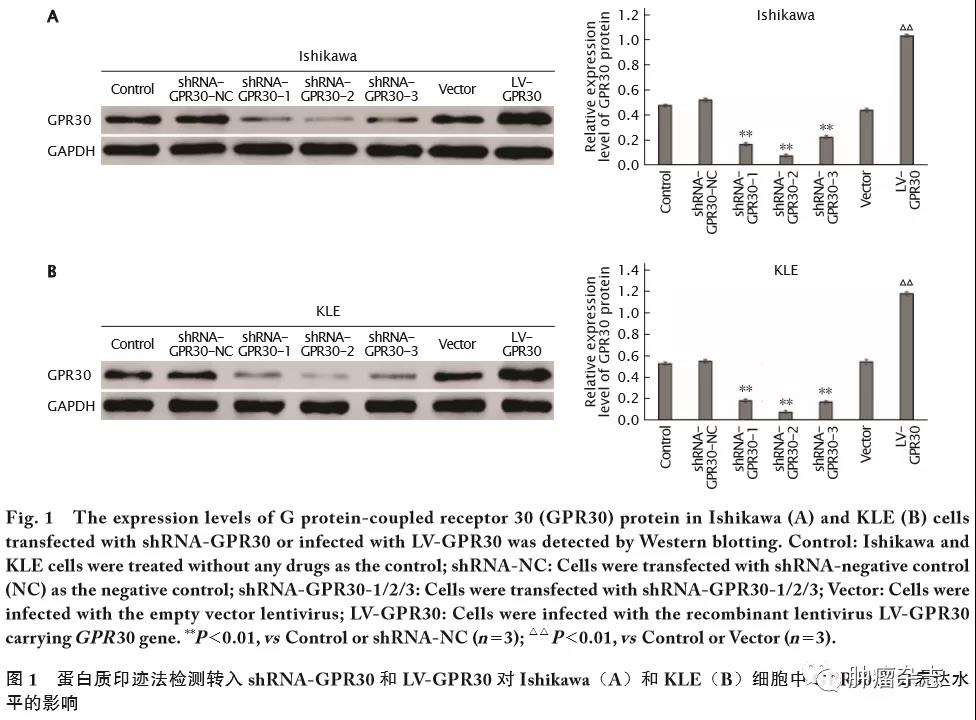
转染shRNA-GPR30和感染LV-GPR30对Ishikawa和KLE细胞中GPR30蛋白表达水平的影响
应用蛋白质印迹法检测(图1)发现,转染shRNA-GPR30-1、shRNA-GPR30-2和shRNA-GPR30-3的Ishikawa和KLE细胞中GPR30蛋白的相对表达量均低于shRNA-NC组和Control组,差异有统计学意义(Ishikawa细胞中F=732.102,P<0.01;3条shRNA对应的t 值分别为24.59、36.18和22.89,P 值均<0.01。KLE细胞中F=695.453,P<0.01;3条shRNA对应的t 值分别为31.55、43.76和34.73,P 值均<0.01);并且shRNA-GPR30-1和shRNA-GPR30-2对GPR30的干扰效果较好,因此选用shRNA-GPR30-1和shRNA-GPR30-2进行后续实验。
感染LV-GPR30慢病毒的Ishikawa和KLE细胞中,GPR30蛋白的相对表达量均高于Vector组、Control组,差异有统计学意义(Ishikawa细胞中F=1776.5,P<0.01;t=50.14,P<0.01。KLE细胞中F=1767.1,P<0.01;t=58.00,P<0.01)。
2.2
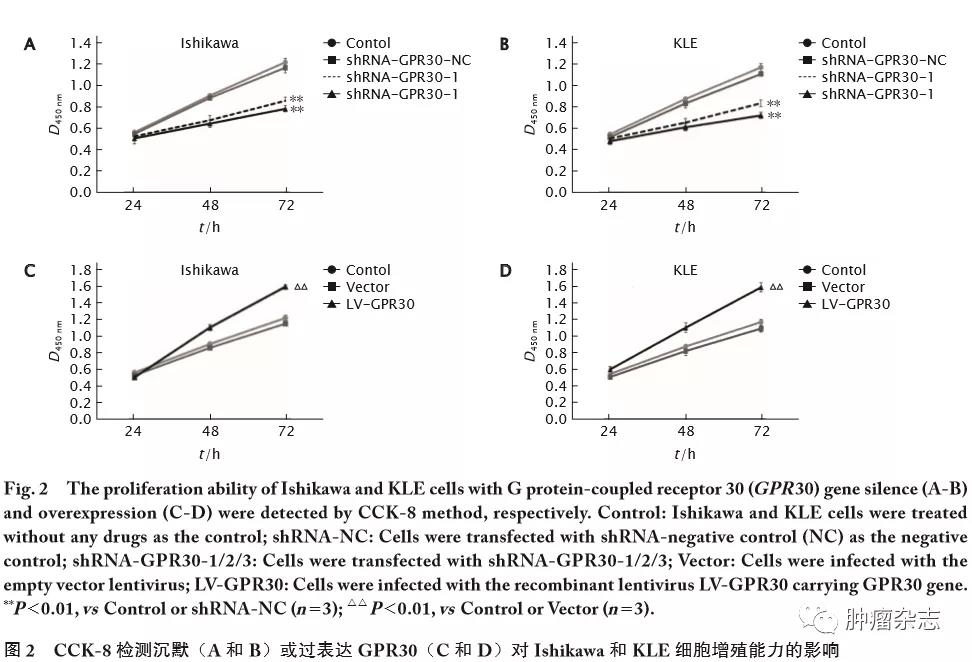
沉默或过表达GPR30对Ishikawa和KLE细胞增殖能力的影响
CCK-8法检测结果(图2)显示,与Control和shRNA-NC组相比,转染shRNA-GPR30-1和shRNA-GPR30-2后Ishikawa和KLE细胞在48和72 h时的D值均明显降低(Ishikawa细胞48 h时2条shRNA对应的t值分别为12.13和11.98,P 值均<0.01;72 h时2条shRNA对应的t值分别为15.62和17.53,P值均<0.01。KLE细胞48 h时2条shRNA对应的t 值分别为14.42和13.33,P值均<0.01;72 h时2条shRNA对应的t 值分别为16.49和17.26,P 值均<0.01),说明沉默GPR30可抑制Ishikawa和KLE细胞的增殖能力。
感染LV-GPR30的细胞D值均较Vector组和Control组明显提高(Ishikawa细胞48 h和72 h时t值分别为8.92和15.88,P 值均<0.01;KLE细胞48和72 h时t 值分别为8.15和11.18,P 值均<0.01),说明GPR30过表达能明显促进Ishikawa和KLE细胞的增殖能力。
2.3
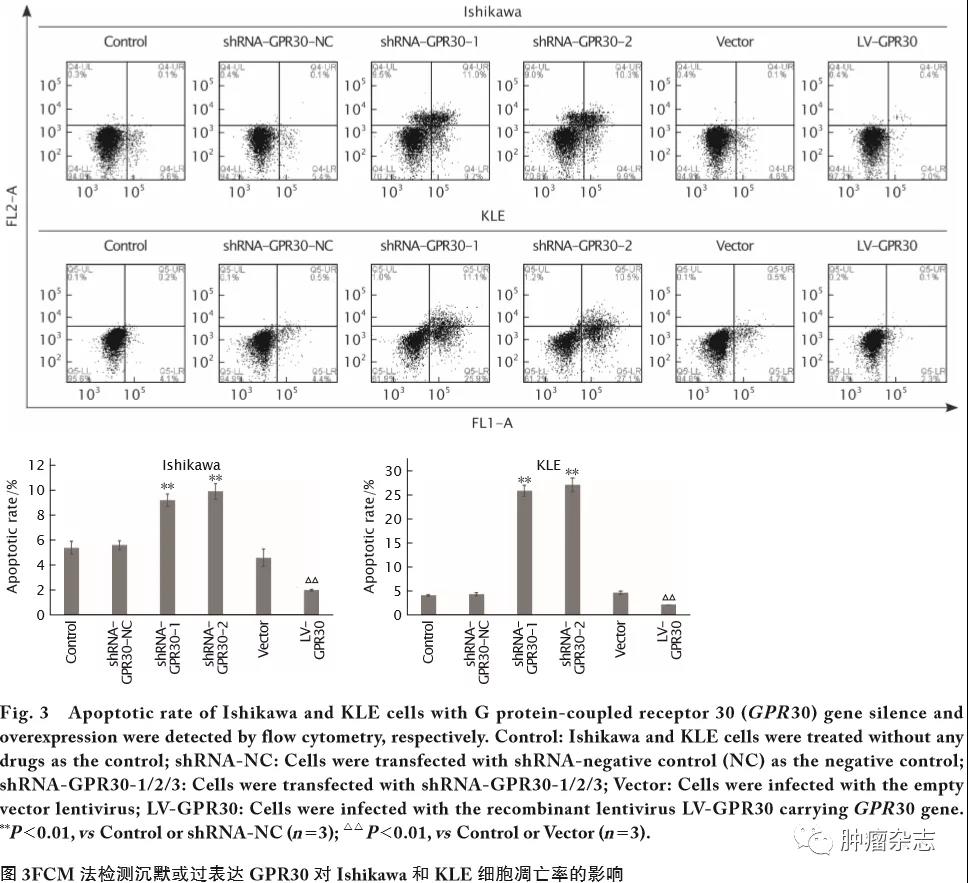
沉默或过表达GPR30对Ishikawa和KLE细胞凋亡的影响
FCM法检测结果(图3)显示,与Control和shRNA-NC组相比,转染shRNA-GPR30-1、shRNA-GPR30-2的Ishikawa和KLE细胞早期凋亡率明显增加(Ishikawa细胞中2条sh RNA对应的t值分别为13.26和11.31,P 值均<0.01;KLE细胞中2条shRNA对应的t值分别为30.26和28.19,P 值均<0.01),说明沉默GPR30能明显促进Ishikawa和KLE细胞的凋亡能力;感染LV-GPR30的细胞早期凋亡率均比Vector组和Control组明显降低(Ishikawa和KLE细胞中t 值分别为9.06和16.45,P 值均<0.01),说明过表达GPR30基因能明显抑制Ishikawa和KLE细胞的凋亡能力。
2.4
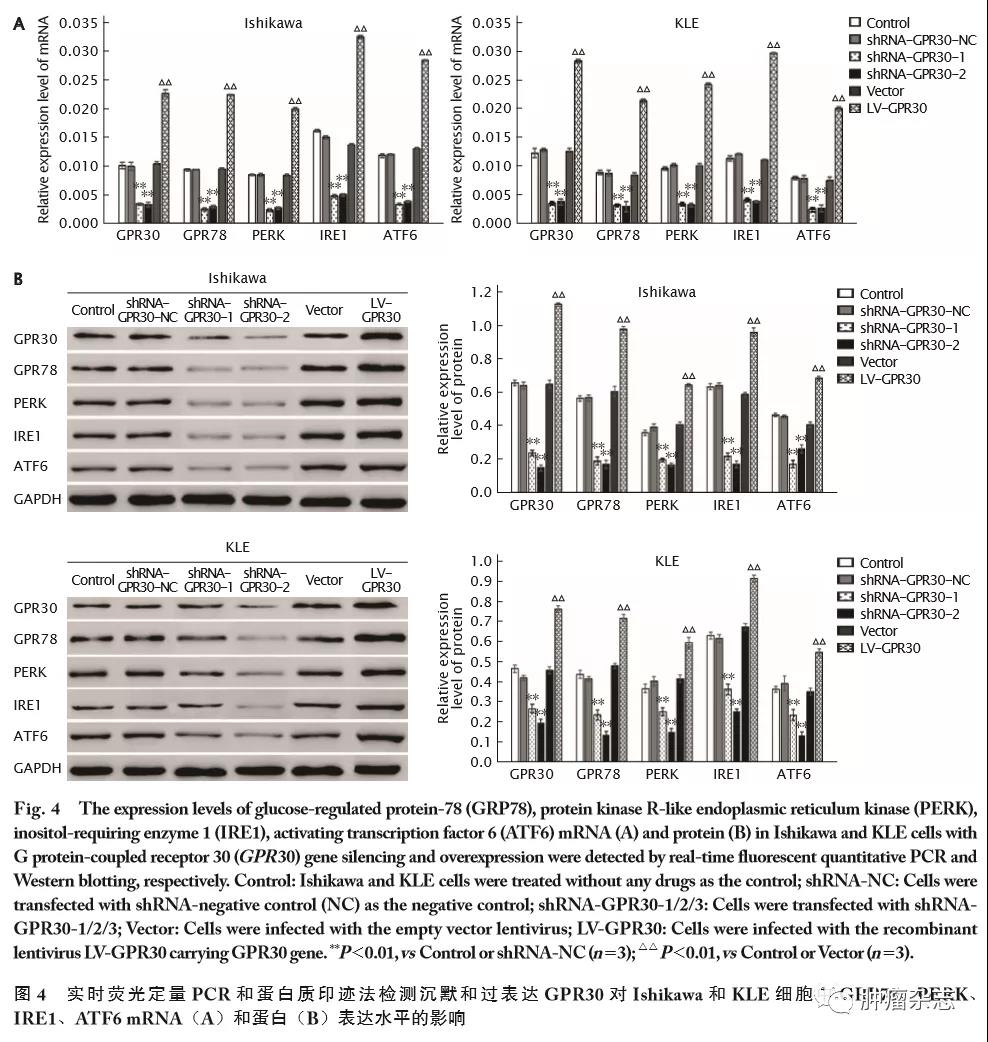
沉默或过表达GPR30对Ishikawa和KLE细胞中GRP78、PERK、IRE1、ATF6 mRNA和蛋白表达水平的影响
实时荧光定量PCR及蛋白质印迹法检测结果显示,与Control和shRNA-NC组相比,Ishikawa和KLE细胞转染shRNA-GPR30-1、shRNA-GPR30-2后GRP78、PERK、IRE1、ATF6 mRNA(图4A)和蛋白(图4B)表达水平均明显下调(P 值均<0.01)。与之相反,与Vector和Control组相比,Ishikawa和KLE细胞感染LV-GPR30后GRP78、PERK、IRE1、ATF6 mRNA(图4A)和蛋白(图4B)表达水平均明显上调(P 值均<0.01)。这一结果说明,沉默GPR30表达可下调子宫内膜癌中GRP78、PERK、IRE1和ATF6的表达,抑制内质网应激途径;而过表达GPR30可上调子宫内膜癌中GRP78、PERK、IRE1和ATF6的表达,激活内质网应激途径。
3 讨 论
经典的雌激素核受体&α;、&β;作为配体激活的转录因子,参与雌激素作用于细胞后引起的基因组效应,可赋予多种基因雌激素敏感性。GPR30作为新型的第3种雌激素受体,介导了雌激素的“快速”、“非基因组”效应[6]。GPR30的发现为研究雌激素致子宫内膜癌发病的机制开辟了新的领域。
GPR30的表达、作用机制及生物学功能与雌激素核受体&α;、&β;有显著差异。GPR30在Ⅰ型和Ⅱ型子宫内膜癌中均过度表达[7],其高表达与子宫内膜癌的生存率和预后呈负相关,被认为是预测子宫内膜癌临床结局的新指标[8]。虽然GPR30介导的细胞信号转导通路如PI3K/Akt、p38MAPK和Src/EGFR/stat3已得到相关验证[9-11],但GPR30在子宫内膜癌发生和发展中的作用机制仍待进一步研究。
内源性GPR30可在某些细胞表面表达[12],也可在细胞质内的高尔基体和内质网膜上表达[13]。GPR30的不同亚细胞分布可能介导不同的信号转导途径。本课题组前期研究显示,GPR30亚定位于子宫内膜癌细胞Ishikawa的内质网中。
内质网功能之一是参与细胞内蛋白质的合成、折叠和转移。当细胞受各种应激刺激时[如氧化还原环境的变化、Ca2+耗竭、突变蛋白的表达、缺氧和(或)葡萄糖剥夺等],蛋白质的折叠能力被破坏,导致内质网功能紊乱,引起内质网应激[4]。内质网应激可以诱发肿瘤发生,并促进肿瘤细胞的生存、发展、新生血管生成及治疗抗拒性[14]。
未折叠蛋白反应是内质网应激中最重要的信号通路[15]。目前已知的未折叠蛋白反应有3条转导通路:PERK、IRE1和ATF6信号转导通路[16]。细胞正常时,PERK、IRE1和ATF6与内质网应激标志蛋白GRP78结合而失活。内质网应激时,PERK、IRE1和ATF6与GRP78解离,激活下游元件,进而介导细胞生存与凋亡[17];但其上游激活机制尚不明了。
已有研究显示,内质网应激后的未折叠蛋白活化和GRP78过表达,可以影响子宫内膜癌细胞的生长、侵袭能力及化疗耐药性[18],但子宫内膜癌中GPR30与内质网应激的相关研究较少。本课题组前期研究发现,子宫内膜癌组织中GPR30与GRP78的表达呈正相关,提示两者间存在共表达的交互或调节作用。
为进一步研究GPR30是否可能通过内质网应激途径影响子宫内膜癌细胞的生物学行为,本研究选用了两种不同特点的子宫内膜癌细胞株作为研究对象,分别是Ishikawa和KLE细胞,分别代表Ⅰ型和Ⅱ型子宫内膜癌。前期研究已显示,Ishikawa和KLE细胞系中GPR30 mRNA及蛋白的表达均高于原代培养的子宫内膜腺上皮细胞,并且KEL细胞中GPR30的表达高于Ishikawa细胞[19]。随后成功构建了GPR30 shRNA及过表达GPR30重组病毒,并分别导入两种细胞。结果显示:沉默GPR30表达可下调子宫内膜癌中GRP78的表达,抑制PERK、IRE1、ATF6活性,使子宫内膜癌细胞的增殖能力减弱,凋亡能力增强;而过表达GPR30可上调子宫内膜癌中GRP78的表达,激活PERK、IRE1、ATF6活性,使子宫内膜癌细胞的增殖能力增强,凋亡能力减弱。这一结果说明,沉默 GPR30可抑制子宫内膜癌细胞的增殖能力并促进其凋亡,过表达GPR30可促进子宫内膜癌细胞的增殖能力并抑制其凋亡,该机制可能与内质网应激途径的未折叠蛋白反应有关。因此推测GPR30和GRP78有望成为更有效的分子治疗靶点,在子宫内膜癌的高效靶向药物治疗中具有重要的研究价值。
更多《肿瘤》杂志文章,请访问以下网址:
https://navi.cnki.net/knavi/JournalDetail?pcode=CJFD&pykm=ZZLL
参考文献
[1]Noer MC, Antonsen SL, Ottesen B, et al. TypeⅠ versus typeⅡ endometrial cancer: Differential impact of comorbidity[J]. Int J Gynecol Cancer, 2018, 28(3):586-593.
[2]Ge X, Guo R, Qiao Y, et al. The G protein-coupled receptor GPR30 mediates the nontranscriptional effect of estrogen on the activation of PI3K/Akt pathway in endometrial cancer cells[J]. Int J Gynecol Cancer, 2013, 23(1):52-59.
[3]叶 佳, 张 沐, 马勤宜, 等. G蛋白偶联受体30在子宫内膜癌Ishikawa细胞中的表达及亚细胞定位[J]. 肿瘤, 2011, 31(11):977-981.
[4]Wang M, Kaufman RJ. Protein misfolding in the endo-plasmic reticulum as a conduit to human disease[J]. Nature, 2016, 529(7586):326-335.
[5]叶 佳, 吕 蓓, 张 阳, 等. 子宫内膜癌组织中G蛋白偶联受体30和葡萄糖调节蛋白78的表达及其临床意义[J]. 上海医学, 2019, 42(6):351-356.
[6]Barton M, Filardo EJ, Lolait SJ,et al.Twenty years of the G protein-coupled estrogen receptor GPER: Historical and personal perspectives[J]. J Steroid Biochem Mol Biol, 2018, 176:4-15.
[7]Wan J, Yin Y, Zhao M, et al. The positivity of G-protein-coupled receptor-30(GPR30), an alternative estrogen receptor is not different between type 1 and type 2 endometrial cancer[J]. Oncotarget, 2017, 8(53):90897-90904.
[8]Smith HO, Leslie KK, Singh M, et al. GPR30: a novel indicator of poor survival for endometrial carcinoma[J]. Am J Obstet Gynecol, 2007, 196(4):386.
[9]Wang X, Lu L, Tan Y, et al. GPR30 reduces myocardial infarct area and fibrosis in female ovariectomized mice by activating the PI3K/AKT pathway[J]. Life Sci, 2019, 226:22-32.
[10]Yang S, Deng L, Lai Y, et al. Over expression of GPR30, indicating poor prognosis and promoting proliferation, upregulates Beclin-1 expression via p38MAPK signaling in esophageal squamous cell carcinoma progression[J]. Int J Clin Exp Pathol, 2018, 11(7):3426-3435.
[11]Peng J, Zuo Y, Huang L, et al. Activation of GPR30 with G1 attenuates neuronal apoptosis via src/EGFR/stat3 signaling pathway after subarachnoid hemorrhage in male rats[J]. Exp Neurol, 2019, 320:113008.
[12]Gaudet HM, Cheng SB, Christensen EM, et al.The G-protein coupled estrogen receptor, GPER: The inside and inside-out story[J]. Mol Cell Endocrinol, 2015, 418(Pt 3):207-219.
[13]Campden R, Audet N, Hebert TE. Nuclear G protein signaling: new tricks for old dogs[J]. J Cardiovasc Pharmacol, 2015, 65:110-122.
[14]Ulianich L, Insabato L. Endoplasmic reticulum stress in endometrial cancer[J]. Front Med(Lausanne), 2014, 1:55.
[15]Feldman DE, Chanuhan V, Koong AC. The unfolded pro-tein response: a novel component of the hypoxic stress response in tumors[J]. Mol Cancer Res, 2005, 3(11):597-605.
[16]Fabio MA. Targeting endoplasmic reticulum signaling path-ways in cancer[J]. Acta Oncologica, 2012, 51:822-830
[17]Mei Y,Thompson MD, Cohen RA, et al. Endoplasmic reticulum stress and related pathological processes[J]. J Pharmacol Biomed Anal, 2013, 1(2):100-107.
[18]Bifulco G, Miele C, Di Jeso B, et al. Endoplasmic reticulum stress is activated in endometrial adenocarcinoma[J]. Gynecol Oncol, 2012, 125(1):220-225.
[19]叶 佳, 杨晓清, 盛 楠, 等. 不同子宫内膜癌细胞系中G蛋白耦联受体30 mRNA及蛋白表达观察[J]. 山东医药, 2016, 56(19):31-33.