MD Anderson王鲁华教授JCO发文:高危套细胞淋巴瘤的定义、当前挑战和管理策略
套细胞淋巴瘤(MCL)是B细胞非霍奇金淋巴瘤中一种罕见的、具有侵袭性的亚型,属于传统化疗无法治愈性的疾病,接受标准治疗后缓解期较短,尤其是高危MCL患者。如何准确判断MCL高危患者及进行预后评估,给予正确合理的治疗策略显得非常重要。近期,MD Anderson癌症中心的王鲁华教授(Michael Wang)等在JCO发表了一篇关于高危MCL的综述性文章,针对高危MCL的定义、预后评估及治疗挑战等方面进行了全面解读。
引言
近年来,套细胞淋巴瘤(MCL)领域在病理学、预后因素及新型治疗方案等方面经历了较大的变化,以上进展使得治愈MCL成为可能,但即便如此,高危MCL的治疗仍然是一项重大的挑战。目前,MCL的治疗方法正逐渐从完全依赖免疫化疗转变为联合高效的非化疗靶向药(如伊布替尼、阿卡替尼、泽布替尼和维奈托克等)进行治疗。近期,美国FDA批准了抗CD19 CAR-T产品KTE-X19用于MCL的治疗,这堪称里程碑式的进步。
然而,需要指出的是,难治性MCL患者仍无特别有效的治疗方案,对于新型治疗药物的疗效亦不佳(中位生存仅为3~10月)。基于MCL治疗方面存在的未满足需求,该文章旨在提供最新版的MCL临床管理策略。
Part 1:MCL的概述、特点及治疗挑战
MCL介绍、治疗挑战
MCL是一类较为罕见、通常为侵袭性的非霍奇金淋巴瘤,中位发病年龄为68岁。由于MCL存在异质性,故其危险因素的定义对于MCL的预后判断及治疗管理显得尤为重。根据MIPI评分标准,约有65%的MCL患者为低中危组,此类患者通常具有更长的总体生存(OS),在接受免疫化疗时,低危及中危组MCL患者的5年OS分别可达83%和63%,而MIPI高危组的患者则仅为34%。对于高危组MCL患者而言,若在给予BTK抑制剂治疗的基础上仍出现疾病进展,则其治疗上存在较大的挑战。
高危MCL的定义及特点
MCL的高危因素可概括为包括两大方面:1. 宿主因素(如体能状况差、高龄和伴有其它合并症等)2. 疾病的本身特征(如中枢神经系统受累、疾病转化和BTK抑制剂-难治性MCL等)。
MCL患者的病理学高危因素包括多形性组织学、MIPI高危组、高Ki-67(≥30%)以及TP53基因异常等。此外,疾病复发、复杂核型、一线治疗后12~24个月内疾病进展等因素预示着MCL患者的预后不佳。
在基因突变方面,以下基因突变可能是MCL预后不良的因素(但仍需进一步验证),主要包括MYC基因重排或过表达、17p-、复杂基因组变异、DNA高度甲基化、SOX11基因过表达、MRD阳性、IGHV基因未突变、体细胞突变(包括CCND/NSD/NOTCH1/NOTCH2/KMT2D/CDKN2A/SMARCA4以及HNRNPH1突变等)。此外,miR18b表达上升及BACH2低表达等也可能预示MCL预后不佳,具体详见下图。
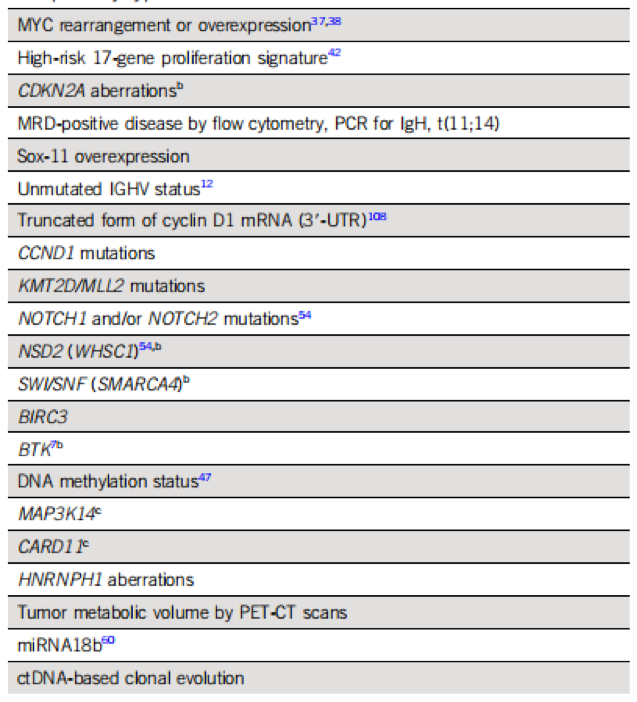
Part 2:预后评估因素
MCL的常见临床高危因素
l 合并症及体能状态
通常,临床试验中的MCL患者在体能状态和合并症方面的状况较好,多项研究已经证实,合并症是影响MCL患者生存的不良预后因素。在瑞典的一项大型临床研究中,共纳入1385例MCL患者,其中28%的患者伴有合并症,结果显示,伴有合并症的MCL患者的中位OS及淋巴瘤特异生存均劣于无合并症的MCL患者。此外,体能状态差(PS评分为3或4)意味着预后不良。
l 中枢神经系统(CNS)累及
初诊时,MCL患者中出现CNS累及的比例不足1%,然而,极少数基线特征为高危(如母细胞样MCL、高LDH、高Ki-67等)的MCL患者会更容易出现CNS累及。某些回顾性研究显示,CNS累及的MCL患者的生存期也更差,中位OS仅为3~8个月。一项近期的回顾性研究表明,较之于传统免疫化疗,伊布替尼对于CNS累及的MCL患者的疗效相对更好,但总体预后仍差,1年PFS为49%,而免疫化疗的1年PFS仅为6%。目前的研究表明,伊布替尼对于CNS累及MCL患者的治疗是有效的。
母细胞样/多形性侵袭性组织学MCL
在新诊断MCL患者或转变性MCL患者中,约有10%~20%存在母细胞样/多形性侵袭性组织学,总体而言,此类患者在经历多种治疗后仍预后不佳。相对于新诊断MCL患者,转变型MCL患者的预后明显更差,中位OS分别为14个月vs 48个月。CNS累及的部位通常为软脑膜(占此类患者的5%~30%),Ki-67的平均值为70%,复杂核型及四倍体也较为常见。此外,侵袭性MCL患者中发生NOTCH2、NOTC、UBR5以及CCND1基因突变的频率相对更高。
母细胞样/多形性侵袭性组织学MCL患者的治疗存在巨大挑战,部分医疗中心会应用大剂量免疫化疗+自体干细胞移植(ASCT)治疗。由于目前可参考的治疗数据并不多,因此我们更为推荐的治疗方法是纳入临床试验。
一项III期临床研究中,有9%的MCL患者为母细胞样/多形性侵袭性组织学,分别接受6个周期R-CHOP方案+清髓性放化疗+ASCT(n=234,对照组)、6个周期R-CHOP或R-DHAP方案+大剂量含阿糖胞苷的预处理方案+ASCT(n=232,阿糖胞苷组),结果显示:①较之于对照组,阿糖胞苷组可延长治疗至治疗失败的间隔时间,分别为9.1年 vs 3.9年(Ki-67≥30%的患者分别为4.5年 vs 2年)。②母细胞样/多形性侵袭性组织学MCL患者的5年OS明显劣于经典型MCL患者,分别为38% vs 75%。
一项研究对370例接受伊布替尼治疗的MCL患者进行了综合分析,其中36例(10%)患者为母细胞样MCL。结果显示,母细胞样MCL患者的客观缓解率(ORR)劣于非母细胞样MCL,分别为50% vs 68%;中位OS也相对更短,分别为12.8月 vs 未达到。此外,在真实世界研究中,接受伊布替尼治疗的母细胞样MCL患者,其生存期也明显更短,中位OS分别为4个月vs 17个月。
另有一项II期研究评估了伊布替尼+利妥昔单抗方案对于MCL患者的疗效,结果显示:①母细胞样MCL患者(n=7)中位无进展生存(PFS)为21个月,明显劣于非母细胞样MCL患者(n=42)的48个月(p=0.16);中位OS分别为30个月 vs 未达到(p=0.15)。②母细胞样MCL患者的ORR为71%,非母细胞样MCL患者的ORR则为91%(p=0.001)。
此外,一项纳入183例侵袭性MCL患者的研究表明,以R-HCVAD为基础的方案、利妥昔单抗+化疗、伊布替尼为基础的方案的有效率分别为85%、75%及69%。
高Ki 67(≥30%)且MIPI评分高危
MIPI评分已经明确可作为MCL患者的预后判断指标,主要包括四大参数:年龄、PS评分、血清乳酸脱氢酶(LDH)水平和白细胞计数。在一项纳入455例MCL患者的随机对照研究中,MIPI评分高危组患者的中位生存明显劣于MIPI低危组,分别为29个月(高危组)vs 未达到(低危组)。Nordic MCL2研究表明,在预测MCL患者生存方面,MIPI评分要优于IPSS评分。
由于高Ki-67是MCL患者接受R-CHOP方案疗效不佳的因素之一,因此联合应用Ki-67及MIPI评分能更有效地对MCL患者进行预后评估,称之为“改良版MIPI评分”。根据改良版MIPI评分,高危组、中危组及低危组MCL患者的中位OS分别为1.5年vs 4.3年vs未达到。
在接受多种一线治疗方案时,MIPI高危组的MCL患者的生存情况均明显更差,来那度胺+利妥昔单抗的中位OS为13个月;伊布替尼+利妥昔单抗的中位OS为34个月。此外,高Ki-67是MCL患者孤立的预后不良指标,研究显示Ki-67≥50% MCL患者的生存期明显劣于低Ki-67的MCL患者,中位OS分别为20个月vs 118个月。并且,在高K-i67的MCL患者中,CCND1、TP53、NOTCH1、NOTCH2、KMT2C以及NSD2突变的频率会较之于低Ki-67的MCL患者更高。
Ki-67及MIPI对MCL一线治疗方案(伊布替尼或伊布替尼+利妥昔单抗)疗效存在怎样的影响,这仍在研究探索中。中期研究结果显示,高Ki-67的MCL患者的PFS要更差。在BTK抑制剂治疗前提下,关于高Ki-67淋巴组织微环境是如何影响患者生存、肿瘤生长以及MCL细胞的克隆演变等问题尚在探索中。
TP53基因异常
TP53基因异常(突变或17P-)会导致基因组学不稳定性、细胞周期阻滞失败以及肿瘤生长失控。TP53基因异常与其它因素相关(例如母细胞样/多形性侵袭性组织学、高Ki-67、复杂核型及MIPI评分高危等),也是预后不佳的因素之一。TP53基因异常可采用多种方法进行检测,其中荧光原位杂交技术(FISH)及二代基因测序(NGS)可用来检测TP53基因突变;免疫组化可用来检测TP53蛋白的表达情况,TP53过表达是指免疫组化中TP53在超过50%的细胞中有表达。
在一项研究中,Nordic组队176例MCL患者进行了治疗前的DNA基线水平检测,其中20例(11%)为TP53基因突变,29例(16%)为TP53基因缺失。结果显示:①存在TP53基因异常的MCL患者,其中位OS仅为1.8年,明显劣于无TP53基因异常MCL患者的12.7年。②TP53基因突变通常与其它基因突变同时存在,例如NOTCH1基因突变(71%)、CDKN2A基因缺(del9p21占31%)、TP53基因缺失(del17p13占31%)。③TP53基因突变与TP53基因缺失同时存在意味着最差的预后。
European MCL Network的一项研究显示,CDKN2A与TP53基因缺失同时存在的MCL患者中位OS<2年,而两者均无缺失的MCL患者中位OS可达7年。在另一项研究中,在接受伊布替尼单药治疗的MCL患者中,TP53突变(n=20)患者的中位OS为10.3月,而TP53未突变的MCL患者,中位OS为33.6月。与之相反,一项研究采用伊布替尼、来那度胺及利妥昔单抗联合治疗MCL患者,结果显示TP53突变者与TP53未突变患者的缓解率、生存情况并无差异。
复杂核型
在MCL患者中,复杂核型是指除t(11;14)之外同时存在3种以上互不相关的染色体异常改变。一项纳入74例MCL患者研究显示复杂核型MCL患者的中位OS明显更差,并且Ki-67>30%以及母细胞样形态学的概率也更高。在另外一项研究中,有53例MCL患者在初诊时为复杂核型,结果表明:①中位OS明显劣于非复杂核型的MCL患者,分别为4.5年vs 11.6年(p<0.01)。②111例患者在第一次完全缓解(CR)后接受ASCT治疗,复杂核型MCL患者的中位OS为5.1年,而非复杂核型MCL患者的中位OS为8.6年(p<0.01);中位PFS分别为3.5年vs 6.7年(p<0.01)。因此,复杂核型是MCL患者的孤立预后指标。
一线治疗后12个月内出现早期疾病进展
在一线治疗后未能达到CR或达完全缓解12个月内出现疾病进展,这是MCL预后不佳的因素之一。在一项纳入404例新诊断MCL患者的研究中,结果显示,早期出现疾病进展的MCL患者,其OS明显差于晚期出现进展的MCL患者,中位OS分别为30个月vs 70个月(p<0.01)。另外,在意大利的一项研究中,纳入188例接受过大剂量免疫化疗的MCL患者,结果显示,早期出现疾病进展组(n=90)患者的OS要明显短于晚期出现疾病进展(n=98)的MCL患者(p<0.01)。
BTK抑制剂、Veneclax或CAR-T治疗耐药:三重耐药
随着MCL治疗选择的增加,对新型治疗方案耐药的模式也越来越多。伊布替尼是MCL治疗上的一大进步,但一项纳入114例MCL患者的研究中显示,在伊布替尼治疗中出现疾病进展时,其中位OS仅为2.9个月。另一项类似研究纳入80例停用伊布替尼后复发的MCL患者,其中41例患者在伊布替尼治疗时疾病仍进展,结果显示此类患者的生存结局更差,接下来转换为免疫化疗、来那度胺、苯达莫司汀及硼替佐米治疗的有效率(ORR)也仅为30%。近期,一项研究应用利妥昔单抗、苯达莫司汀及阿糖胞苷(R-BAC方案)治疗BTK抑制剂耐药的MCL患者,结果显示其ORR为83%,CR为60%,中位PFS为10个月。此外,对于BTK抑制剂耐药的MCL患者而言,BTK突变通常较为少见(10%~20%),而TP53、NSD2、UBR5、CDKN2A 突变则在伊布替尼治疗进展患者中较多见;OXPHOS、c-MYC、m-TOR信号通路相关的基因在伊布替尼耐药的患者中通常为过表达。
Venetoclax(维奈克托)是一类选择性Bcl-2抑制剂,可单药或联合CD20单抗用于BTK抑制剂难治的MCL患者,有研究显示Venetoclax可使此类患者的PFS达8个月,OS达13.5个月。不同于慢性淋巴细胞白血病(CLL),在Venetoclax耐药的MCL患者中,Bcl-2突变极为罕见,但TP5、KMT2D、CCND1、CDKN2A、CELSR3, 及SMARCA4突变在Venetoclax治疗进展的MCL患者中较为常见。
Brexucabtagene autoleucel是一类CAR-T治疗产品,已获批用于治疗高度难治性MCL患者。目前,需要在CAR-T临床研究中进行更长的随访,来明确CAR-T治疗后缓解持续时间、是否进展等。
Part 3:高危MCL患者的治疗及管理策略
CD19 CAR-T治疗MCL
Brexucabtagene autoleucel(KTE-X19)是复发/难治性MCL治疗的最新进展,也获得了FDA批准。在制备过程中,首先去除B细胞,然后进行病毒转导和阳性T细胞的筛选及收集。
ZUMA-2研究是一项国际多中心、单臂、II期研究,纳入68例复发性MCL患者(包括BTK抑制剂治疗进展的MCL患者),先给予白细胞单采、淋巴细胞耗竭性化疗,然后接受 2×106/L的KTE-X19细胞治疗。结果显示:①母细胞样、TP53基因突变及高Ki-67的MCL患者在接受KTE-X19治疗后,ORR能>93%。②经过12.3个月的随访,57%的MCL患者仍维持缓解,中位缓解持续期(DOR)、中位PFS及OS未达到。③常见的≥3级不良反应事件(AEs)为血细胞减少(69%)及感染(32%)。
需要指出的是,少数MCL患者在CAR-T治疗后仍表现为进展,这部分患者的预后是极其不理想的。但即便如此,抗CD19 CAR-T产品KTE-X19的出现是高危MCL治疗上的里程碑性进展。
细胞治疗的其它进展
Lisocabtagene maraleucel(JCAR-017)另一种抗CD19 CAR-T产品,目前正在进行MCL的临床试验。一项I期研究中(n=17),中位随访18个月,结果显示:①ORR为71%,CR为53%。②≥3级的细胞因子释放综合征(CRS)发生率为6%,中性粒细胞减少发生率为12%。
新型非CAR-T治疗
LOXO-305是一类新型、可逆转、非共价BTK抑制剂,体内外研究显示它对BTK野生型和C481S突变型的BTK均具有选择性靶向作用。在I期研究中,LOXO-305显示出对BTK抑制剂-难治性CLL及CLL患者的较好前景。
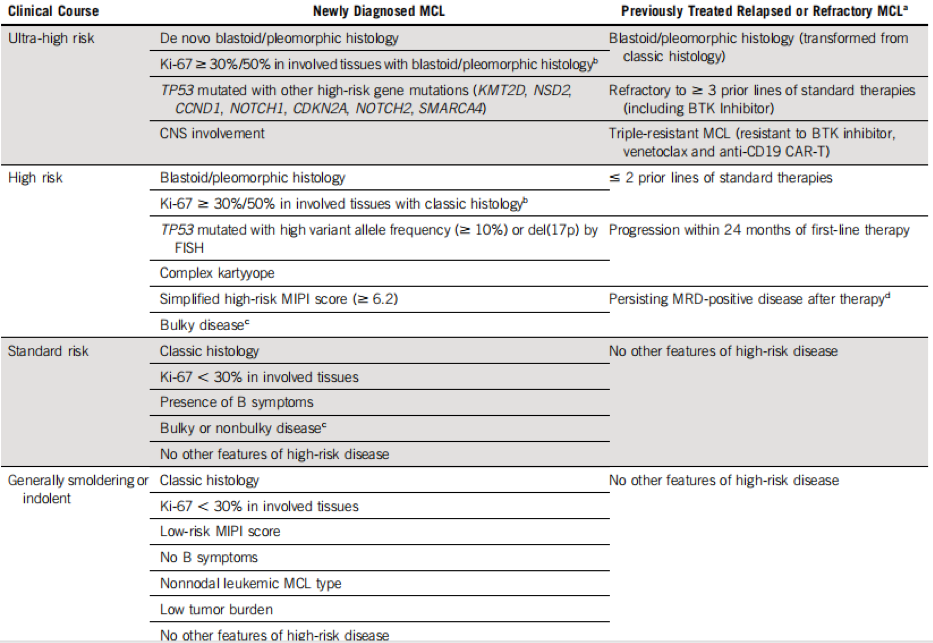
高危MCL患者的管理路径
l 对于MIPI评分低危或中危组的MCL患者,应采用免疫化疗作为一线治疗方案。
l 对于MIPI评分高危组的MCL患者,先给予高强度的免疫化疗,然后接受ASCT巩固治疗+利妥昔单抗维持治疗。
l 如果可行,推荐对MIPI低中高危组的MCL患者均进行临床试验。
l 对于复发性MCL患者,评估预后的因素包括既往接受治疗的线数、PS评分、合并症、干细胞移植情况、是否早期复发(即一线治疗后12~24个月内复发)、BTK抑制剂治疗下出现疾病进展。
l 除外CNS累及或高龄MCL患者,推荐临床试验或Brexucabtagene autoleucel治疗高危型MCL患者。
l 异基因造血干细胞移植(Allo-HSCT)在某些医疗中心会用来治疗高危型MCL患者,但其严重的并发症使得其仅适用于少部分MCL患者。
具体详见下图。
CNS累及的预防
高危MCL的CNS累及预防方法仍存在争议,尚无前瞻性、随机研究对其进行探讨。但对于母细胞样MCL患者,大剂量阿糖胞苷、伊布替尼、Venetoclax可考虑作为CNS预防的治疗方案。
参考文献
Preetesh Jain,Martin Dreyling, John F Seymour, Michael Wang. High-Risk Mantle Cell Lymphoma: Definition, Current Challenges, and Management.J Clin Oncol. 2020 Oct 19;doi: 10.1200/JCO.20.02287.