携带miR-196b-5p的骨髓间充质干细胞来源外泌体对结肠癌细胞耐药性的影响
携带miR-196b-5p的骨髓间充质干细胞来源外泌体对结肠癌细胞耐药性的影响
李晓辉1,瞿紫微1,卢 昕1,孟庆彬1,陈华涛1,任 骏1,谭成沛2
Effect of exosomes derived from bone marrow mesenchymal stem cells carrying miR-196b-5p on drug resistance of colon cancer cells
LI Xiaohui1, QU Ziwei1, LU Xin1, MENG Qingbin1, CHEN Huatao1, REN Jun1, TAN Chengpei2
作者单位
1. 武汉第一医院胃肠外科,湖北 武汉 430022;2. 神农架林区中医医院普外科,湖北 神农架 442000
基金项目
2018年湖北省知识创新专项(自然科学基金)(编号:2018CFC814)
AUTHORS FROM
1. Department of Gastrointestinal Surgery, Wuhan First Hospital, Wuhan 430022, Hubei Province, China; 2. Department of General Surgery, Shennongjia Forestry Hospital of Traditional Chinese Medicin, Shennongjia 442000, Hubei Province, China
GRANT
Knowledge Innovation Project 2018 of Hubei Province(Natural science foundation)(No. 2018CFC814)
[摘要]
目的:探讨携带有微RNA(microRNA,miRNA ,miR)-196b-5p的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)来源的外泌体(exosomes)对结肠癌细胞耐药性的影响及其机制。
方法:分离收集BALB/c小鼠BMSCs并采用FCM法进行鉴定;采用脂质体法将miR-196b-5p-模拟物(miR-196b-5p-mimic)或miR-196b-5p-抑制子(miR-196b-5p-inhibitor)转入BMSCs,从培养液中收集BMSCs分泌的外泌体并予以鉴定(透射电子显微镜下观察外泌体及蛋白质印迹法鉴定外泌体标志物的表达情况)。实时荧光定量PCR法检测外泌体中miR-196b-5p的表达水平。用外泌体处理小鼠结肠癌CT26.WT细胞,并用实时荧光定量PCR法检测细胞中miR-196b-5p的表达水平;随后采用不同质量浓度的5-氟尿嘧啶(5-fluorouracil,5-Fu)(0、1.0、1.5和2.0 mg/mL)处理外泌体处理后的CT26.WT细胞,MTT法检测5-Fu处理24和48 h后对细胞活力的影响,FCM法检测对细胞凋亡率的影响;蛋白质印迹法检测CT26.WT细胞中多药耐药蛋白(multidrug resistance,MDR)、多药耐药相关蛋白(multidrug resistance-associated protein,MRP)、肺耐药相关蛋白(lung resistance-related protein,LRP)以及磷脂酰肌醇-3激酶(phosphoinositide-3 kinase,PI3K)-蛋白激酶B(protein kinase B,PKB,又称AKT)通路相关蛋白的表达水平。
结果:成功获得miR-196b-5p高表达(或低表达)的BMSCs分泌的外泌体。随着5-Fu浓度的提高,各组CT26.WT细胞的活力均明显降低,凋亡率增加(P 值均<0.01),其中以miR-196b-5p过表达组CT26.WT细胞的活力最低,细胞凋亡率最高。在同一浓度5-Fu干预下,miR-196b-5p过表达组CT26.WT细胞中MDR、MRP、LRP、磷酸化PI3K(phospho-PI3K,p-PI3K)及p-AKT蛋白的表达水平均明显低于Exosomes组(未转入mimic或inhibitor的BMSCs分泌的外泌体)(P 值均<0.01),而miR-196b-5p低表达组中各耐药相关蛋白的表达水平均明显高于Exosomes组(P 值均<0.01)。
结论:携带有高水平miR-196b-5p的BMSCs来源的外泌体可降低结肠癌CT26.WT细胞对5-Fu的耐受性,从而促进细胞凋亡,其作用机制可能与抑制PI3K/AKT通路的激活有关。
[关键词]结肠肿瘤;骨髓间充质干细胞;外泌体;结肠癌细胞;耐药性;PI3K/AKT通路
[ABSTRACT]
Objective: To investigate the effect of exosomes derived from bone marrow mesenchymal stem cells(BMSCs) carrying microRNA(miR)-196b-5p on the drug resistance of colon cancer cells and its mechanism.
Methods: BMSCs of BALB/c mice were isolated and identified by flow cytometry(FCM) assay. MiR-196b-5p-mimic or miR-196b-5p-inhibitor were transfected into BMSCs by liposome, the exosomes secreted by BMSCs in cell culture medium(CM) were separated. After the exosomes were identified(observed using transmission electron microscopy and detected the expression of exosomes markers by Western blotting), the expression level of miR-196b-5p in the exosomes was detected by real-time fluorescent quantitative-PCR. Colon cancer CT26.WT cells of mice were treated with exosomes, the expression of miR-196b-5p in cells was detected by real-time fluorescent quantitative-PCR. CT26.WT cells were treated with different concentrations 5-fluorouracil(5-Fu)(0, 1.0, 1.5, 2.0 mg/mL), after treatment 24 and 48 h the cell viability was detected by MTT assay, apoptotic rate was detected by FCM method. The expression levels of multidrug resistance(MDR), multidrug resistance-associated protein(MRP), lung resistance-related protein(LRP) and phosphoinositide-3 kinase(PI3K)/protein kinase B(PKB, also known as AKT) pathway related protein were detected by Western blotting.
Results: The exosomes of BMSCs with high(or low) expression of miR-196b-5p were successfully obtained. With the increase of 5-Fu concentration, the cell viability of CT26.WT cells were decreased and the cells apoptosis rate were increased in each group. Mimic-exosomes group had the lowest viability and the apoptosis rate was the highest. Under the same concentration of 5-Fu, the expression level of MDR, MRP, LRP, p-PI3K and p-AKT in mimic-exosomes group were significantly lower than those in exosomes group(all P < 0.01), while the protein levels in inhibitor-exosomes group were significantly higher than those in exosomes group(all P < 0.01).
Conclusion: BMSCs-derived exosomes carrying high levels of miR-196b-5p can reduce the tolerance of CT26.WT cells to 5-Fu and promote cell apoptosis, which may be related to the inhibition of PI3K/AKT signaling pathway activation.
[Key words]Colonic neoplasms; Exosomes; Bone marrow mesenchymal stem cells; Drug resistance, neoplasm; PI3K/AKT signaling pathway
结肠癌是全球范围内第3大常见癌症,其发病率与死亡率存在着明显的地理差异,在较不发达国家中的患病及死亡占比较高于发达国家[1]。结肠癌是一种多因素疾病,涉及遗传、环境和生活方式等多方面的危险因素[2]。5-氟尿嘧啶(5-fluorouracil,5-Fu)是治疗结肠癌的传统化疗药物之一,但肿瘤细胞对其产生耐受性经常是导致大量结肠癌患者临床治疗失败的主要原因之一[3]。间充质干细胞(mesenchymal stem cells,MSCs)是一种具有高度分化能力、自我更新的细胞,可通过囊泡的形式旁分泌至细胞外,其分泌的外泌体富含微RNA(microRNA,miRNA,miR)和转运RNA,可影响靶细胞信号转导[4-6]。研究发现,MSCs来源的外泌体对癌症细胞耐药具有重要的调节作用,有助于提高化疗疗效[7]。miR-196b-5p与结肠癌的发生和发展有着密切联系,高表达的miR-196b-5p被认为是预测转移性结肠癌患者接种疫苗后疗效评价的生物标志物之一[8],而且结肠癌患者血清外泌体中含有miR-196b-5p,且其表达水平与结肠癌病理过程有关[9]。当前有关miR-196b-5p在结肠癌耐药中的相关研究却鲜有报道,MSCs来源的富含miR-196b- 5p的外泌体可能在结肠癌耐药过程中具有一定的作用。因此,此次研究拟通过分离小鼠骨髓来源的MSCs(bone marrow MSCs,BMSCs),采用miR-196b-5p-mimics或miR-196b-5p-inhibitor干预后,收集外泌体,检测经不同miR-196b-5p水平外泌体处理后的结肠癌细胞对5-Fu的敏感性,以期为结肠癌的临床治疗提供新的方向。
1 材料与方法
1.1
动物、细胞及试剂
8只健康的无特定病原体(specific pathogen-free,SPF)级BALB/c雌性小鼠(4周龄,15~16 g)购自北京斯贝福生物技术有限公司(动物合格证号:11401500041882)。小鼠结肠癌CT26.WT细胞购自中国科学院上海生命科学研究院细胞资源中心。DMEM-LG和Opti-MEM培养液购自美国HyClone公司,胎牛血清购自美国Gibco;PE标记的鼠抗鼠CD44和CD34单克隆抗体、eFluor® 450标记的鼠抗鼠CD105单克隆抗体和PE标记的鼠抗鼠CD90抗体单克隆抗体购自美国eBioscience;兔抗鼠CD63、CD81、肿瘤易感基因101(tumor susceptibility gene 101,TSG101)和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,P13K)单克隆抗体,兔抗鼠磷酸化PI3K(phospho-PI3K,p-PI3K)、蛋白激酶B(protein kinase B,PKB,又称AKT)和磷酸化AKT(phospho-AKT,p-AKT)多克隆抗体购自英国Abcam,鼠抗鼠多药耐药蛋白(multidrug resistance,MDR)单克隆抗体购自美国CST、兔抗鼠多药耐药相关蛋白(multidrug resistance-associated protein,MRP)多克隆抗体、兔抗鼠肺耐药相关蛋白(lung resistance-related protein,LRP)单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG和山羊抗鼠IgG购自武汉贝茵莱生物科技有限公司。AnnexinⅤ-FITC/碘化丙啶(propidium iodide,PI)凋亡检测试剂框购自美国BD公司。miR-196b-5p-模拟物(mimic)、miR-196b-5p-抑制子(inhibitor)及对应的阴性对照(negative control,NC)-mimic、NC-inhibitor购自广州锐博科技有限公司(货号:miR10001081-1-5、miR20001081-1-5、miR1N0000001-1-5和miR2N0000001-1-5)。LipofectAMINETM 2000购自美国Invitrogen公司,外泌体提取试剂框购自美国SBI,TRIzol试剂购自美国Ambion公司;反转录试剂框购自日本TaKaRa公司,二甲基亚砜购自美国σ公司。
流式细胞仪(NovoCyte)为艾森生物(杭州)有限公司产品,透射电子显微镜(HT7700)为日本日立公司产品,荧光定量PCR仪(CFX-Connect 96)为美国Bio-Rad公司产品,全自动化学发光分析仪(Tanon-5200)为上海天能科技有限公司产品,倒置荧光显微镜(IX53)为日本Olympus公司产品。
1.2
方法
1.2.1
分离培养小鼠BMSCs
颈椎脱臼处死BALB/c小鼠,用75%的乙醇溶液消毒后于超净工作台中取下小鼠双侧股骨及胫骨,剪去骨骺端,暴露骨髓腔。用不含血清的DMEM-LG培养液冲洗髓腔,7号针头反复吹打骨髓制成单细胞悬液。250×g离心10 min,弃上清液;加入少量的DMEM-LG培养液重悬细胞。将细胞悬液缓慢加于等体积的Percoll分离液之上,400×g离心30 min,然后取其第2层乳白色淋巴细胞层于新离心管中,加入10 mL DMEM-LG培养液混匀,175×g离心10 min,弃上清液。加入含15%胎牛血清的DMEM-LG培养液重悬细胞,按3×106个/mL的密度接种于面积为25 cm2的培养瓶中,置于37 ℃、CO2体积分数为5%的培养箱中进行培养,待细胞融合度达到80%以上时进行传代。
1.2.2
鉴定BMSCs
取对数生长期的细胞,用0.25%胰蛋白酶消化处理后吹打制成单细胞悬液。175×g离心5 min,除去上清液;调整细胞密度为1×106个/mL。取100 μL单细胞悬液,加入2 μL PE标记的鼠抗鼠CD44单克隆抗体(0.2 mg/mL)、PE标记的鼠抗鼠CD34单克隆抗体(1×106个细胞/20 μL)、eFluor®450标记的鼠抗鼠CD105单克隆抗体(0.2 mg/mL)或PE标记的鼠抗鼠CD90单克隆抗体(0.1 mg/mL),4 ℃避光孵育30 min。加入2 mL流式染色缓冲液洗涤1次, 250×g离心5 min,弃上清液。加入400 μL流式染色缓冲液重悬细胞,上流式细胞仪检测。
1.2.3
mimics及inhibitor瞬时转染
取1×105个BMSCs,转染前24 h用500 μL不含抗生素的完全培养液重悬细胞。分别取50 μL用Opti-MEM培养液稀释后的20 pmol miR-196b-5p-mimics(或miR-196b-inhibitor)及对应的NC-mimics和NC-inhibitor,加入1 μL LipofectAMINETM 2000,将稀释后的mimics(或inhibitor)与LipofectAMINETM 2000转染试剂混合后室温静置20 min;将转染混合液加入BMSCs中,于恒温培养箱中培养48 h。
1.2.4
提取外泌体
收集未转染miRNA的BMSCs以及转染了miR-196b-5p-mimic(或inhibitor)的BMSCs培养上清液各10 mL,4 ℃ 1 572×g离心15 min。取上清液,加入1/5体积的Exosome Precipitation Solution混匀后,4 ℃过夜。400×g离心15 min,弃上清液。PBS重悬后清洗细胞,400×g离心15 min,弃上清液,加入适量PBS制成外泌体悬液。将外泌体悬液滴加于铜网上,静置5 min,醋酸铀避光染色5 min,双蒸水清洗后滤纸吸干,透射电子显微镜下观察外泌体形态并拍照。
1.2.5
外泌体的鉴定
采用蛋白质印迹法检测外泌体生物标志物CD63、CD81和TSG101的表达情况。提取外泌体总蛋白,蛋白质定量后以每孔20 μg蛋白上样量进行12% SDS-PAGE分离蛋白。将分离后的蛋白转移至PVDF膜上,用封闭液封闭处理2 h。加入一抗[兔抗鼠CD63(体积稀释比例为1∶1 000)、CD81(体积稀释比例为1∶2 000)和TSG101(体积稀释比例为1∶1 000)单克隆抗体]室温孵育1 h;PBST清洗2次后,加入HRP标记的羊抗兔IgG(体积稀释比例为1∶10 000)室温继续孵育1 h;。PBST清洗2次,加入电化学发光剂显色,分析蛋白条带灰度值。
1.2.6
实时荧光定量PCR检测转染效率
提取外泌体总RNA,根据反转录试剂框说明操作合成cDNA,再进行PCR扩增。miR-196b-5p上游引物序列为5’-GGGTAGGTAGTTTCCTG-3’,下游引物序列为5’-AACTGGTGTCG TGGAGTCGGC-3’;内参基因U6上游引物序列为5’-CTCGCTTCGGCAGCACATATACT-3’,下游引物序列为5’-ACGCTTCACGAATTTGCGT GTC-3’。PCR扩增条件:95 ℃ 3 min;95 ℃ 5 s、56 ℃ 10 s、72 ℃ 25 s,共39个循环;65 ℃ 5 s,95 ℃ 50 s。采用2-&δ;&δ;Ct法计算miR-196b-5p相对表达量。
1.2.7
实验分组及处理
将小鼠结肠癌CT26.WT细胞分为6组:培养液(culture medium,CM)组,加入与培养液等体积的BMSCs培养液,培养24 h;外泌体(Exosomes)组,培养液中加入10 μg正常BMSCs分泌的外泌体,培养24 h;Mimic-外泌体(Mimic-exosomes)组,培养液中加入10 μg转染了miR-196b-5p-mimic的BMSCs分泌的外泌体,培养24 h;NC-mimic-外泌体(NC-mimic-exosomes)组,培养液中加入10 μg转染了NC-mimic的BMSCs分泌的外泌体,培养24 h;Inhibitor-外泌体(Inhibitor-exosomes)组,培养液中加入10 μg转染了miR-196b-5p-inhibitor的BMSCs分泌的外泌体,培养24 h;NC-inhibitor-外泌体(NC-inhibitor-exosomes)组,培养液中加入10 μg转染了NC-inhibitor的BMSCs分泌的外泌体,培养24 h。采用实时荧光定量PCR法检测各组细胞中miR-196b-5p的表达水平,实验流程同1.2.6节。
1.2.8
用MTT法筛选5-Fu处理时间
收集各组对数期的细胞(分组同1.2.7节),以5×103个/孔的细胞密度接种于96孔板中,每孔100 μL,置于37 ℃、CO2体积分数为5%的培养箱中培养过夜。各组细胞分别加入不同质量浓度的5-Fu(0、1.0、1.5和2.0 mg/mL),培养24和48 h后每孔加入10 μL MTT试剂(5 mg/mL),培养4 h后除去上清液,每孔再加入150 μL二甲基亚砜,振荡10 min,于酶联免疫检测仪波长490 nm处检测各孔的D值。
1.2.9
FCM法检测细胞凋亡率
收集不同质量浓度5-Fu(0、1.0、1.5和2.0 mg/mL)处理后的各组细胞(分组同1.2.7节),取1×106个细胞,400×g离心5 min,收集细胞;用PBS洗涤细胞,最后加入200 μL PBS重悬细胞。加入10 μL Annexin Ⅴ-FITC和10μL PI,轻轻混匀,避光孵育30 min后,再加入300 μL PBS上流式细胞仪检测细胞凋亡率。
1.2.10
蛋白质印迹法检测耐药相关蛋白及PI3K/AKT通路相关蛋白的表达
采用蛋白质印迹法检测不同质量浓度的5-Fu(0、1.0、1.5和2.0 mg/mL)处理后的各组CT26.WT细胞(分组同1.2.7节)中MDR、MRP、LRP、p-PI3K及p-AKT蛋白的表达水平,实验流程同1.2.5节。一抗分别为鼠抗鼠MDR单克隆抗体(体积稀释比例为1∶1 000)、兔抗鼠MRP多克隆抗体(体积稀释比例为1∶1 000)、兔抗鼠LRP单克隆抗体(体积稀释比例为1∶10 000)、兔抗鼠PI3K单克隆抗体(体积稀释比例为1∶1 000)、兔抗鼠p-PI3K多克隆抗体(体积稀释比例为1∶1 000)、兔抗鼠AKT多克隆抗体(体积稀释比例为1∶500)和兔抗鼠p-AKT多克隆抗体(体积稀释比例为1∶1 000)。
1.2.11
统计学方法
采用SPSS 22.0软件对所有的实验数据进行统计学分析。所有实验均孤立重复3次,计量资料用 ¡À s表示。多组间比较采用单因素方差分析,组内两两比较用LSD-t检验。以P<0.05表示差异具有统计学意义。
2 结 果
2.1
BMSCs鉴定结果
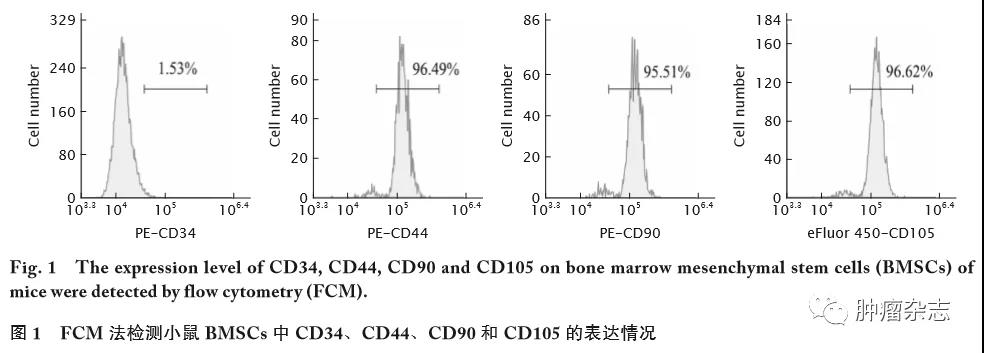
FCM法检测结果(图1)显示,从小鼠骨髓收集获得的小鼠BMSCs表面,CD34表达阴性,CD44、CD90和CD105表达阳性,符合MSCs表面标志物的特征[10],说明本研究成功获得BMSCs。
2.2
外泌体鉴定结果
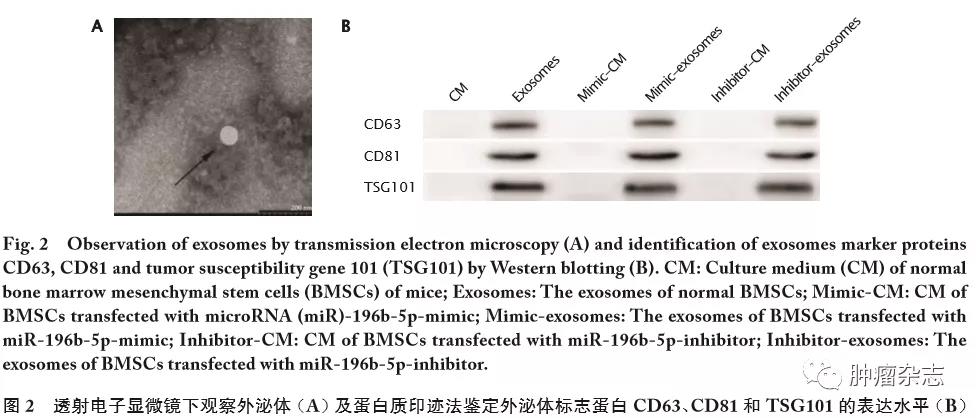
透射电子显微镜下观察收集获得的各组BMSCs来源的外泌体。结果(图2A)发现,收集获得囊泡的直径为60~80 nm。
采用蛋白质印迹法检测含有此种囊泡的培养液以及囊泡提取后的培养液中CD63、CD81和TSG101蛋白的表达情况。结果(图2B)显示,含有囊泡的3个培养液组(Exosomes组、Mimic-exosomes组和Inhibitor-exosomes组)中均高表达CD63、CD81和TSG101,而不含囊泡的3个培养液组(CM组、Mimic-CM组和Inhibitor-CM组)均未检查到标志蛋白CD63、CD81和TSG101的表达,说明本次研究中成功提取到外泌体。
2.3
外泌体及CT26.WT细胞中miR-196b-5p的表达
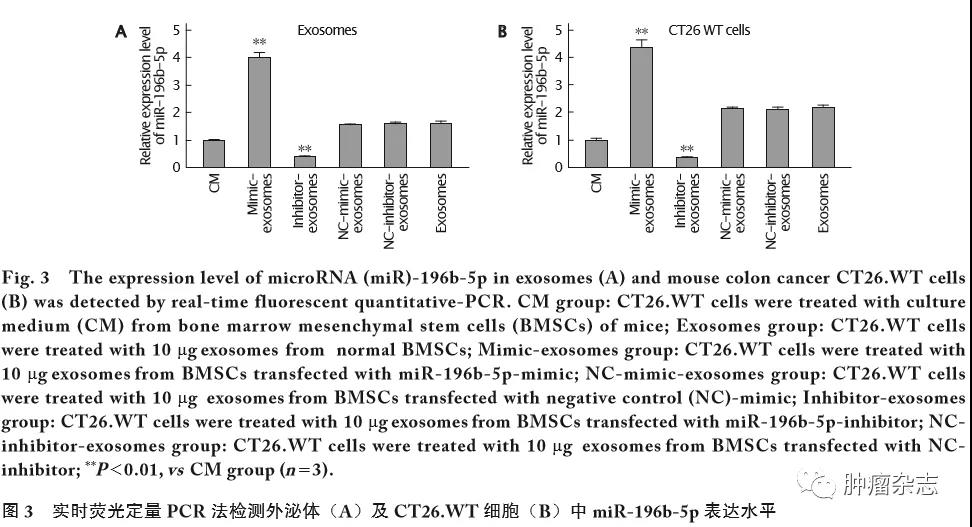
采用实时荧光定量PCR检测外泌体和CT26.WT细胞中miR-196b-5p的表达水平。结果(图3)显示,无论在外泌体还是在CT26.WT细胞中,与CM组、Exosomes组和NC-mimic-exosomes组等对照组相比,Mimic-exosomes组中miR-196b-5p的表达水平明显上调(P 值均<0.01);与CM组、Exosomes组和NC-inhibitor-exosomes组等对照组相比,Inhibitor-exosomes组中miR-196b-5p的表达水平明显下调(P 值均<0.01)。这一结果说明,miR-196b-5p-mimic和miR-196b-5p-inhibitor成功转入BMSCs,影响了外泌体中miR-196b-5p的表达,且携带高(或低)水平miR-196b-5p的外泌体可调控结肠癌CT26.WT细胞中miR-196b-5p的表达水平。
2.4
外泌体对CT26.WT细胞增殖的影响及5-Fu干预时间的筛选
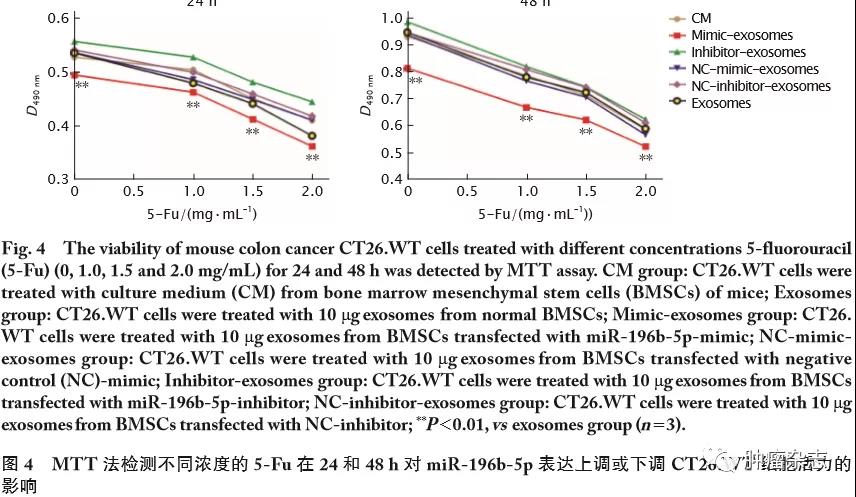
MTT法检测结果(图4)显示,与CM组、Exosomes组和NC-mimic-exosomes组等对照组相比,随着5-Fu质量浓度(0、1.0、1.5和2.0 mg/mL)的升高,Mimic-exosomes组(miR-196b-5p表达上调)CT26.WT细胞的活力明显降低(P<0.01),增殖能力减弱;而Inhibitor-exosomes组(miR-196b-5p表达下调)CT26.WT细胞的活力与CM组、Exosomes组和NC-mimic-exosomes组等对照组间差异无统计学意义。由于24 h时各组细胞活力过低,不适合用于后续实验的检测,故选择48 h作为5-Fu干预细胞的时间。
2.5
外泌体对CT26.WT细胞凋亡水平的影响
FCM法检测结果(图5)显示,不同质量浓度的5-Fu(0、1.0、1.5和2.0 mg/mL)处理各组CT26.WT细胞48 h后,随着药物浓度的升高,各组CT26.WT细胞凋亡率明显升高(P 值均<0.01);同一浓度5-Fu处理后,与CM组、Exosomes组和NC-mimic-exosomes组等对照组相比,Mimic-exosomes组(miR-196b-5p表达上调)CT26.WT细胞的凋亡率明显提高(P<0.01);与CM组、Exosomes组和NC-inhibitor-exosomes组等对照组相比,Inhibitor-exosomes组(miR-196b-5p表达下调)CT26.WT细胞的凋亡率明显降低(P<0.01)。上述结果说明,携有高(或低)水平miR-196b-5p的外泌体可增强(或减弱)5-Fu对小鼠结肠癌CT26.WT细胞凋亡的影响。
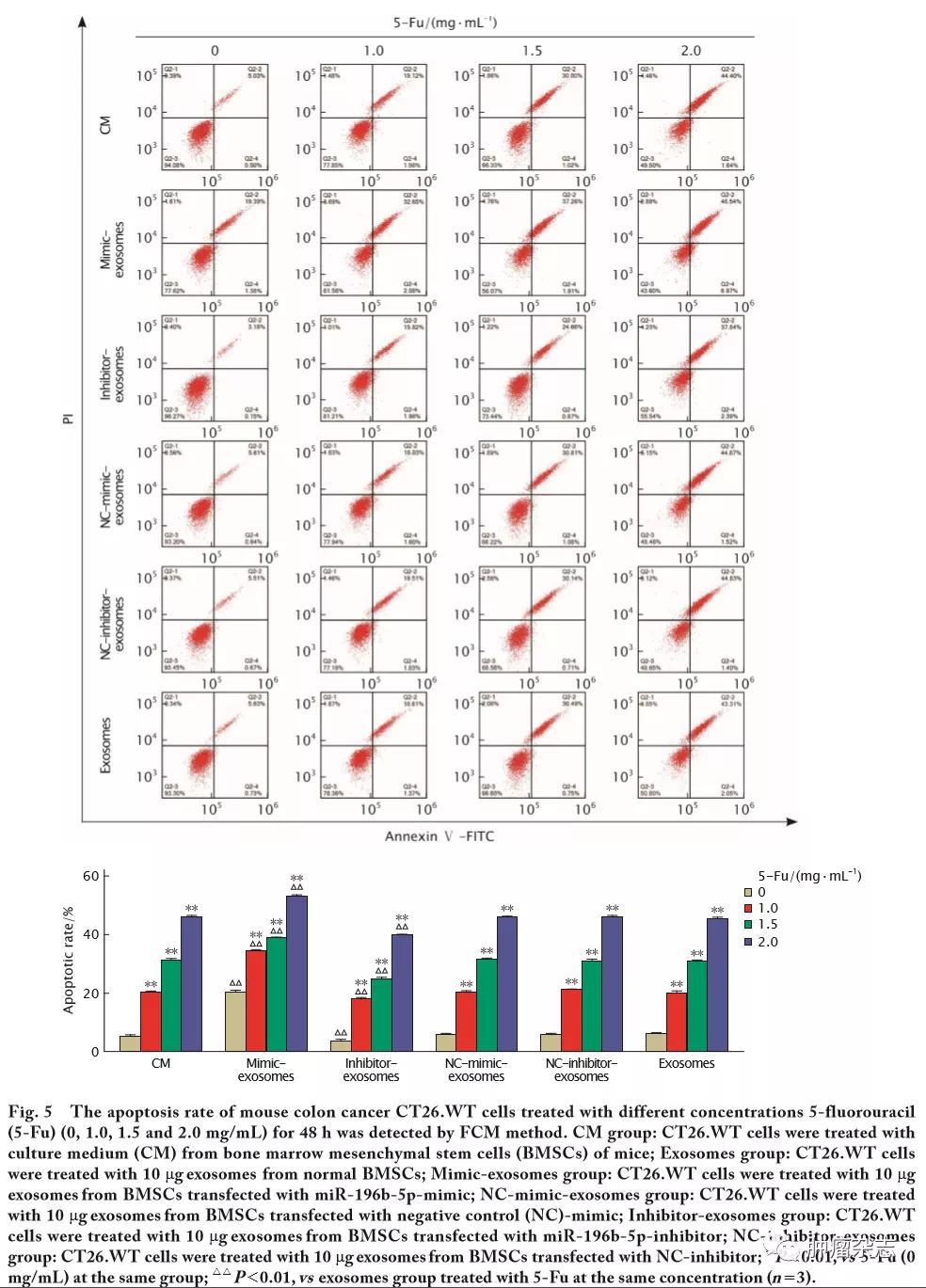
2.6
外泌体对CT26.WT细胞中耐药相关蛋白表达的影响
蛋白质印迹法检测结果(图6A)显示,用不同质量浓度的5-Fu(0、1.0、1.5和2.0 mg/mL)处理下,与Exosomes组比较,Mimic-exosomes组MDR、MRP和LRP蛋白表达水平明显降低(P值均<0.01),Inhibitor-exosomes组均明显升高(P 值均<0.01),说明携有高(或低)水平miR-196b-5p的外泌体可减弱(或增强)结肠癌CT26.WT细胞耐药相关蛋白的表达。
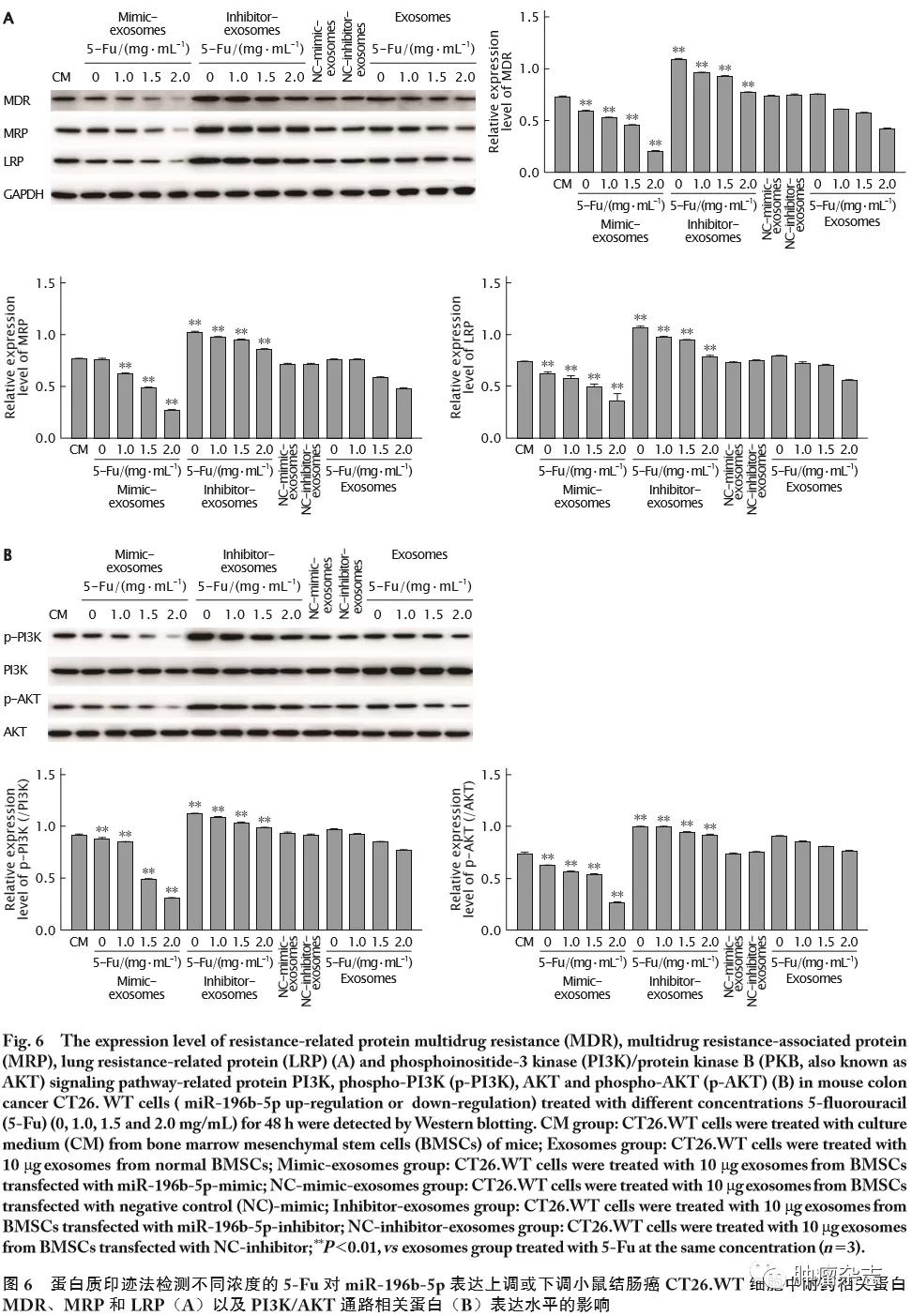
2.7
外泌体对CT26.WT细胞PI3K/AKT通路蛋白表达的影响
蛋白质印迹法检测结果(图6B)显示,在不同质量浓度的5-Fu处理下,与Exosomes组比较,Mimic-exosomes组CT26.WT细胞中p-PI3K和p-AKT的表达水平均明显下调(P 值均<0.01),Inhibitor-exosomes组均明显升高(P 值均<0.01)。这一结果说明,携有高(或低)水平miR-196b-5p的外泌体可减弱(或增强)结肠癌CT26.WT细胞中PI3K/AKT通路中相关蛋白的表达。
3 讨 论
BMSCs是指存在于骨髓基质细胞系统中的一类干细胞,也是最早被发现的干细胞,其广泛应用于多种疾病的基础及临床研究[11]。由于BMSCs具有自我更新和多向分化能力,可对结肠癌的肿瘤微环境进行调节,在结肠癌靶向治疗策略中具有广阔的应用前景[12]。研究显示,BMSCs以独特的旁分泌方式,将携带有脂质、蛋白质和非编码RNA等的外泌体转移到其他细胞,被其他细胞吸收后进而影响该细胞的生物学行为,是一种新型的肿瘤治疗策略[13]。外泌体作为一种新的细胞间信号转导机制[14],可通过不同的作用机制参与肿瘤免疫、转移、侵袭及化疗耐药等过程,其携带的内容物可能是肿瘤诊断和治疗的潜在标志物[15]。
关于miR-196b-5p在结肠癌中的作用,一直以来存在争议。有研究学者认为,沉默miR-196b-5p可抑制结肠癌细胞的增殖,诱导癌细胞凋亡,而高表达miR-196b-5p则会维持癌细胞干性及化疗耐受性[9];然而,STIEGELBAUER等[16]认为,miR-196b-5p低水平与结肠癌患者预后不良有关,当miR-196b-5p低表达时,结肠癌细胞迁移与侵袭能力增强,促进了结肠癌的发展。上述研究均说明,miR-196b-5p表达水平与结肠癌细胞的增殖、迁移、侵袭及化疗敏感性程度具有密切联系,但其在结肠癌细胞中的调控作用却无定论。在前期实验及本次研究结果中,携带有高表达水平miR-196b-5p的外泌体处理结肠癌细胞后,细胞的增殖能力减弱,凋亡增多,提示在本次研究中,miR-196b-5p在结肠癌中发挥着抑癌作用。
手术和化疗是目前治疗结肠癌的主要方法,对于转移性结肠癌,手术切除疗效甚微,化疗成为首选。5-Fu作为结肠癌治疗中最常用的化疗药物之一,癌细胞耐药性成为其临床疗效的主要限制因素,而PI3K/AKT信号通路的激活则参与了结肠癌细胞对5-Fu耐药性产生的过程[17]。MDR和MRP蛋白表达上调后,可抑制药物对癌细胞的毒性作用,即增强癌细胞的化疗耐受性[18]。MRP将药物排出细胞外,降低细胞内药物浓度,从而降低药物对肿瘤细胞的作用[19],而LRP与MRP存在于同一条染色体上,两者的作用可能存在一定的相关性[20]。结合本次研究结果,miR-196b-5p表达上调的外泌体处理结肠癌CT26.WT细胞,耐药相关蛋白(MDR、MRP和LRP)及PI3K/AKT通路激活相关蛋白(p-PI3K和p-AKT)均显著降低,而miR-196b-5p表达下调的外泌体处理后细胞中各蛋白指标均显著升高,提示miR-196b-5p可调控结肠癌CT26.WT细胞对5-Fu的敏感性。
综上所述,携有高水平miR-196b-5p的BMSCs来源的外泌体对结肠癌CT26.WT细胞的药物敏感性具有一定的调控作用,高表达miR-196b-5p可降低癌细胞对5-Fu的耐受性,从而促进细胞凋亡,其机制可能与抑制PI3K/AKT通路激活有关。
更多《肿瘤》杂志文章,请访问以下网址:
https://navi.cnki.net/knavi/JournalDetail?pcode=CJFD&pykm=ZZLL
参考文献
[1]NAVARRO M, NICOLAS A, FERRANDEZ A, et al. Colorectal cancer population screening programs worldwide in 2016: An update[J]. World J Gastroenterol, 2017, 23(20):3632-3642.
[2]LUCAS C, BARNICH N, NGUYEN HTT. Microbiota, inflammation and colorectal cancer[J]. Int J Mol Sci, 2017, 18(6):e1310.
[3]WANG KL, MA LN, BU GB, et al. Tetrandrine reverses the drug resistance of colon cancer to 5-fluorouracil[J]. Biom Res, 2017, 28(11):4843-4848.
[4]REIS LA, BORGES FT, MANUEL J. SIMÕES, et al. Bone Marrow-derived mesenchymal stem cells repaired but did not prevent gentamicin-induced acute kidney injury through paracrine effects in rats[J]. PLoS One, 2012, 7(9):e44092.
[5]SERENA RB, KOOS R, DANIJELA KL, et al. Human bone marrow- and adipose-mesenchymal stem cells secrete exosomes enriched in distinctive miRNA and tRNA species[J]. Stem Cell Res Ther, 2015, 6:127.
[6]RAGER TM, OLSON JK, ZHOU Y, et al. Exosomes secreted from bone marrow-derived mesenchymal stem cells protect the intestines from experimental necrotizing enterocolitis[J]. J Pediatr Surg, 2016, 51(6):942-947.
[7]JI R, ZHANG B, ZHANG X, et al. Exosomes derived from human mesenchymal stem cells confer drug resistance in gastric cancer[J]. Cell Cycle, 2015, 14(15):2473-2483.
[8]SHINDO Y, HAZAMA S, NAKAMURA Y, et al. miR-196b, miR-378a and miR-486 are predictive biomarkers for the efficacy of vaccine treatment in colorectal cancer[J]. Oncol Lett, 2017, 14(2):1355-1362.
[9]REN D, LIN B, ZHANG X, et al. Maintenance of cancer stemness by miR-196b-5p contributes to chemoresistance of colorectal cancer cells via activating STAT3 signaling pathway[J]. Oncotarget, 2017, 8(30):49807-49823.
[10]赵 刚, 刘微微, 高伟玮, 等. 不同组织来源间充质干细胞体外成骨分化能力的比较研究[J]. 中国骨质疏松杂志, 2017, 23(5):561-566, 584.
[11]荣为为, 韩明子, 金世柱, 等. 骨髓间充质干细胞在组织工程研究中的应用新进展[J]. 现代生物医学进展, 2017, 17(05):982-984, 992.
[12]王少川, 宋 武. 骨髓间质干细胞在结直肠肿瘤微环境中的作用[J]. 医学综述, 2015, 21(3):434-437.
[13]MOHAMMED HR, EMINE B, GOUDA KH, et al. Exosomes: From garbage bins to promising therapeutic targets[J]. Int J Mol Sci, 2017, 18(3):538.
[14]YANG YX, YE YQ, SU XH, et al. MSCs-derived exosomes and neuroinflammation, neurogenesis and therapy of traumatic brain injury[J]. Front Cell Neurosci, 2017, 11:55.
[15]林 锋, 钱海利. Exosome在肿瘤发展中的研究进展[J]. 癌症进展, 2016, 14(8):725-729.
[16]STIEGELBAUER V, VYCHYTILOVA-FALTEJSKOVA P, KARBIENER M, et al. MicroRNA-196b-5p regulates colorectal cancer cell migration and metastases through interaction of HOXB7 and GALNT5[J]. Clil Cancer Res, 2017, 23(17):5255-5266.
[17]GAO Y, XIAO X, ZHANG C, et al. Melatonin synergizes the chemotherapeutic effect of 5-fluorouracil in colon cancer by suppressing PI3K/AKT and NF-κB/iNOS signaling pathways[J]. J Pineal Res, 2017, 62(2):e12380.
[18]CAI B, MIAO Y, LIU Y, et al. Nuclear multidrug-resistance related protein 1 contributes to multidrug-resistance of mucoepidermoid carcinoma mainly via regulating multidrug-resistance protein 1: A human mucoepidermoid carcinoma cells model and spearman’s rank correlation analysis[J]. PLoS One, 2013, 8(8): e69611.
[19]YANG AK, ZHOU ZW, WEI MQ, et al. Modulators of multidrug resistance associated proteins in the management of anticancer and antimicrobial drug resistance and the treatment of inflammatory diseases[J]. Curr Top Med Chem, 2010, 10(17):1732-1756.
[20]孔 易, 胡占峰, 徐树雷, 等. 多药耐药相关蛋白和肺耐药蛋白在大肠癌中的表达及其意义[J]. 广东医学, 2014, 35(2):255-257.