免疫稳态主力军:调节性T细胞发育
#1
调节性T细胞
Foxp3+CD4+调节性T(Treg)细胞约占T细胞的5-7%,在预防自身免疫疾病和维持免疫稳态中起核心作用,但同时也是抗肿瘤免疫的主要障碍。
Treg细胞的主要特征是组成性高表达CD25(IL-2受体α链),和β和γ链形成高亲和力的IL-2受体,此外还表达抑制分子CTLA-4。
CTLA-4是一个关键Treg抑制性分子,在后期,CTLA-4水平逐渐降低,其他抑制分子如LAG3和IL-10增加来填补。
Treg细胞还利用多种抑制分子发挥抑制作用,包括IL-10、TGF-β,IL-35、TIGIT、CD39和CD73,也是抑制自身免疫重要力量。
胸腺是Treg细胞发育的主要部位。
#2
调节性T细胞发育
对Treg细胞发育的早期研究表明,出生两天,Foxp3+CD4+细胞出现在胸腺中,在第三天出现在外周。
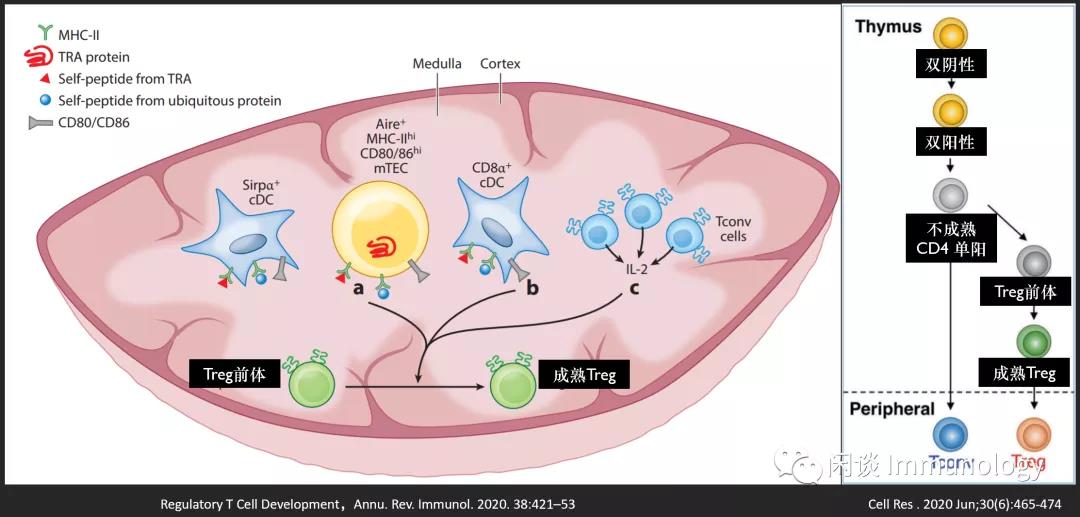
很多研究工作集中在确定Treg细胞分化启动和完全执行的胸腺区域。

这些信号是如何传递的,以及它们是否必须按一定的顺序,仍然是一个热门研究领域。阳性选择的胸腺细胞进入髓质,在那里他们遇到一组APC递呈的自身pMHC-II配体和辅助信号。

#3
MHC-II自身抗原--Treg自身耐受的形成
用质谱分析胸腺中MHCII类分子中洗脱肽。结果表明,大多数肽为广泛表达的蛋白质(包括核蛋白、胞浆蛋白、分泌蛋白和跨膜蛋白)。这些肽的来源还无法完全解析,应该包括胸腺APC本身递呈的内源性抗原的混合物,再加上从胸腺血液或间质液中的外源性抗原。
细胞内的蛋白质可以通过自噬途径,在胸腺中的MHC-II分子上呈递,当这一途径被破坏时,T细胞的选择和自我耐受性受到干扰。
T细胞选择最吸引人的研究之一,是胸腺中异位基因表达(PGE)。早期证据来自于转基因小鼠,发现在胸腺有胰岛素及其他基因启动子的意外表达,而这些基因本来是有组织限定的(即在特定组织表达,称之为组织限制性抗原,tissue-restricted antigens ,TRAs)。后续的研究认为PEG不是转基因的产物,而是机体高度协调的过程,是产生耐受的基础。
TRAs由胸腺内基质细胞表达,PEG产生数千个包括外周基因在内的转录本。
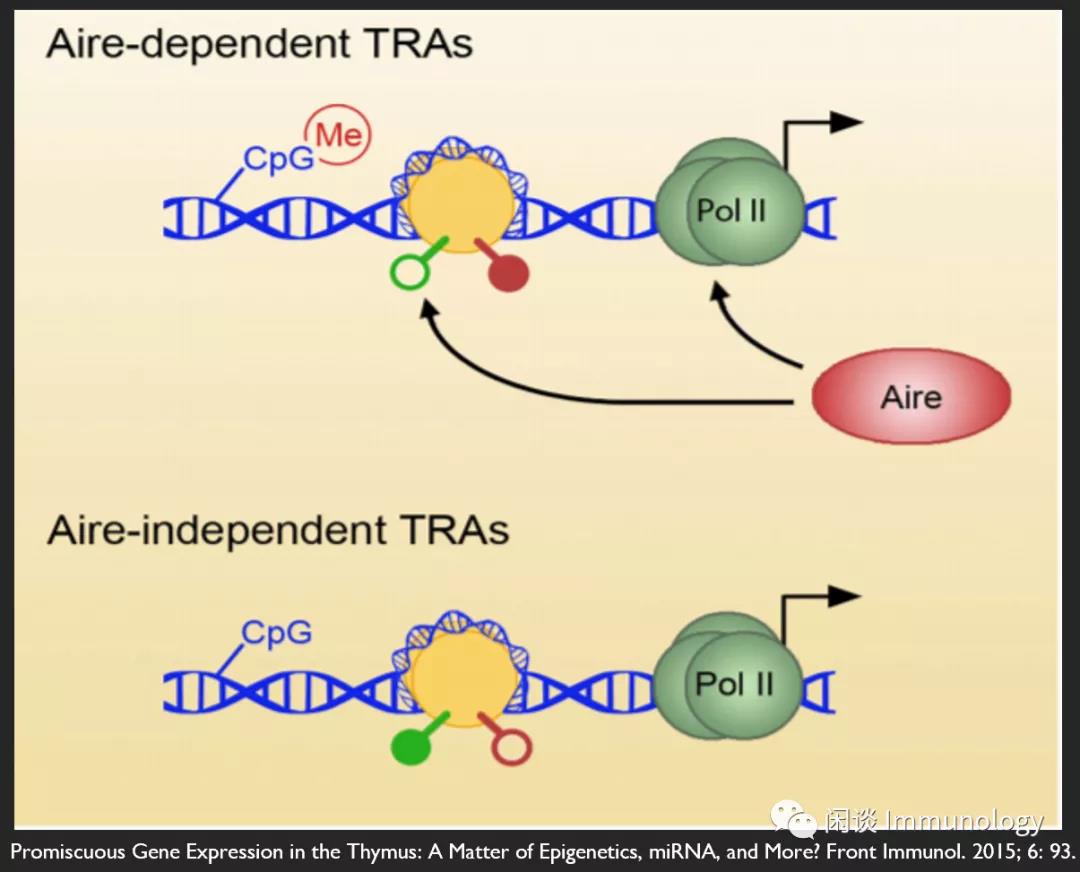
自身免疫调节因子(Aire)是一种转录激活调节因子,由mTECs优先表达,调节PEGs。Aire突变,丧失功能,会产生自身免疫性多腺综合征1(APS-1)。
自身肽在胸腺中的异位表达,由Aire依赖和Aire非依赖的机制驱动,在很大程度上被认为是通过驱动发育中的胸腺细胞的克隆缺失来促进耐受性的,这些胸腺细胞对自身肽具有反应性。
#4
寻求稳定性:Treg细胞表观遗传程序
单纯表达Foxp3,并不足以赋予Treg细胞身份,必须与适当的表观遗传配对。其关键表观遗传特征之一是CpGs去甲基化。这种低甲基化模式开始于胸腺发育的早期阶段,是Treg谱系稳定性的关键。为其他关键转录因子提供支架。这种DNA去甲基化模式将真正的Treg细胞与瞬时上调Foxp3的不稳定Treg细胞区分开来(例如,用TGF-β诱导的Treg细胞表现出高表达的Foxp3蛋白,但缺乏Treg细胞特异性去甲基化特征)。
喵评:调节性T细胞维持免疫稳态的重要力量,未来还会有更深入的研究,值得持续关注......
主要参考文献
Fontenot JD, Gavin MA, Rudensky AY. 2003. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat. Immunol. 4:330–36
Hori S, Nomura T, Sakaguchi S. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science 299:1057–61
Fontenot JD, Rasmussen JP,Williams LM, Dooley JL, Farr AG, Rudensky AY. 2005. Regulatory T cell lineage specification by the forkhead transcription factor Foxp3. Immunity 22:329–41
Peter A. Savage, David E.J. Klawon, and Christine H. Miller. Regulatory T Cell Development,Annu. Rev. Immunol. 2020. 38:421–53
Hanahan D. 1998. Peripheral-antigen-expressing cells in thymic medulla: factors in self-tolerance and autoimmunity. Curr. Opin. Immunol. 10:656–62
Ohkura N, Hamaguchi M, Morikawa H, Sugimura K,Tanaka A, et al. 2012.T cell receptor stimulation induced epigenetic changes and Foxp3 expression are independent and complementary events required for Treg cell development. Immunity 37:785–99
Zheng Y, Josefowicz S, Chaudhry A, Peng XP, Forbush K, Rudensky AY. 2010. Role of conserved noncoding DNA elements in the Foxp3 gene in regulatory T-cell fate. Nature 463:808–12
Naganari Ohkura et al, Transcriptional and epigenetic basis of Treg cell development and function: its genetic anomalies or variations in autoimmune diseases Cell Res . 2020 Jun;30(6):465-474
Olga Ucar, and Kristin Rattay,Promiscuous Gene Expression in the Thymus: A Matter of Epigenetics, miRNA, and More? Front Immunol. 2015; 6: 93.