中国首创MET-TKI赛沃替尼Savolitinib的前世今生
赛沃替尼(Savolitinib,原称沃利替尼)是中国自主原创的高度选择性口服MET-TKI,目前正开展着多项临床试验。奥希替尼联合赛沃替尼治疗EGFR-TKI靶向治疗耐药后MET扩增的NSCLC的ⅠB期TATTON研究队列B和D结果已发表在《柳叶刀·肿瘤》(The Lancet Oncology)杂志,2020年美国临床肿瘤学会(ASCO)年会上也报道了赛沃替尼治疗MET 14外显子跳跃突变肺肉瘤样癌(PSC)或其他非小细胞肺癌(NSCLC)亚型的国内Ⅱ期注册临床研究(NCT02897479)最新结果。目前,中国国家药品监督管理局(NMPA)已将赛沃替尼治疗MET 14外显子跳跃突变NSCLC的新药上市申请纳入优先审评,并将以全新通用名赛沃替尼(原称沃利替尼)上市造福中国患者。
关于赛沃替尼
在中国,每年新增肺癌病例超过77.4万例,占全球肺癌新增病例的37%,其中约80%~85%的肺癌属于NSCLC。NSCLC是一种复杂的疾病,有许多不同的潜在基因突变驱动肿瘤的形成和发生发展。据估计,约2%~3%的NSCLC患者会发生MET 14外显子跳跃突变,伴有此类突变的患者预后普遍较差。在中国,每年约新增12000至20000例MET 14外显子跳跃突变的NSCLC新增病例。此外,MET扩增还是EGFR突变阳性晚期NSCLC患者使用EGFR-TKI治疗后的获得性耐药机制之一,此类患者往往缺乏行之有效的后续治疗选择。
赛沃替尼(Savolitinib,原称沃利替尼)是一种口服的高选择性小分子MET-TKI,最初由和黄中国医药科技有限公司发现,阿斯利康在2011年就赛沃替尼与其签订了全球专利许可、合作开发和商业化协议。赛沃替尼的全球开发计划包括NSCLC与肾癌,并且正在探索用于治疗其他MET驱动的肿瘤。迄今为止,赛沃替尼已在全球范围内逾1000名患者中开展研究。临床试验显示,赛沃替尼在多种MET基因异常的肿瘤中均表现出了良好的临床疗效,并且具有可接受的安全性特征[1]。如今,NMPA已将赛沃替尼治疗MET 14外显子跳跃突变NSCLC的新药上市申请纳入优先审评,纳入优先审评资格的新药上市申请可获NMPA在审评审批的过程中优先配置资源。同时,这是赛沃替尼在全球范围内的首个新药上市申请,也是中国首个选择性MET-TKI的新药上市申请。
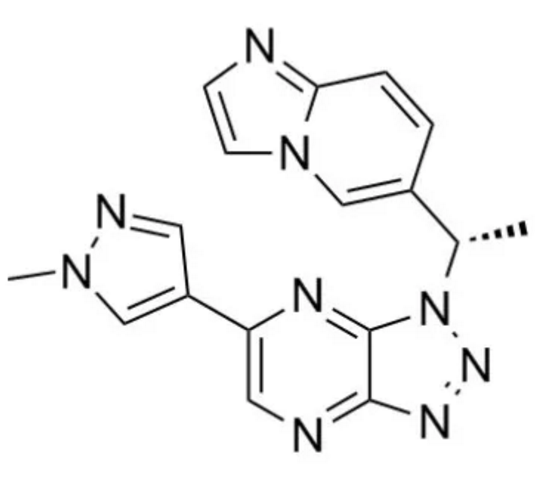
图1. 赛沃替尼化学结构式(图片来源:medchemexpress.com)
关于赛沃替尼国内Ⅱ期注册临床研究(NCT02897479)
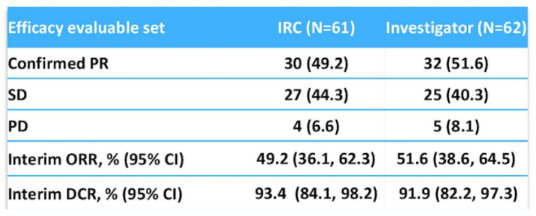
2020年ASCO年会上,上海交通大学附属胸科医院陆舜教授团队报告了一项关于赛沃替尼治疗MET 14外显子跳跃突变PSC或其他NSCLC亚型的Ⅱ期临床研究最新结果[2]。在这项中国多中心、单臂的Ⅱ期研究中,纳入70例MET 14外显子跳跃突变的患者,PSC比例高达35.7%,其他NSCLC亚型45例(64.3%)。患者每日一次接受赛沃替尼600mg(体重≥50kg)或400mg(体重<50kg)治疗,21天为一个周期,直至疾病进展或出现不可接受的毒性。主要研究终点为根据RECIST v1.1标准,孤立评审委员会(IRC)评估的客观缓解率(ORR)。次要研究终点包括疾病控制率(DCR)、缓解持续时间(DoR)、起效时间(TTR)、PFS、6个月PFS率、总生存期(OS)、安全性和耐受性。
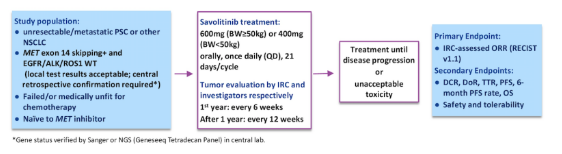
图2. 研究设计及入组标准
表1. 可评估患者的疗效
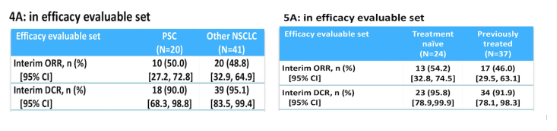
根据病理亚型进行亚组分析,PSC患者的ORR为50%,DCR为90%,DoR尚未达到;其他NSCLC亚型患者的ORR为48.8%,DCR为95.1%,DoR达到9.6个月,中位PFS达到9.7个月;根据治疗线数进行亚组分析,初治患者的ORR为54.2%,DCR为95.8%;经治患者的ORR为46.0%,DCR为91.9%,DoR尚未达到。
表2. PSC/其他NSCLC亚型(左)和初治/经治(右)患者的疗效
赛沃替尼治疗相关不良事件(AE)多为1~2级,最常见的不良反应(≥15%)包括外周性水肿、恶心、AST/ALT升高、呕吐等。因治疗相关AE而导致中断治疗的发生率较低,约为14%,并且无间质性肺炎发生。
关于TATTON研究

TATTON研究[3]是一项多臂、多中心、开放标签的Ⅰb期研究,纳入经EGFR-TKI治疗后出现疾病进展且伴MET扩增的局部晚期或转移性EGFR敏感突变NSCLC患者。两个全球性扩展队列B和D详见研究设计。队列B共入组144例EGFR突变阳性伴MET扩增NSCLC患者(B1组69例,B2组51例,B3组18例)。B1组中有超过三分之一患者既往接受过三线或三线以上治疗,而B2和B3亚组中患者既往接受治疗线数相对较少。主要研究终点是安全性和耐受性,次要终点为ORR。
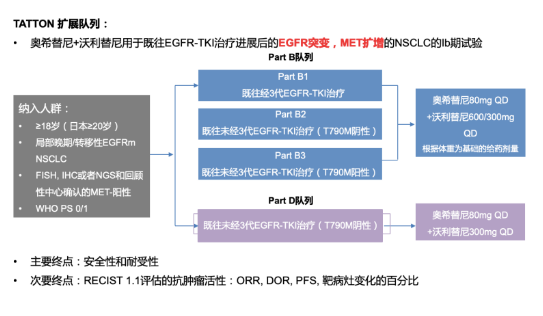
图3. TATTON研究队列B和D研究设计及入组标准
研究结果显示,队列B中,既往未接受3代EGFR-TKI治疗组B2/B3/D组的ORR分别为65%,67%和64%;既往未接受3代EGFR-TKI治疗组B2/B3/D组的PFS分别为9个月、11个月和9.1个月。
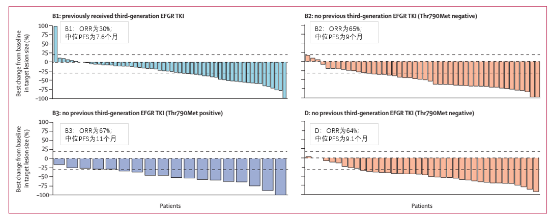
图4. TATTON研究队列B(B1、B2、B3)和D患者的靶病灶变化和疗效
目前,虽然国内还没有一个MET-TKI获批,但是中国原创MET-TKI赛沃替尼针对中国人群开展的国内Ⅱ期注册临床研究(NCT02897479)已取得良好疗效,并基于该研究,NMPA已将赛沃替尼治疗MET 14外显子跳跃突变NSCLC的新药上市申请纳入优先审评。同时,TATTON研究也证实奥希替尼联合赛沃替尼在EGFR敏感突变伴MET扩增晚期NSCLC患者中具有初步抗肿瘤活性和较高的安全性。此外,旨在评估奥希替尼联合赛沃替尼对于奥希替尼治疗耐药后伴MET扩增的EGFR敏感突变晚期NSCLC患者疗效的SAVANNAH研究(NCT03778229)正在进行中,多药Ⅱ期平台ORCHARD研究(NCT03944772)也在进行中,涉及一线奥希替尼治疗耐药后多种耐药机制治疗组分配,其中包括奥希替尼联合赛沃替尼。总体而言,无论是对于MET 14外显子跳跃突变还是MET扩增NSCLC,赛沃替尼的未来应用前景都非常值得期待。
参考文献
1、 Chi-Med's savolitinib nabs accelerated review status in China.
2、 Shun Lu, Jian Fang, Xingya Li, et al. Phase II study of savolitinib in patients(pts) with pulmonary sarcomatoid carcinoma(PSC) and other types of non-small cell lung cancer(NSCLC) harboring MET exon 14 skipping mutations(METex14+). J Clin Oncol 38: 2020(suppl; abstr 9519).
3、 Lecia V Sequist, Ji-Youn Han, Myung-Ju Ahn et al. Osimertinib plus savolitinib in patients with EGFR mutation-positive, MET-amplified, non-small-cell lung cancer after progression on EGFR tyrosine kinase inhibitors: interim results from a multicentre, open-label, phase 1b study. Lancet Oncol. 2020 Mar;21(3):373-386. doi: 10.1016/S1470-2045(19)30785-5.