国产原研药达伯舒蓄势待发,直冲治疗一线
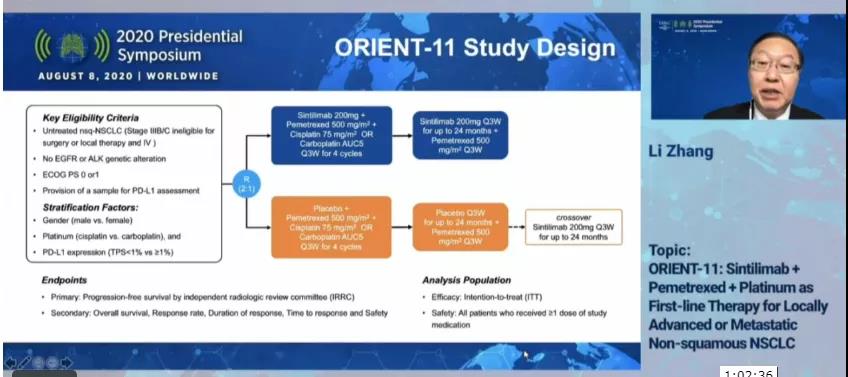
在2020年世界肺癌大会(WCLC2020)会前会上,中山大学肿瘤防治中心肺癌首席专家张力教授解读了ORIENT-11的相关研究结果(图1):国产肿瘤免疫药达伯舒®(信迪利单抗注射液)联合化疗用于治疗一线非鳞状非小细胞肺癌(NSCLC)结果令人满意。

ORIENT-11研究
研究设计
研究共招募了397例晚期NSCLC患者,按照随机、双盲、安慰剂对照的方法将患者随机分成两组:一组是将131人用单纯化疗加安慰剂治疗;另一组是将266人用达伯舒联合化疗治疗。治疗终点为无进展生存期(PFS),即治疗一直持续至患者疾病出现进展(如图2)。
研究结果
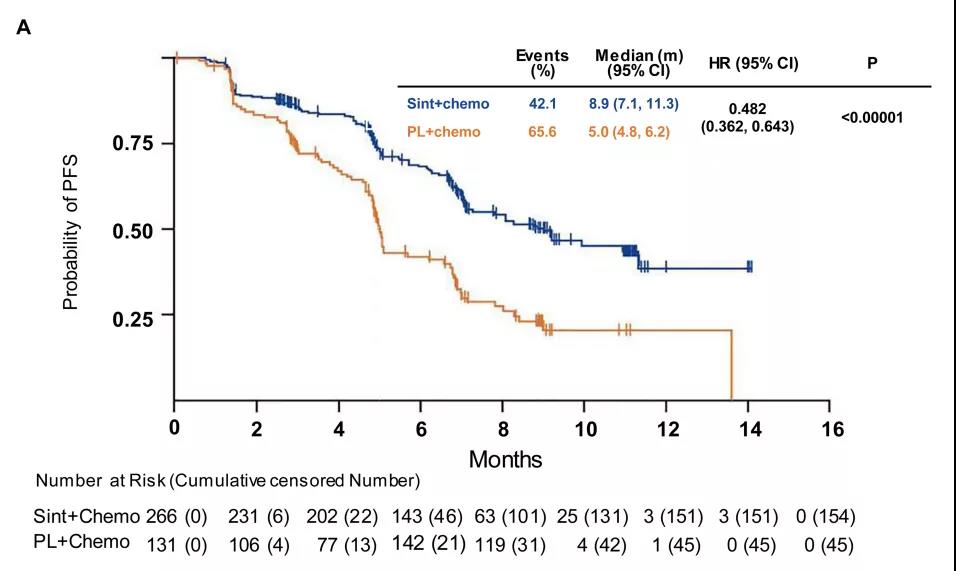
1. 中位无进展生存期显著延长:达伯舒联合化疗组的中位无进展生存期(FPS)是8.9个月,也就是从治疗开始接近9个月肿瘤都不进展;而单纯化疗组的患者在5个月就出现疾病进展(如图3);
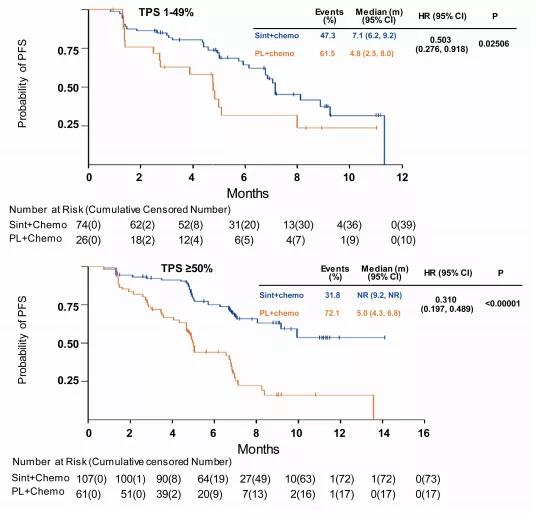
值得注意的是,随着PD-L1表达的升高,PFS获益显著增加(如图4),也就意味着对于PD-L1高表达的患者,可以获益多多。
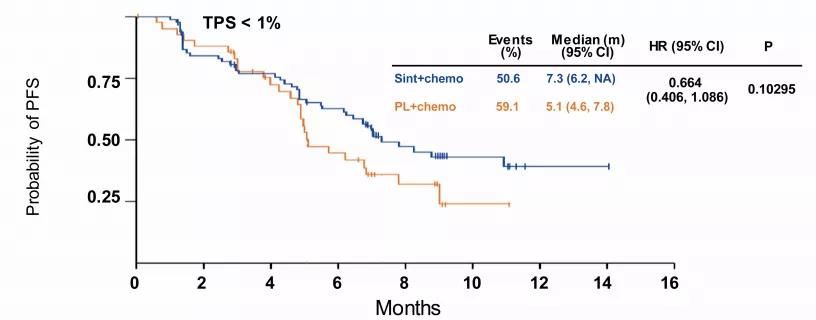
但对于PD-L1阴性患者,获益虽然在统计学上差异并不明显,但是对比安慰剂组,仍表现为获益(如图5)。
2. 生存期提升,1年生存率接近70%
虽然两组总生存期数据均未达到预期,但两组生存曲线已经分开,而且达伯舒组明显高于安慰剂组(如图6);
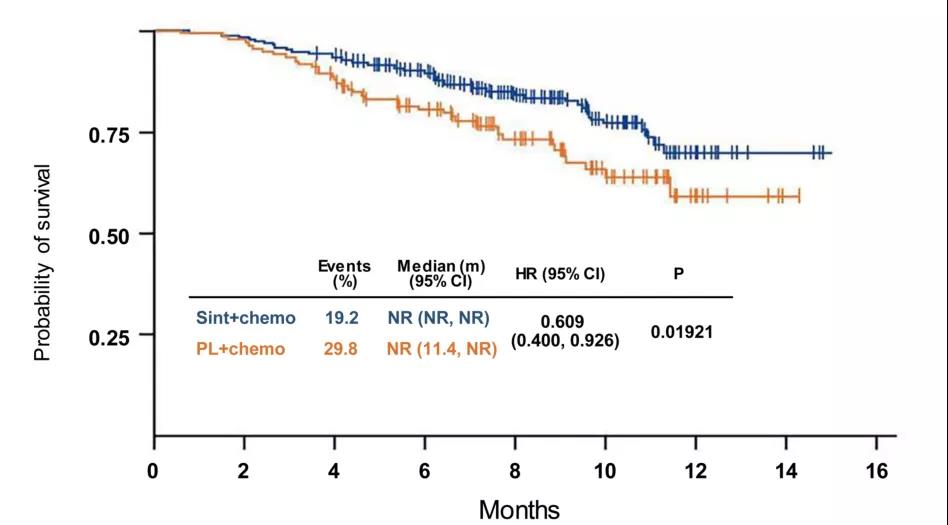
根据张力教授补充说,总生存期数据未达到预期,是因为达伯舒组患者的总生存期还未成熟,观察时间较短,但截止到中期分析,约80%的患者仍生存,1年生存率已经接近70%。
3. 客观缓解率显著提高:达伯舒组客观缓解率(ORR)达51.9%,明显高于安慰剂组的29.8%。此外达伯舒组起效更快,中位起效时间为1.5个月。
4. 耐受性良好:两组严重不良反应发生率总体相近,但达伯舒组患者因不良反应中止治疗或死亡的比例较低,常见的不良反应是皮疹、免疫相关性的内分泌功能异常和肺炎等(如图7)。但张力教授表示,以上不良反应都是可控可处理的。
达伯舒®(信迪利单抗注射液)作为2019年唯一进入国家医保目录的PD-1单抗产品,为中国癌症患者带来了长期生存的希望。在今年4月底,达伯舒®(信迪利单抗注射液)用于治疗非鳞NSCLC的相关审批数据已经提交国家药监局,预估明年初有望拿到国家适应证批准。我们期待达伯舒®(信迪利单抗注射液)能尽早获批肺癌一线,尽早为患者所用。
参考文献:
[1] Yang Y, Zhang L .,et al. Efficacy and safety of sintilimab plus pemetrexed and platinum as first-line treatment for locally advanced or metastatic nonsquamous non-small cell lung cancer: a randomized, double-blind, phase 3 study(ORIENT-11), Journal of Thoracic Oncology(2020), doi: https://doi.org/10.1016/j.jtho.2020.07.014.