国际大咖带你了解复发或难治性AML的治疗策略
数十年来,复发难治性急性髓系白血病(AML)的治疗一直是临床面临的挑战。尽管进行了大量的临床研究,但结果始终不尽如人意,5年总生存率(OS)仅为10%(ECOG-ACRIN研究)。再次完全缓解(CR)后异基因造血细胞移植(Allo-HCT)治疗仍然是少数具有治疗潜力的方案选择。但是,最近几种新药的获批改变了AML患者延续近半个世纪的治疗方法。这种新的方式为重新探索复发难治性AML的治疗提供了机会。近日,纪念斯隆凯特琳癌症中心的Susan DeWolf 教授和Tallman教授通过具体的案例,分享了复发难治性AML患者的治疗策略,并发表在《血液》(Blood)杂志的How I Treat系列,【肿瘤资讯】小编特此整理,以饕读者。
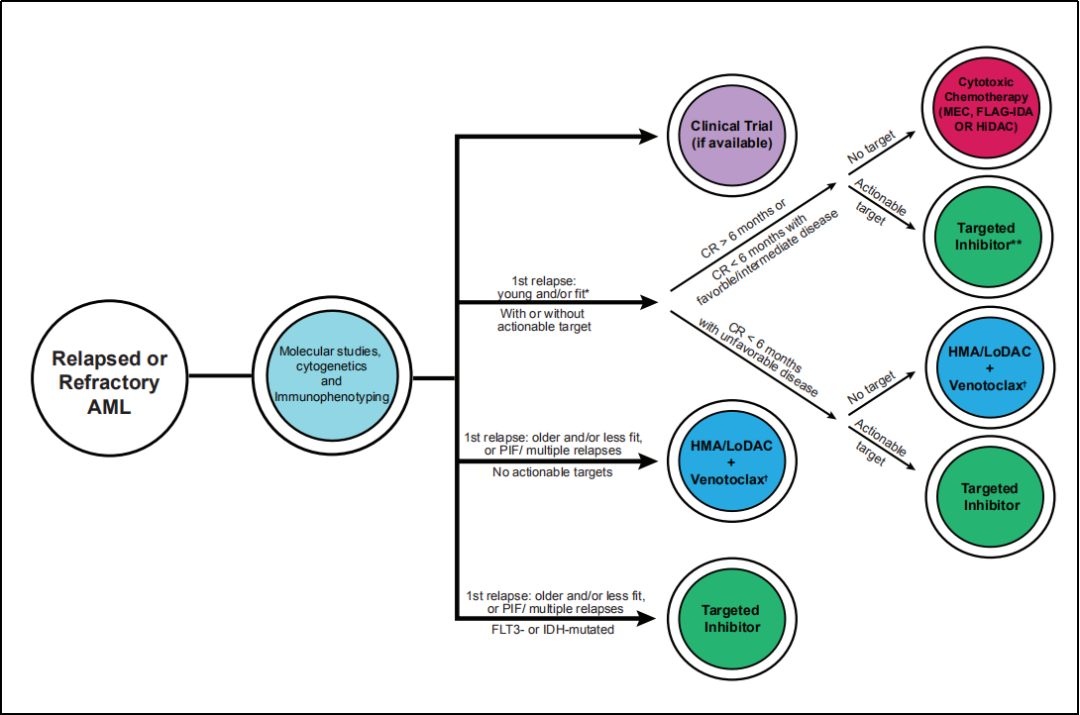
图1 复发或难治性AML患者治疗的策略
复发难治性的精确定义
面对不断变化的缓解标准,对复发和难治性疾病的精确定义十分重要,原发难治性疾病(PRD)目前尚无统一的定义。研究者认为PRD,也称为初始诱导失败(PIF),是一种持续白血病状态,在至少两个疗程的强化诱导治疗后,幼稚细胞数超过5%,这也是2017年ELN指南提出的标准。但是5%的标准已经过于陈旧,目前已不仅依赖于从形态学方面检测微小残留疾病(MRD)的存在。在以Venetoclax为基础的非强化疗方案和靶向治疗日益兴盛的时代,基于最新的前瞻性数据,研究者倾向于使用去甲基化药物或低剂量阿糖胞苷,联合Venetoclax进行2疗程治疗,后续根据患者的缓解情况进行方案的调整。就靶向治疗而言,患者的中位缓解时间通常超过2个月,确定治疗失败也是一个很大的挑战,研究者一般会延用治疗方案直至疾病进展为止。
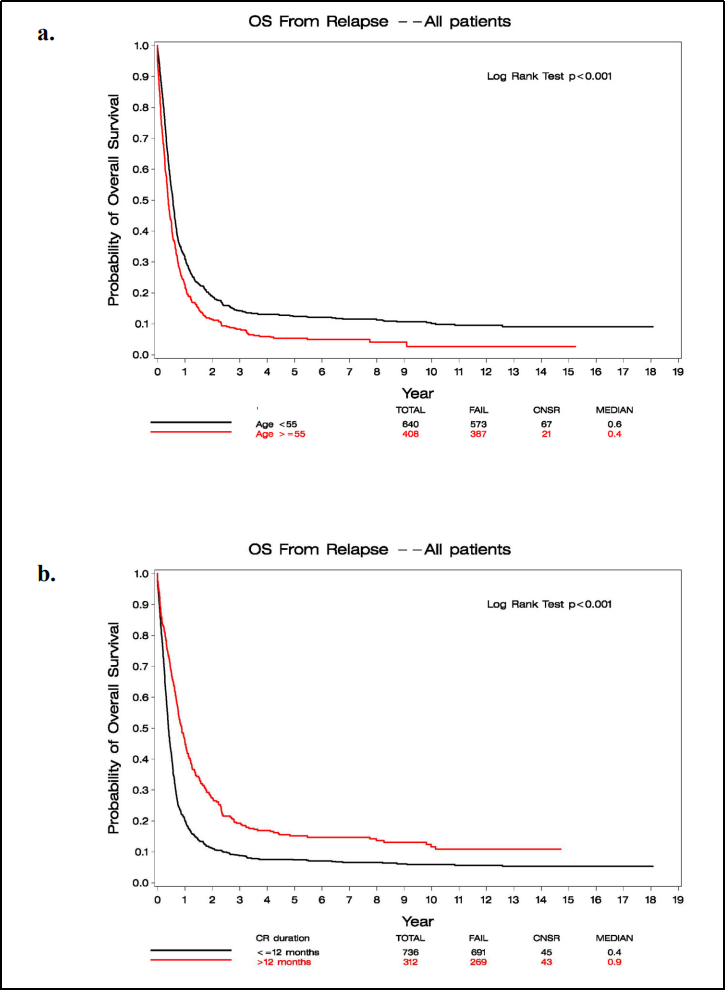
图2 基于ECOG-ACRIN研究长期随访(1984-2008)结果:OS和持续CR
复发疾病主要分为两类:骨髓或髓外明显的形态学复发、初始清除后MRD的再次出现。采用流式细胞术或母细胞表型分析对患者进行定期的骨髓评估,可以监控患者的疾病复发情况。在一些分子水平突变亚型,例如NPM1突变型AML中,MRD与较高的复发率相关。然而,也需要进一步研究,来阐明MRD检测的技术与异常克隆检测的临床意义,其中一些克隆可能是白血病前病变,而不是复发的潜在因素。
表1 ELN指南修正的复发难治性AML的定义

预后因素
首次完全缓解(CR)的持续时间是AML患者复发的主要风险因素,在首次诱导治疗后1年内复发的患者预后最差。其他孤立因素,例如年龄、细胞遗传学诊断、某些分子特性如FLT3 内部串联重复(ITD)突变状态和既往Allo-HCT治疗史,在患者的疾病进展中也发挥了作用。EPI和GOELAMS为2种主要的预后评分系统,对复发后的患者预后进行很好的分层。
病例1:早期复发的年轻AML患者
患者基本病情及治疗过程
女性,年龄30,平素体健,患有AML和髓外疾病,在强化诱导治疗和巩固化疗后仅2个月复发。患者最初表现为宫颈腺病,白细胞计数(WBC)为322 K/μL,急需行白细胞去除术。骨髓象显示,骨髓中含有90%的异常骨髓幼稚细胞(CD34+、CD11b+、CD15+、CD33+、CD117+、CD123+、HLA-DR+)。进一步分析发现,患者存在DNMT3A突变,核型正常。PET-CT检测结果显示,局限于宫颈和盆腔的淋巴结FDG增高;腰椎穿刺鞘内化疗证实无恶性脑脊液细胞。
患者接受阿糖胞苷+柔红霉素(90mg/m2)诱导治疗,1个月后患者的骨髓MRD呈阴性。患者选择不进行移植治疗,并采用高剂量阿糖胞苷(HiDAC)进行4个疗程的巩固治疗。然而,治2个月后患者的宫颈腺病复发,骨髓检查显示55%的幼稚细胞与与原发疾病具有相同的表型和突变类型。患者很快接受MEC诱导(mitoxantrone/etoposide/阿糖胞苷)治疗,通过流式细胞术检测MRD(白细胞计数1.8%)显示其再次达到形态学CR,继而患者行Allo-HCT治疗,并治疗1年内达到持续CR。然而,鉴于患者接受了移植治疗,并首次缓解短暂,其长期预后仍然不确定。
经典HiDAC的方案正在逐渐被替代
对于年轻患者的早期复发,在没有明确的靶向突变的情况下,强化疗诱导治疗后联合Allo-HCT是标准的治疗方案。HiDAC的早期治疗研究始于1980s,但由于临床研究证实减低剂量阿糖胞苷(1.5~2g/m2)方案与经典的HiDAC(3g/m2)方案的疗效相似,经典的HiDAC已被较少运用,从而减低治疗中产生的毒性。目前研究者往往考虑采用MEC和FLAG-IDA的治疗方案。
靶向治疗在FLT3突变患者治疗中的运用
近30%的AML患者存在FLT3突变,小分子抑制剂的发展为FLT3突变患者提供了新的治疗模式。近期,随机、Ⅲ期临床研究ADMIRAL,探索了FLT3抑制剂Gilteritinib治疗原发性难治或首次复发的FLT3突变AML患者的安全性及疗效性。该研究结果的发布不仅成为2018年Gilteritinib治疗复发或难治性FLT3突变患者的获批依据,同时也改变了此类患者的标准治疗格局。Gilteritinib单药治疗患者的中位总生存(OS)为9.3个月,而诱导化疗(低剂量阿糖胞苷、阿扎胞苷、MEC或FLAG-IDA)组的中位OS仅为5.6个月。生存期较长的2个亚组为FLT3-ITD阳性的患者(中位OS为7.1个月 vs 4.3个月)和具有某些多重突变的患者,如NPM1和DNMT3A(中位OS为10.8个月 vs 8.9个月)。基于上述,如果病例1患者为FLT3-ITD 阳性,后续应该如何治疗是值得探讨的问题。在ADMIRAL研究的指导下,考虑患者的临床病程和疾病生物学特性,如果患者在首次复发时出现FLT3突变,研究者推荐使用Gilteritinib代替强化化疗方案进行治疗。
病例2:首次诱导治疗失败的案例
患者基本病情及治疗过程
男性,年龄52,无明显病史,临床表现为呼吸短促。经血常规检测为贫血,血红蛋白6.2 g/dL,外周血中出现幼稚细胞。经骨髓活检和细胞遗传学分析确诊为AML,核型[46,XY,inv(3)(q21q26)],无其他相关突变,预后很差。患者最初幼稚细胞比例持续>70%,并接受阿糖胞苷联合柔红霉素诱导治疗。随后进行了经典的HiDAC治疗,但在后续的骨髓评估中仍有33%的幼稚细胞。在临床试验失败后,患者再次接受MEC诱导治疗,疾病继续恶化。最终,在诊断8个月后,患者接受了2个疗程的阿扎胞苷联合Venetoclax治疗,经流式细胞术检测MRD呈阴性,达到CR。患者随后行了Allo-HCT治疗,2年来病情持续缓解。
以BCL-2抑制剂为基础的联合方案正在改变初治AML患者的治疗格局
该患者属于PIF类,在经过至少2个疗程的强化疗后仍未达到CR。口服BCL-2抑制剂Venetoclax 联合HMAs(Decitabine或阿扎胞苷)或低剂量阿糖胞苷(LoDAC)方案的出现,正在迅速改变初治AML的治疗格局。Venetoclax联合HMAs治疗新诊断的不符合标准诱导治疗条件的老年AML患者,药物显著的协同作用达到了超过70%的应答率。此外,该疗法通常耐受性良好,并不局限于有特定突变的患者,通常可以在第一个疗程后调整为门诊治疗。
该联合疗法的特点为患者可以在1~2疗程内快速达到缓解,临床上通常在治疗1疗程后进行骨髓评估。在一些患者中,由于细胞计数恢复时间的延长,研究者会将Venetoclax的用药时间从28天缩短到21天,甚至14天。
移植治疗的选择及复发后的治疗策略
对于符合移植条件的患者,建议在治疗1~2疗程后实行移植,最佳Allo-HCT治疗时机为患者达到CR。但是对于复发难治的患者,很难达到MRD阴性,考虑到移植治疗的潜力,可以在适当的患者中(即使未达到CR)进行移植治疗。如果移植不是治疗中的预期的方案,可以选择Venetoclax联合HMAs进行治疗直至疾病进展。
如果该患者在移植后最终出现复发,应该如何进一步治疗,也是值得关注的问题。临床试验目前是移植后复发公认的治疗选择,除非患者存在可以进行靶向治疗的相关突变。对于CD33+的患者,Gemtuzumab是一种治疗的选择,但也有发生静脉闭塞疾病的风险。因此,研究者倾向于选择其他的治疗方法,如HMAs、细胞治疗(如DLI)、两者联合、或在患者再次达到CR后,对合适的患者进行新供体Allo-HCT的二次移植。
病例3 高龄IDH+ AML患者复发后的治疗策略
患者基本病情及治疗过程
女性,年龄86,骨髓活检结果显示,幼稚细胞占比64%,细胞遗传学检测提示,明显的5q缺失,无分子水平异常。确诊为AML并接受阿扎胞苷治疗,患者经治疗,2年内持续缓解,直至出现30%~40%的幼稚细胞比例,以及全血细胞减少症恶化。分子学评估发现了IDH1突变,随即使用500mg/d的Ivosidenib(已于近期FDA获批)进行诱导治疗。期间定期对患者进行骨髓的评估,而对于老年患者,则尽量减少侵入性检查。由于血细胞计数正常,外周血中没有可检测到的疾病,我们仅通过临床评估和全血细胞计数来监测患者的病情改变。几周后,患者外周血细胞指标开始好转,并在复发1年后持续使用Ivosidenib进行治疗,目前疾病稳定。
靶向治疗时代,AML复发患者的治疗选择
AML的克隆进化原理现已确立,在靶向治疗的时代,在患者复发时进行完整的分子学检测十分重要,一般IDH和FLT3突变状态是需要被重点关注的。Ivosidenib和Enasidenib分别是针对IDH1和IDH2突变的新型口服药物,并被列入2019年复发或难治性AML患者的NCCN指南中。Ivosidenib于2018年发表的第一阶段临床研究,成为其FDA的获批依据。该研究结果显示,复发或难治性AML患者的CR率达21.8%,中位缓解时间为9.3个月。IDH2突变的患者,接受Enasidenib治疗同样达到了令人鼓舞的结果。但是,Enasidenib和Ivosidenib的治疗均与IDH分化综合征的风险相关,类固醇通常是有效的应对方案。如果患者在使用类固醇治疗超过48小时后,症状持续恶化,或者需要住院治疗,一般研究者应停止靶向治疗,而采取保守治疗的策略。
靶向治疗的耐药性
虽然病例3对Ivosidenib治疗的反应良好,但不排除在后续的治疗过程中产生耐药的可能。已有详细的研究表明,在接受IDH抑制剂治疗的患者中发现了新的IDH突变,或者原有IDH突变中发生第二位点突变,这是一种新的抗性机制。另外,在一些患者中,出现耐药是由于在抗IDH治疗后,出现的非IDH突变。FLT3或其他关键信号通路(如RAS/MAPK)的突变已被确定为FLT3抑制剂的一种耐药机制。此外,并不是所有复发患者的克隆都有特定的突变,这也限制了靶向治疗的效果。将靶向治疗与其他药物(如HMAs)结合可能是克服某些疾病耐药性的有效方法。
总结
表2 复发性或难治性AML患者新的靶向治疗方法
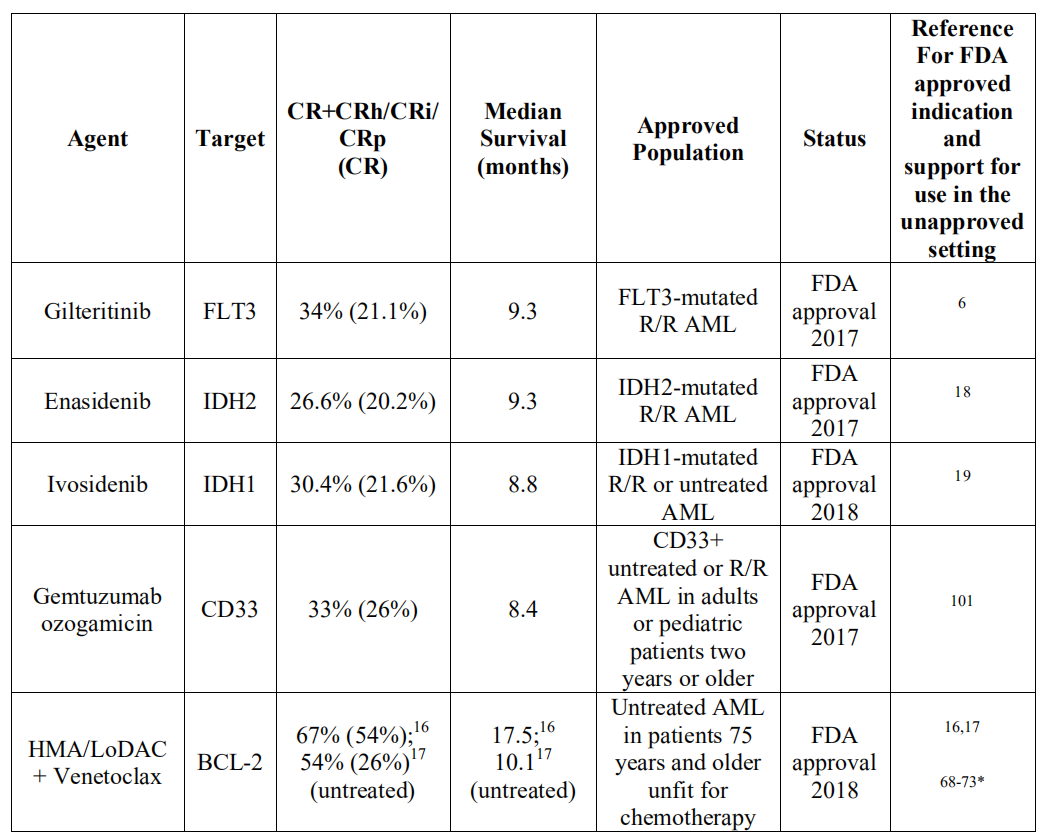 如表2所述,对于达到CR超过6个月后首次复发的年轻和/或fit患者,一般采用细胞毒性化疗的方法;然而,如果患者存在FLT3-ITD突变,倾向于使用Gilteritinib进行治疗。如果患者在达到CR后6个月内复发,治疗方法则取决于疾病的生物学特性:如果患者存在不良的细胞遗传学或分子生物学异常,可以选择使用靶向药物治疗,或者使用HMA/LoDAC 联合 Venetoclax进行治疗,来替代高强度化疗。如果患者年龄较大,耐受性差,为PIF或多次复发,可以也使用HMA/LoDAC + Venetoclax治疗,除非患者存在靶向性突变,可以选用适当的靶向药物进行治疗。
如表2所述,对于达到CR超过6个月后首次复发的年轻和/或fit患者,一般采用细胞毒性化疗的方法;然而,如果患者存在FLT3-ITD突变,倾向于使用Gilteritinib进行治疗。如果患者在达到CR后6个月内复发,治疗方法则取决于疾病的生物学特性:如果患者存在不良的细胞遗传学或分子生物学异常,可以选择使用靶向药物治疗,或者使用HMA/LoDAC 联合 Venetoclax进行治疗,来替代高强度化疗。如果患者年龄较大,耐受性差,为PIF或多次复发,可以也使用HMA/LoDAC + Venetoclax治疗,除非患者存在靶向性突变,可以选用适当的靶向药物进行治疗。
对于复发或难治性AML的有效治疗,是血液学家不断求索的目标。推荐使用有效的口服靶向药物,避免高强度化疗和减少长期住院率,预防复发,以提高患者的生活质量,是AML临床治疗的目标。随着分子遗传学进展、靶向药物的研发和各种联合方案的蓬勃发展,AML的治疗已经进入了新的医学时代。
参考文献
DeWolf Susan,Tallman Martin S,How I treat relapsed or refractory AML. Blood, 2020, 136: 1023-1032.