体内外乳腺癌模型的研究进展
体内外乳腺癌模型的研究进展
何 玲1, 2,徐 佳1,罗弘杉1,林丽美1,廖端芳1,李亚梅1
Research progress of breast cancer models in vitroand in vivo
He Ling1, 2, Xu Jia1, Luo Hongshan1, Lin Limei1, Liao Duanfang1, Li Yamei1
作者单位
湖南中医药大学 1. 药学院湘产大宗药材品质评价湖南省重点实验室;2. 医学院,湖南 长沙 410208
基金项目
1. 湖南省教育厅科研基金资助项目(编号:19C1398)
2. 湖南省自然科学基金资助项目(编号:2019JJ50443)
3. 湖南中医药大学研究生创新项目(编号:2019CX12)
AUTHORS FROM
1. Key Laboratory for Quality Evaluation of Bulk Herbs of Hunan Province; 2. Medical School, Hunan University of Chinese Medicine,Changsha 410208, Hunan Province, China
GRANT
1.Scientific Research Fund of Hunan Provincial Education Department(No. 19C1398)
2. Natural Science Foundation of Hunan Province(No. 2019JJ50443)
3.Hunan University of Chinese Medicine postgraduate innovation project(No. 2019CX12)
[摘要]
乳腺癌已成为在全球范围内女性中发病率最高的恶性肿瘤,且其发病率仍以每年3%~4%的速度不断增长,严重威胁了女性的生活质量和生命健康。在乳腺癌的基础研究中,建立理想的乳腺癌模型至关重要。本文在分析了乳腺癌病因与分类、生物标志物和治疗靶点的基础上,着重阐述了在乳腺癌研究中常用到的2类细胞模型(二维细胞培养和三维细胞培养)及5类动物模型(自发、诱导、移植、基因工程和远处转移),并结合具体实验流程,详细地分析了各类模型适用的研究领域,帮助研究者了解其最新的研究进展,以期更好地探究乳腺癌的病因、机制、治疗和预防。最后,本文系统地比对了各种细胞模型与动物模型的优势与不足。
[关键词]乳腺肿瘤 ;模型,生物学;模型,动物
[ABSTRACT]
Breast cancer has become the malignant tumor with the highest incidence of women in the world, and its incidence is still growing at a rate of 3% to 4% per year, which seriously threatens the quality of life and health of women. In the basic research of breast cancer, it is essential to establish an ideal breast cancer model. To this end, based on a brief description of the etiology and classification of breast cancer, biomarkers, and therapeutic targets, this article focuses on two types of cell models commonly(two-dimensional cell culture and three-dimensional cell culture), and five major animal models(spontaneous, induction, transplantation, genetic engineering and distant transfer), which were used in breast cancer research. In addition, the article combines with specific experimental research to analyze various models of the applicable research fields in detail, in order to help researchers understand the latest research progress situation better, and to explore the etiology, mechanism, treatment, and prevention of breast cancer; In the end, the advantages and disadvantages of various cell models and animal models are systematically compared.
[Key words]Breast neoplasms ; Models, biological; Models, animal
乳腺癌是一个全球性的疾病,是在女性中发病率最高的恶性癌症,也是所有恶性肿瘤中的第2大致命物[1]。2018年,女性乳腺癌死亡比例占癌症死亡总数的11.6%,仅次于肺癌(18.4%),仅2018年,全球就有210万新增病例[2]。据中国国家癌症中心(National Central Cancer Registry of China,NCCR)的统计数据显示,乳腺癌是<45岁妇女癌症死亡的主要原因,且近年来其发病率呈显著的上升趋势[3]。
随着乳腺癌发生率和死亡率的逐年攀升,使得其已位居威胁女性身心健康的恶性肿瘤之首。因此,全球有越来越多的科研工作者投入到了乳腺癌发病机制和新药研发的工作中。尽管有大量的人力、物力和财力的投入,但研发成功的抗乳腺癌药物仍屈指可数,究其原因是很多临床前疗效较好的药物在临床中的疗效并不理想。因此,建立健全和合理应用临床前抗乳腺癌药物的评价体系,促进临床前研究与临床药效研究的结合与统一,就显得尤为迫切和重要。此外,癌症模型在探讨癌症的发病病因、发病机制以及癌症治疗效果评估方面必不可少,近年来,随着乳腺癌相关研究的不断深入,对构建乳腺癌模型的研究也得到了进一步地发展,在一定程度上有助于探讨乳腺癌相关机制。本文将就乳腺癌模型的最新研究进展进行综述。
1
乳腺癌概述
1.1
乳腺癌的病因与分类
目前,关于乳腺癌的发病机制尚未完全阐明,但已明确的是,乳腺癌的发病与激素、神经功能、日常饮食及生殖等多种因素密切相关[4-5]。其中,月经周期、年龄和肿瘤家族史是诱发乳腺癌的重要危险因素[6]。近年来,由生活水平普遍提高所带来的营养过剩,即超重和肥胖问题愈加严重。更为严峻的是,超重与肥胖已被证实与乳腺癌发病风险增加有关,并且可能会影响相关癌症患者的预后[7]。
纵观乳腺癌诊断与治疗的发展历程,从以肿瘤分期为依据分类,到结合免疫组织化学表型与临床病理分类,再到今天以基因水平的分子病理与分子分型为依据分类,其科学理念日渐清晰[8]。目前,根据临床病理学分类,乳腺癌分为原位癌、早期浸润性癌、浸润性特殊癌和浸润性非特殊癌;根据分子分类标准,乳腺癌分为Luminal A型(LA)、Luminal B型(LB)、人表皮生长因子受体2(human epithelial growth factor receptor 2,HER-2)过表达型、基底样型/三阴性型及其他特殊类型乳腺癌[9],并且随着研究的深入已确切地将乳腺癌亚型细分出具体的乳腺癌细胞系。
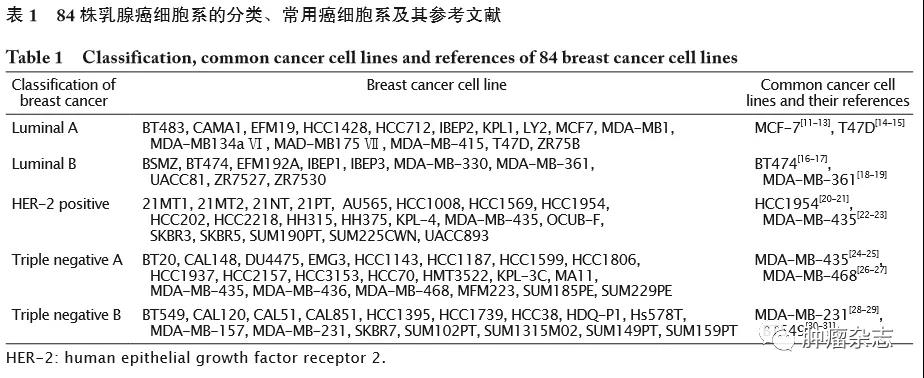
近年来,在构建乳腺癌模型方面对乳腺癌细胞系的应用较多。不过仅MCF-7、T47D和MDA-MB-231等细胞在乳腺癌细胞系的研究中被频繁使用[10],其他癌细胞在乳腺癌的研究中应用较少,这使得研究者们对乳腺癌细胞系的认识仍十分局限,只对几种细胞系的了解较深入。对此,本文总结归纳了84株乳腺癌细胞系的分类[10]和广泛用于乳腺癌研究的细胞系(表1),以供研究者根据实验研究的需要,选择相应的乳腺癌细胞株构建模型。
1.2
乳腺癌的生物标志物
肿瘤标志物是指特异性存在于恶性肿瘤细胞,在恶性肿瘤的发生和发展过程中,肿瘤细胞的相关基因逐步得到表达后,机体产生的一类物质。从20世纪60年代开始,肿瘤标志物便开始广泛应用于临床,其对原发肿瘤的发现、良恶性肿瘤的鉴别诊断、肿瘤治疗效果的评估等方面均具有重要意义[32]。
目前,乳腺癌生物标志物主要分为2大类,即传统乳腺癌生物标志物和新型乳腺癌生物标志物。传统乳腺癌生物标志物是临床诊疗乳腺癌的重要参照,主要包含雌激素受体(estrogen receptor,ER)、孕激素受体(progestogen receptor,PR)、HER-2、癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(&α;-fetoprotein,AFP)、糖类抗原15-3(carbohydrate antigen,CA15-3)和细胞角蛋白片段(cytokeratin fragments-21,CYFRA-21)等。在临床诊疗过程中,通常采用多项联合检测以期获得更精确的诊断结果。然而传统方法的灵敏度和特异度仍不能达到令人满意的效果。因此,探寻新的乳腺癌生物标志物的研究从未停下。研究者在检测机体细胞、积液、血液、尿液、泪液和乳汁的过程中,逐步发现了一些更有价值的新型乳腺癌生物标志物,如微小RNA(microRNA,miRNA)、循环肿瘤细胞(circulating tumor cells,CTCs)、循环游离DNA(circulating free DNA,ctDNA)、尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator ,uPA)和外泌体(exosomes)等[33]。
由于乳腺癌具有生物特征多样性的特征,其病因学、发病学均相当复杂。已发现的乳腺癌生物标志物在用于临床检测诊断时,其特异性和精确度仍不高。且迄今为止,还没任何单一的生物标志物足以精确诊断乳腺癌[34]。因此,当前乳腺癌特异性生物标志物仍有待进一步探索,以解决乳腺癌早期诊断、疗效评估和预后判断的临床问题。
1.3
乳腺癌治疗的靶点
随着新理论和新技术的不断发展,乳腺癌的治疗方式有了越来越多的选择。目前,外科治疗、化学药物治疗、内分泌治疗和放射治疗是疗效较好的几种治疗措施。此外,随着分子生物学等的深入研究,分子靶点及靶向药物治疗在现阶段抗肿瘤研究中受到越来越多的重视[35]。在研究中,已发现ER、PR、HER-2、p53、长链非编码RNA(long non-coding RNA,LncRNA)、热休克蛋白90(heat shock protein 90,HSP90)、血小板衍生生长因子、氧化酶-2、雄激素受体和蛋白激酶1&δ;(casein kinase 1&δ;,CK1&δ;)均是有效的治疗靶点。另外,尚有一些新的治疗靶点,如p53基因,目前正处于研究开发阶段。其中,在乳腺癌动物模型和临床前模型的实验中,以p53为治疗靶点的PRIMA1(p53 reactivation and induction of massive apoptosis 1)和APR246(a methylated derivative and structural analogue of PRIMA 1)等化合物,可通过将突变型p53基因转化为具有抑癌作用的野生型p53基因等方式,来抑制乳腺癌细胞的增殖,且研究中均未发现严重的不良反应。由此可见,p53有可能作为一个治疗靶点应用于乳腺癌的临床诊疗中[36]。
总体而言,现阶段对于乳腺癌的认知水平已达到一定高度,但乳腺癌的病因、发病机制和转归十分复杂,仍需要通过更多的基础研究和临床研究去探索。此外,乳腺癌模型作为乳腺癌研究进程中的一种有效辅助工具,也同样具有必要的研究价值。
2
乳腺癌的建模类型
2.1
乳腺癌细胞的二维培养模型和三维培养模型
当前,二维培养模型和三维培养模型是乳腺癌细胞在体外培养中常用的2种方法。
2.1.1
●
乳腺癌细胞的二维培养模型
二维平面培养方法在体外细胞实验中的应用较广,尤其是在细胞检测方面。在该培养体系中,单层细胞在平坦的平板或刚性基质表面黏附和生长[37],这种单层结构使大多数细胞在生长过程中都能从培养液中得到近似的营养成分。但此时若细胞形态发生异常,则可影响细胞的增殖、分化、凋亡、基因和蛋白质的表达等多种过程。
二维细胞培养有一定的局限性:(1)与体内肿瘤细胞生长的环境存在一定差异;(2)在该培养体系中增殖的细胞,其形态和结构等方面都与体内细胞存在着差异[38]。然而,该技术也有其优点,其操作简单,可轻松解剖特定细胞类型的特征,便于与世界各地的其他研究人员进行比较和探讨[39];同时,该培养模型在药物发现中也发挥着举足轻重的作用——筛选化合物的标准程序即从基于二维细胞培养的实验开始。总体而言,二维细胞培养技术仍是一种有价值的细胞基础研究方法。
2.1.2
●
乳腺癌细胞的三维培养模型
鉴于二维培养模型的局限性,研究人员在实验过程中,逐渐探索出更佳的细胞培养方法,即细胞的三维培养方法。一般而言,三维细胞培养是将细胞放在细胞外基质蛋白或其类似物的生长支架上进行培养,使细胞得以很好地生长,从而产生三维立体特异性肿瘤组织结构[40]。采用该方法模拟构建的细胞生长环境,在肿瘤细胞形态和表型特征方面可与体内乳腺癌细胞高度相似。
目前,体外构建三维细胞模型的方法主要有多孔支架培养法、旋转培养法、磁悬浮培养法、纳米印迹培养板培养法和实体瘤芯片等。其中,类器官技术是近年来发展最为迅速的一类三维细胞培养技术。类器官是从干细胞或器官祖细胞发展而来且具有器官特异性的细胞类型集合,其具备原发肿瘤的组织学和遗传学特征[41]。与传统肿瘤模型不同的是,肿瘤类器官模型不需要大量的样本量,可从小样本中培养,甚至可采用以针吸活检方法取下的标本。其中,SACHS等[42]在官方允许和乳腺癌患者知情同意的情况下,利用155个肿瘤,建立了乳腺癌类器官活体生物库。通过组织学、全基因组DNA测序(Whole Genome Sequencing,WGS)和核糖核酸测序的方法深入分析。研究结果显示,正常类器官与5个乳腺癌类器官在组织学特征与基因上相一致,其余类器官结果互相一致,并且具有明显的异质性。另外,SACHS等[42]还利用其中的12个乳腺癌类器官模型,同时对12个乳腺癌类器官模型和相应的乳腺癌患者使用他莫昔芬药物。停药后观察发现,乳腺癌类器官对他莫昔芬的体外反应与相应患者的反应一致,这在很大程度上表明,乳腺癌类器官具有乳腺癌体外药物筛选的潜在用途。综上,类器官有可能弥补乳腺癌细胞系和异种移植物(patient-derived xenografts,PDX)模型的不足之处,即允许高通量药物敏感性筛选和捕捉疾病异质性。
已有多项研究表明,经三维培养后的肿瘤细胞耐药性显著增强。徐红等[43]将MCF-7细胞接种于胶原支架材料——Ⅰ型鼠尾胶原溶液与磷酸缓冲盐溶液(phosphate buffer saline,PBS),随后将细胞/胶原混悬液置于37 ℃培养箱,待胶原成胶后补加细胞培养液,并继续置培养箱内培养,借此将乳腺癌MCF-7细胞与胶原支架材料复合,成功构建具有耐药表型及功能的乳腺癌三维培养模型。王杰等[44]将MDA-MB-231细胞在二维和三维2种不同培养条件下进行培养,使用临床常用的一线化疗药物多西他赛(docetaxel,DTX)、表柔比星(epirubicin,EPI)、长春瑞滨(vinorelbine,NVB)、5-氟尿嘧啶(5-fluorouracil,5-Fu)、环磷酰胺(cyclophosphamide,CTX)、吉西他滨(gemcitabine,CEM)、顺铂(cisplatin,DDP)、紫杉醇(paclitaxel,Tax)和依托泊苷(etoposide,VP-16)在多种浓度条件下分别做药物敏感性实验。其结果显示,MDA-MB-231细胞在三维培养条件下,对化疗药物有更强的耐药性,其中三维条件下DTX、EPI、NVB、5-Fu、CTX、CEM、DDP、Tax和VP-16的20%抑制浓度值(20% inhibitory concentration,IC20)分别是二维条件下的11.7、2.3、46.5、12.7、769.2、8.1、1.7、11.7和0.7倍。由此可见,三维培养条件下的乳腺癌细胞表现出更强的耐药性。
此外,相较于二维培养方法,三维培养系统能更好地模拟体内环境,培养出的细胞形态和功能更加贴近动物体内活细胞的真实生长状况,并可评估细胞外基质的影响[39]。也正因此,三维细胞培养在肿瘤耐药性研究[45]、肿瘤新生血管形成研究[46]、肿瘤细胞与基质细胞共培养研究[47]等方面得到广泛应用。在一定程度上,三维培养系统可将传统的二维单层细胞培养与动物模型连接起来,可为细胞提供更类似于体内的生长环境,还可避免体内因素的影响[38],其在药物筛选、肿瘤细胞生物学、干细胞研究和许多其他基于细胞的分析和装置中有着巨大的应用前景。
2.2
乳腺癌的实验动物模型
乳腺癌动物模型是研究乳腺癌在体内发生和发展的机制,以及检测药物防治肿瘤发生和发展有效性的重要工具。从1913年BAGG首次开始培育Balb系小鼠,到1932年第26代Balb系小鼠正式被命名为Balb/c品系,期间历经了29年[48]。如今动物模型已经得到了广泛应用,其中常用到的动物模型包括自发、诱导、移植、基因工程和远处转移这5类。
在最新的研究中,丁秀娟等[49]利用SD大鼠与MAT BⅢ细胞成功构建移植型乳腺癌动物模型,并使用多柔比星和姜黄素进行药物治疗。在治疗后的第1天,收集动物的心脏样本。通过高分辨率的呼吸运动测量法,测量左心室活检组织的电传递链活动,发现姜黄素降低了多柔比星对大鼠乳腺癌模型中的心脏毒性损害。曲义坤等[50]的研究发现,用SD老年大鼠和化学致癌剂二甲基苯蒽(dimethyl ben-zanthracene,DMBA)建立诱发性乳腺癌动物模型,待建模完成后及时取乳腺病灶组织,采用蛋白质印迹法测定标本中磷脂酰肌醇-3激酶(phosphoinositide-3 kinase,PI3K)/蛋白激酶B(protein kinaseB,PKB,又称AKT)信号通路。用统计学软件SPSS18.0行χ2及t检验后发现,乳腺癌大鼠PI3K/AKT信号表达水平显著高于正常大鼠,这表明PI3K/AKT信号通路与乳腺癌血管形成有很大联系。由此可见,乳腺癌动物模型在乳腺癌的临床前研究中的确发挥了重要作用。
也有研究显示[51-52],每种类型的动物模型均有其优缺点,如成瘤率高低和所形成的肿瘤与人体肿瘤生物特征相似度等。并且各种类型的动物模型在构建的过程中,需要研究者所投入的资金,培育动物所需要的饲料、水、时间和动物生活环境等均有差别。
3
总结及展望
检测乳腺癌生物标志物,可用于验证乳腺癌模型是否构建成功。成功构建的乳腺癌模型可有助于进一步明确乳腺癌病因、探索乳腺癌的发病机制与治疗靶点。乳腺癌模型在研究人类乳腺癌的预防、发生、诊断及治疗等方面有着至关重要的作用。
本文在介绍了乳腺癌病因与分类、生物标志物、治疗靶点的理论基础上,综述了2大类实验模型——乳腺癌细胞模型(即体外模型)和乳腺癌实验动物模型(即体内模型),其各有优缺点。乳腺癌细胞模型可在体外有针对性地对乳腺癌细胞进行研究,干扰因素少、便于同步化,是分析单个细胞形态、代谢或功能改变的理想模型。然而,细胞株在长期传代过程中,存在变异的隐患,且乳腺癌细胞模型并不能完全模拟体内微环境。因此用细胞株在体外进行研究时,所获得的结果必须在整体水平进行检验。乳腺癌实验动物模型避免了细胞模型的缺点,可深入研究乳腺癌细胞在动物体内的生长、增殖和转移等过程,并能从整体水平较全面地反映出临床疾病的特征,与人体肿瘤的相似度高,是最能体现人类疾病特征的实验模型。但在构建乳腺癌实验动物模型时存在的干扰因素复杂,实验条件难以控制,且个体之间的实验数据可能差异较大。
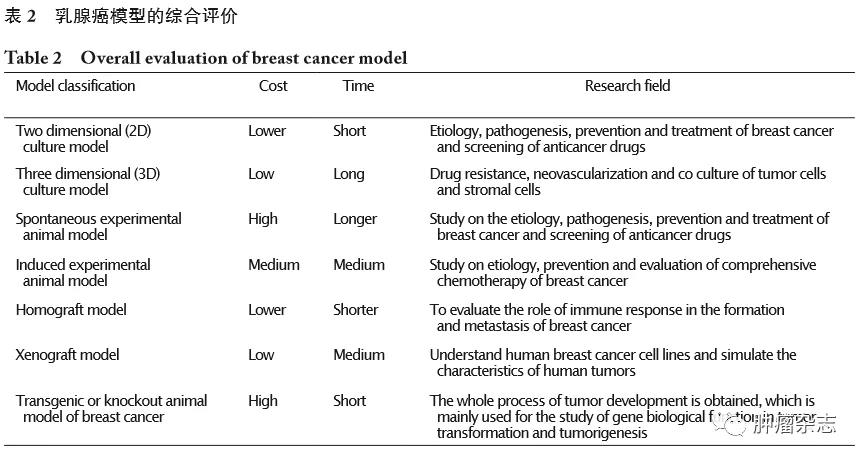
本研究总结了在一些实验需求下适用的实验模型情况(表2)。当使用乳腺癌细胞模型进行孤立性的体外药物筛选时应选择乳腺癌二维培养模型,其可在低成本的情况下达到预期结果。在此基础上,如果需要做进一步探讨癌细胞与细胞外基质的相互联系、研究肿瘤耐药性和肿瘤新生血管等领域问题,则可以选择乳腺癌三维培养模型。对于乳腺癌实验动物模型的应用,若研究人员想最大程度的模拟人体内环境,培育与人体乳腺癌相近的肿瘤,同时愿意投入较多的时间和资金,可以考虑选择自发性实验动物乳腺癌模型;若研究人员想在较短时间内研究基因在肿瘤发生和发展过程中发挥的作用,基因工程型乳腺癌动物模型将是最佳的乳腺癌模型;若研究人员想在低成本且短时间的条件下研究乳腺癌发生和发展进程,则可以考虑PDX模型;如果想进一步探讨乳腺癌转移过程中免疫应答的作用,选择同种移植物模型的效果更佳。
综上所述,目前所构建的各种乳腺癌模型尚未具备理想模型的全部条件,都存在一定的局限性。因此,研究者须掌握各种模型的建模要点,综合考虑实验设计和研究目的,进而选择适当的模型,制作出与人类疾病尽可能相似的实验模型。这样,乳腺癌模型才能显现其科学价值,有助于明确乳腺癌病因、探讨乳腺癌发病机制与治疗靶点,从而更有利于人类乳腺癌的预防和诊治的临床实践。
参考文献
[1]ANASTASIADI Z, LIANOS GD, IGNATIADOU E, et al. Breast cancer in young women: An overview[J]. Updates Surg, 2017, 69(3):313-317.
[2]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424.
[3]CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[4]ESPINAL AC, BUAS MF, WANG D, et al. FOXA1 hypermethylation: link between parity and ER-negative breast cancer in African American women?[J]. Breast Cancer Res Treat, 2017, 166(2):559-568.
[5]师 金, 梁 迪, 李道娟, 等. 全球女性乳腺癌流行情况研究[J]. 中国肿瘤, 2017, 26(9):683-690.
[6]苏 晓. 乳腺癌的靶向药物治疗[J]. 医学信息, 2019, 32(12):46-49.
[7]曹达龙, 叶定伟. 超重和肥胖与癌症发生预后关系的研究进展[J]. 肿瘤, 2017, 37(12):1344-1348.
[8]邬 攀, 刘汉忠. 组织学病理学和分子分类对乳腺癌的病理诊断价值[J]. 中国农村卫生, 2019, 11(10):51.
[9]振东, 孙晓晓, 谢龙祥, 等. 乳腺癌分子分型研究进展[J]. 河南大学学报(医学版), 2018, 37(4):229-233.
[10]DAI X, CHENG H, BAI Z, et al. Breast cancer cell line classification and its relevance with breast tumor subtyping[J]. J Cancer, 2017, 8(16):3131-3141.
[11]XING X, MA JH, FU Y, et al. Essential oil extracted from erythrina corallodendron L. leaves inhibits the proliferation, migration, and invasion of breast cancer cells[J]. Medicine(Baltimore), 2019, 98(36):e17009.
[12]DAVIDOV B, SHMULEVICH R, SHABTAY A, et al. The hormone KL1: A regulator of breast cancer cell metabolism[J]. Isr Med Assoc J, 2019, 21(7):504.
[13]HAN X. targeting taurine transporter(TauT) for cancer immunotherapy of p53 mutation mediated cancers - molecular basis and preclinical implication[J]. Adv Exp Med Biol, 2019, 1155:543-553.
[14]YU S, KIM T, YOO KH, et al. The T47D cell line is an ideal experimental model to elucidate the progesterone-specific effects of a luminal A subtype of breast cancer[J]. Biochem Biophys Res Commun, 2017, 486(3):752-758.
[15]JAVAN MAASOMI Z, PILEHVAR SOLTANAHMADI Y, DADASHPOUR M, et al. Synergistic anticancer effects of silibinin and chrysin in T47D breast cancer cells[J]. Asian Pac J Cancer Prev, 2017, 18(5):1283-1287.
[16]IDOWU T, SAMADDER P, ARTHUR G, et al. Amphiphilic modulation of glycosylated antitumor ether lipids results in a potent triamino 支架蛋白 against epithelial cancer cell lines and BT474 cancer stem cells[J]. J Med Chem, 2017, 60(23):9724-9738.
[17]FAZEKAS J, GRUNT TW, JENSEN-JAROLIM E, et al. Long term storage in liquid nitrogen leads to only minor phenotypic and gene expression changes in the mammary carcinoma model cell line BT474[J]. Oncotarget, 2017, 8(21):35076-35087.
[18]齐 琦, 张 配, 李其响, 等. 冬凌草甲素诱导三阴乳腺癌MDA-MB-231细胞凋亡及对细胞内活性氧水平的影响[J]. 中国中药杂志, 2017, 42(12):2361-2365.
[19]YU Z, SONG YB, CUI Y, et al. Effects of AIF-1 inflammatory factors on the regulation of proliferation of breast cancer cells[J]. J Biol Regul Homeost Agents, 2019, 33(4):1085-1095.
[20]SUN Z, ZHANG C, WANG T, et al. Correlation between long non-coding RNAs(lncRNAs) H19 expression and trastuzumab resistance in breast cancer[J]. J Cancer Res Ther, 2019, 15(4):933-940.
[21]KOSCHORKE A, FARACI S, GIANI D, et al. Phenethyl isothiocyanate hampers growth and progression of HER2-positive breast and ovarian carcinoma by targeting their stem cell compartment[J]. Cell Oncol(Dordr), 2019, 42(6):815-828
[22]KABAN K, SALVA E, AKBUGA J. Modulation of the dual-faced effects of miR-141 with chitosan/miR-141 nanoplexes in breast cancer cells[J]. J Gene Med, 2019, 21(9):e3116.
[23]KHAN I, GRIL B, STEEG PS. Metastasis suppressors NME1 and NME2 promote dynamin 2 oligomerization and regulate tumor cell endocytosis, motility, and metastasis[J]. Cancer Res, 2019, 79(18):4689-4702.
[24]ZHAO H, JIANG H, LI Z, et al. 2-Methoxyestradiol enhances radiosensitivity in radioresistant melanoma MDA-MB-435R cells by regulating glycolysis via HIF-1&α;/PDK1 axis[J]. Int J Oncol, 2017, 50(5):1531-1540.
[25]何丽娟, 李晋生, 陈 霞, 等. 西黄丸含药血清对人乳腺癌细胞株MDA-MB-435和MCF-7细胞增殖的影响[J]. 中国中药杂志, 2018, 43(13):2784-2788.
[26]AZIMI I, PETERSEN RM, THOMPSON EW, et al. Hypoxia-induced reactive oxygen species mediate N-cadherin and SERPINE1 expression, EGFR signalling and motility in MDA-MB-468 breast cancer cells[J]. Sci Rep, 2017, 7(1):15140.
[27]NAKAI K, XIA W, LIAO HW, et al. The role of PRMT1 in EGFR methylation and signaling in MDA-MB-468 triple-negative breast cancer cells[J]. Breast Cancer, 2018, 25(1):74-80.
[28]TSENG TH, CHIEN MH, LIN WL, et al. Inhibition of MDA-MB-231 breast cancer cell proliferation and tumor growth by apigenin through induction of G2/M arrest and histone H3 acetylation-mediated p21WAF1/CIP1 expression[J]. Environ Toxicol, 2017, 32(2):434-444.
[29]MALI AV, JOSHI AA, HEGDE MV, et al. Enterolactone modulates the ERK/NF-κB/Snail signaling pathway in triple-negative breast cancer cell line MDA-MB-231 to revert the TGF-&β;-induced epithelial-mesenchymal transition[J]. Cancer Biol Med, 2018, 15(2):137-156.
[30]CHITTASUPHO C, KEWSUWAN P, MURAKAMI T. CXCR4-targeted nanoparticles reduce cell viability, induce apoptosis and inhibit SDF-1&α; induced BT-549-Luc cell migration in vitro[J]. Curr Drug Deliv, 2017, 14(8):1060-1070.
[31]郎 磊, 周明莉, 杨佳佳, 等. 稳定干扰ITGB1抑制人乳腺癌BT549细胞迁移和侵袭[J]. 基因组学与应用生物学, 2017, 36(5):1737-1742.
[32]李 策, 聂彩辉, 张力君, 等. 肿瘤标志物的应用及其筛选技术研究进展[J]. 药学进展, 2014, 38(1):1-13.
[33]张 青, 甘 淋. 乳腺癌生物标志物的研究进展[J]. 生命的化学, 2018, 38(1):85-90.
[34]KEREN L, BOSSE M, MARQUEZ D, et al. A structured tumor-immune microenvironment in triple negative breast cancer revealed by multiplexed ion beam imaging[J]. Cell, 2018, 174(6):1373-1387.e19.
[35]段羊羊, 井明晰, 徐君南, 等. 乳腺癌分子靶向治疗现状[J]. 中国肿瘤, 2016, 25(3):202-206.
[36]张伯阳, 段秀庆. p53作为乳腺癌潜在生物标志物和治疗靶点的研究进展[J]. 医学综述, 2019, 25(12):2366-2371.
[37]EDMONDSON R, BROGLIE JJ, ADCOCK AF, et al. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors[J]. Assay Drug Dev Technol, 2014, 12(4):207-218.
[38]许保海, 崔 熠, 张瑶楠, 等. 乳腺癌肿瘤干细胞体外培养体系的建立[J]. 生殖医学杂志, 2018, 27(5):465-470.
[39]CARTER EP, GOPSILL JA, GOMM JJ, et al. A 3D in vitro model of the human breast duct: a method to unravel myoepithelial-luminal interactions in the progression of breast cancer[J]. Breast Cancer Res, 2017, 19(1):50.
[40]彭雪梅, 刘永文, 张海燕. 人乳腺癌细胞MDA-MB-231三维培养模型的构建[J]. 山西大同大学学报(自然科学版), 2018, 34(4):34-38.
[41]高坚钧, 秦 伟, 王 浩, 等. 类器官技术在肿瘤研究中的应用与展望[J]. 中国组织工程研究, 2019, 23(7):1136-1141.
[42]SACHS N, DE LIGT J, KOPPER O, et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity[J]. Cell, 2018, 172(1-2):373-386.e10.
[43]徐 红, 刘 伟, 张秀珍, 等. 乳腺癌细胞三维培养耐药模型的体外构建[J]. 生理学报, 2016, 68(2):179-184.
[44]王 杰, 李婷婷, 李瑞红, 等. 构建三阴性乳腺癌的三维体外培养模型用于抗肿瘤药物的活性评价[J].安徽医科大学学报, 2019, 54(3):374-380.
[45]LOVITT CJ, SHELPER TB, AVERY VM. Doxorubicin resistance in breast cancer cells is mediated by extracellular matrix proteins[J]. BMC Cancer, 2018, 18(1):41.
[46]HOOPER RC, JACOBY A, ASANBE O, et al. A novel three-dimensional platform to investigate neoangiogenesis, transendothelial migration, and metastasis of MDAMB-231 breast cancer cells[J]. Plast Reconstr Surg, 2016, 138(3):472e-482e.
[47]RANFTL RE, CALVO F. Analysis of breast cancer cell invasion using an organotypic culture system[J]. Methods Mol Biol, 2017, 1612:199-212.
[48]POTTER M. History of the BALB/c family[J]. Curr Top Microbiol Immunol, 1985, 122:1-5.
[49]丁秀娟, 刘百奇, 韩忠书, 等. 姜黄素对降低阿霉素在大鼠乳腺癌模型中的心脏毒性的机制探讨[J]. 继续医学教育, 2019, 33(1):119-120.
[50]曲义坤, 国麟祺, 夏伟滨, 等. PI3K/Akt信号通路在老年大鼠乳腺癌血管形成中的作用及对整合素连接激酶ILK的抑制效果[J]. 中国老年学杂志, 2019, 39(2):388-391.
[51]李日飞, 袁 娜, 冶冬阳, 等. 乳腺癌实验动物模型的研究进展[J]. 中国比较医学杂志, 2018, 28(2):113-118.
[52]孙彩霞, 高广春, 李明娟, 等. 乳腺癌小鼠模型的研究进展[J]. 医药前沿, 2018, 8(24):10-11.