从SWOG S1403研究看EGFR信号通路的双重抑制是否更优?
EGFR酪氨酸激酶抑制剂(TKI)单药是目前EGFR突变型晚期NSCLC的标准一线治疗。阿法替尼是二代泛ErbB家族TKI,不可逆抑制EGFR胞内区的酪氨酸激酶;西妥昔单抗是EGFR的IgG1单克隆抗体,通过与EGFR胞外区特异性结合发挥作用。两者联合可双重抑制EGFR信号通路,但对EGFR突变型晚期NSCLC患者能否延缓耐药、获益更佳,近期一项阿法替尼联合西妥昔单抗对比阿法替尼单药用于初治EGFR突变型NSCLC的随机对照研究(SWOG S1403)的最终结果发表在《临床肿瘤学》JCO上。

研究背景
EGFR突变在西方人群中发生率约为15%,对于该群体,EGFR TKI较化疗可显著改善临床结局和生活质量。但EGFR TKI并非治愈性的,一二代TKI的中位PFS约为10-12个月,三代TKI的中位PFS约为19个月。
为克服一代EGFR TKI的获得性耐药,人们尝试了多种治疗策略。其中最常见的是三代TKI奥希替尼对于继发性EGFR T790M突变患者有着显著的疗效,但对于T790M阴性TK耐药患者无效。第二代不可逆抑制泛ErbB家族中的阿法替尼是二代TKI,其单独使用时仍无法克服耐药性;但在一项Ⅰb期试验中发现,对于EGFR突变型且获得性耐药的NSCLC患者,阿法替尼联合EGFR单克隆抗体西妥昔单抗可产生29%的响应率,且在T790M阳性或阴性患者中疗效相当。这一结果在其他EGFR TKI与EGFR抗体的组合并未显示,提示阿法替尼联合西妥昔单抗具有独特的克服一代TKIs耐药的能力,且无论有无T790M突变。
在EGFR突变型肺癌的小鼠模型中,初始给予阿法替尼联合西妥昔单抗较任一单药可延缓耐药发生。因此,我们提出假设,用于EGFR突变型NSCLC的一线治疗中,阿法替尼联合西妥昔单抗可能优于阿法替尼单药。
方法
这项研究纳入了携带常见EGFR敏感突变(19外显子缺失和L858R点突变)的Ⅳ期NSCLC患者,非常见突变未予纳入。其他纳入标准包括:未接受针对晚期或转移性疾病的系统治疗或任何EGFR TKI治疗;PS为0-2分。鉴于阿法替尼和西妥昔单抗具有一定的穿透血脑屏障能力,允许纳入未经治疗的无症状脑转移、无需皮质类固醇干预、无软脑膜转移的患者。可测病灶未非强制性的。
受试者1:1随机分配接受每日口服40 mg阿法替尼联合每2周接受西妥昔单抗500 mg/m²的静脉注射或接受阿法替尼单药治疗。直至疾病进展、症状恶化、不可耐受不良反应、妊娠、治疗延期>28天或病人决定退出。如果研究者判断患者持续临床获益,可在影像学RECIST进展后继续治疗。研究中允许局部姑息性治疗(如放疗或手术)。
主要研究终点为PFS。次要终点包括ORR、TTD、OS和毒副反应评估(NCI CTCAE第4版)。分层因素为PS状态(0-1与2)和EGFR突变类型(19外显子缺失与L858R点突变)。对所有随机患者进行疾病进展部位(脑或全身)的事后分析。
结果
共纳入174例未经治疗的EGFR突变型NSCLC患者,联合组(n=89)和单药组(n=85)。其中168例符合条件,联合组(n=83)和单药组(n=85)(图1)。
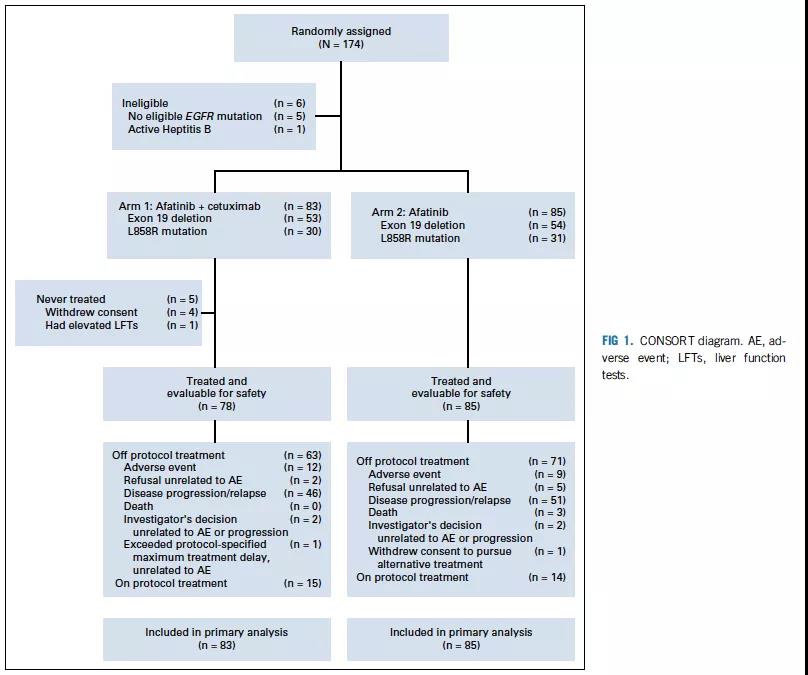
图1 患者数据
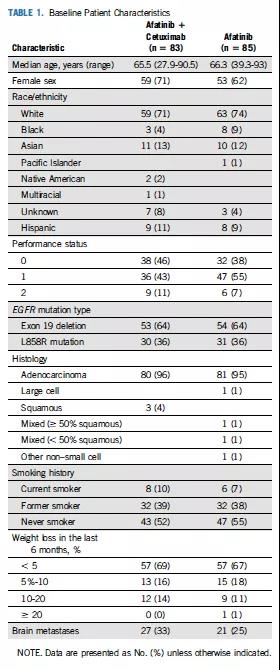
两组患者基线特征基本相似。中位年龄分别为65.5岁和66.3岁;PS =2的患者分别占11%和7%;腺癌分别占96%和95%;EGFR 19外显子缺失突变和L858R点突变在两组均为64%和36%;脑转移患者比例分别为33%和25%(表1)。
表1 患者基线特征
 截至2019年10月18日,29例患者仍在治疗,联合组(n=15)与单药组(n=14),停药原因如图1所示。共观察到138例PFS事件,联合组(n=70)和单药组(n=68),其中联合组(n=15)和单药组(n=19)患者在病情进展后继续治疗。
截至2019年10月18日,29例患者仍在治疗,联合组(n=15)与单药组(n=14),停药原因如图1所示。共观察到138例PFS事件,联合组(n=70)和单药组(n=68),其中联合组(n=15)和单药组(n=19)患者在病情进展后继续治疗。
主要研究终点PFS在两组间无显著差异(HR =1.01; 95% CI, 0.72-1.43; P = 0.94; 中位PFS: 11.9个月 vs 13.4个月; 图2A);亚组分析表明,无论临床或肿瘤特征如何,两组PFS均无差异(图2B)。
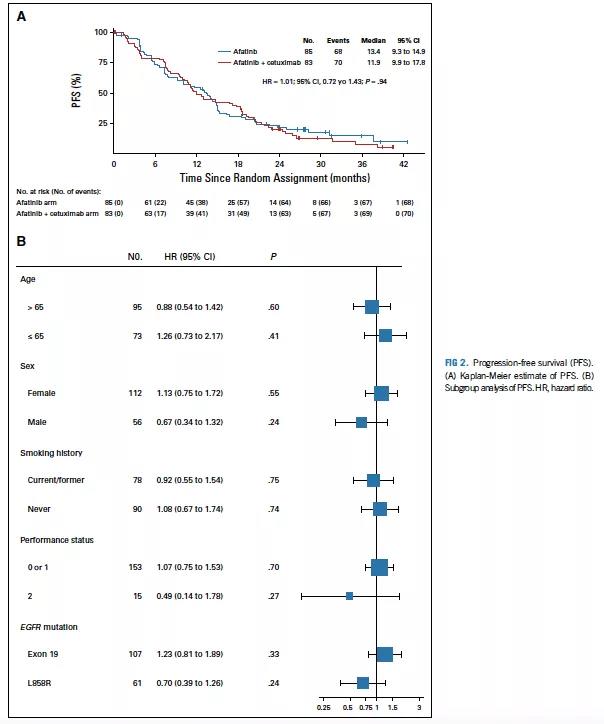
图2 PFS分析图
次要研究终点TTD在两组间也无显著差异(HR = 0.90; 95% CI, 0.64-1.26; P = 0.54),联合组TTD为12.7个月(95% CI, 10.8-17.6),单药组为12.2个月(95% CI, 9.3-15.1);进展后治疗时间两组分别为5.0个月(95% CI, 2.1-7.2)和3.3个月(95% CI, 1.9-4.2)。
联合组和单药组1年脑部进展发生率分别为8%(95% CI, 3%-5%)和14%(95% CI, 8%-23%);1年全身进展率分别为46%(95% CI, 35%-57%)和34%(95% CI, 24%-44%)(图A1)。
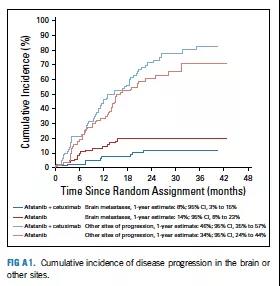
图A1 大脑或其他部位疾病进展的累积发病率
共153例患者有基线可测病灶可评估疗效,证实或未经证实的肿瘤缓解在联合组和单药组分别为67%和74%(P = 0.38)。两组至缓解时间相似,分别为联合组2.0个月(95% CI, 1.94- 3.81)和单药组1.94个月(95% CI, 1.87-2.04)。联合组和单药组缓解持续时间分别为9.4个月(95% CI, 6.6-16.6) 和11.3个月(95% CI, 5.7-13.0)。全体人群和各亚组分析显示,两组OS均无显著差异(HR, 0.82; 95% CI, 0.50-1.36; P=0.44; 2年OS率, 67% vs 70%; 图3)。
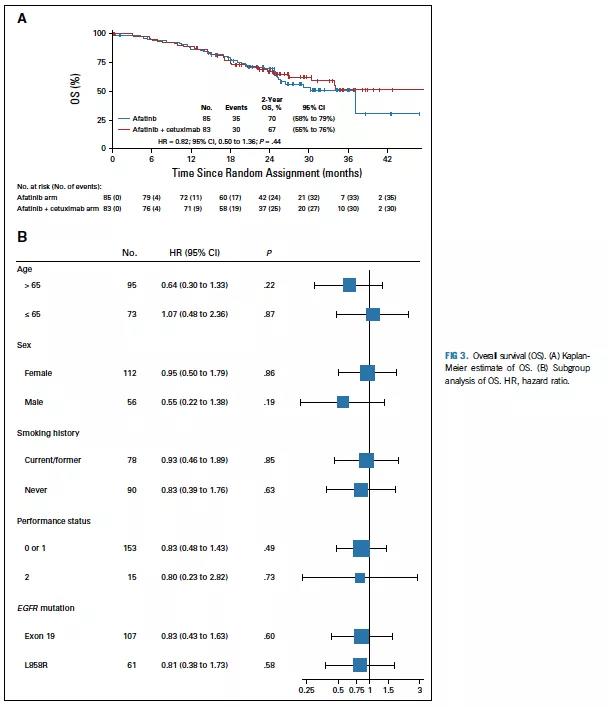
图3 OS分析与森林图
19外显子缺失突变患者较L858R点突变患者具有更长的PFS和OS(图A2),两组间PFS和OS无论突变类型如何均无显著差异(图A3,A4)。
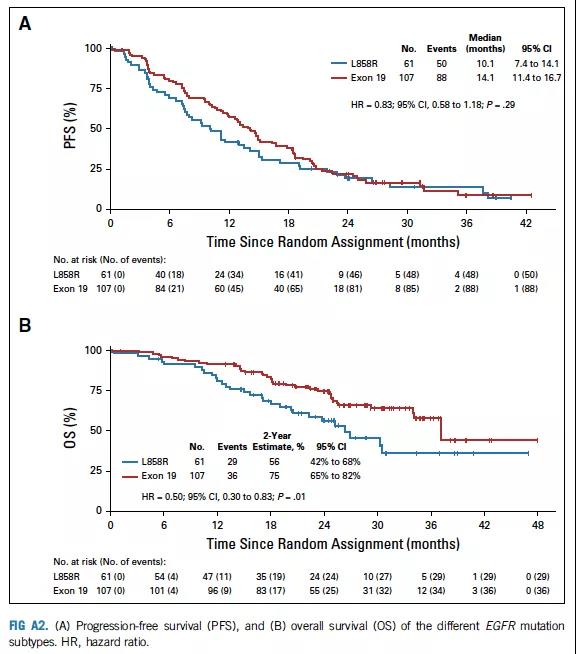
图A2 PFS分析与不同EGFR突变亚型的OS分析
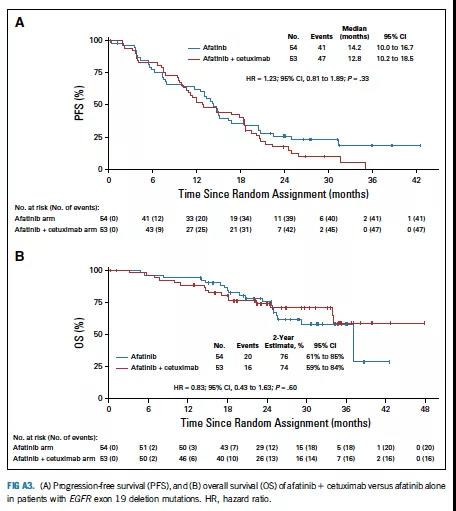
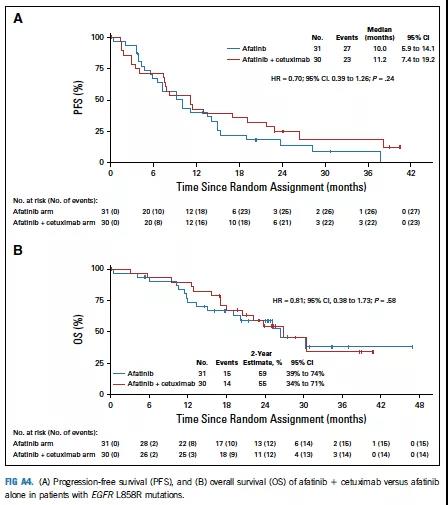
图A3 PFS与在19外显子缺失突变患者中的OS分析
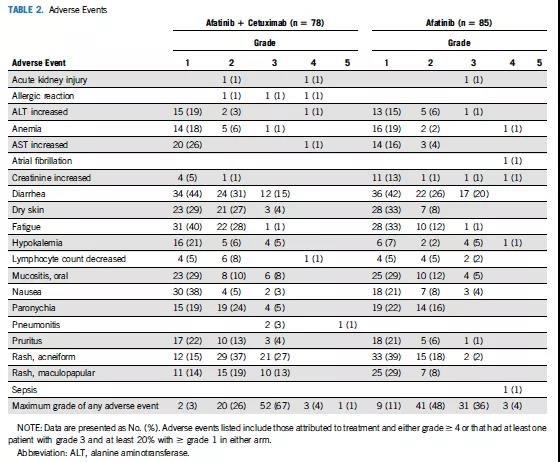
联合组较单药组≥3级不良事件(AE)发生率更高(72% vs 40%; P< 0.0001)。常见≥3级治疗相关性AE两组分别为:痤疮样皮疹(联合组:27%,单药组:2%)、 斑丘疹(联合组:13%,单药组:0%)和腹泻(联合组:15%,单药组:20%)(表2)。联合组观察到1例治疗相关性死亡。阿法替尼减量至30 mg时,AE更多见于联合组(56.7% vs 26.2%)。减量至20 mg时,AE则在两组间相似(13.6% vs 16.7%)。联合组中25例(30%)患者因毒性停止西妥昔单抗治疗,西妥昔单抗的中位治疗周期为9个周期(0-51)。因AE导致的治疗中断分别为联合组12(14%)例和单药组9(11%)例(图1)。
表2 不良事件
讨论
这项临床试验得到的是阴性的结果,一线阿法替尼联合西妥昔单抗较阿法替尼单药未能显著改善EGFR突变型NSCLC患者的PFS、OS、TTD和ORR。
EGFR TKI单药仍是EGFR突变型NSCLC的标准治疗,尽管一至三代TKI均可选择,但三代TKI奥希替尼与厄洛替尼或吉非替尼相比可显著改善PFS和OS,已经成为一线治疗的优选方案。但即便如此,几乎所有患者最终仍会产生获得性耐药,在疾病进展后可用的治疗方案十分有限。因此,改进一线治疗策略成为EGFR突变型NSCLC研究的重中之重。
为什么阿法替尼与西妥昔单抗的联合治疗在耐药时有效却在一线治疗中失败,原因尚不清楚。接受联合用药的患者毒性更大、阿法替尼减少剂量的频率也更高。但这些因素本身并不能解释失败的结果。因为先前的研究表明,阿法替尼减量至每天30 mg并不会影响PFS。尽管试验中两组的停药率相似,联合组中许多患者因AE停止了西妥昔单抗的治疗,这可能会稀释联合治疗的获益。鉴于阿法替尼联合西妥昔单抗在EGFR TKI进展后的部分患者中仍有效,本项研究中联合方案在初始治疗中的失败可能反映了未经治疗疾病与获得性耐药具有生物学差异。自本研究开始以来,涌现出更多的临床前证据支持靶向HER-家族成员的EGFR TKI-单克隆抗体组合,尤其是将该组合用于携带HER2扩增/过表达这一EGFR TKIs耐药机制的肿瘤。最近的研究表明,HER2单克隆抗体介导的抑制与西妥昔单抗和奥希替尼一起,可以通过促进EGFR和HER2的降解,促进细胞凋亡,抑制ERK的激活,以及降低包括MET、AXL和HER3在内的旁路激活,来防止EGFR TKIs耐药的发生。此外,靶向EGFR-和HER家族的抗体(靶向HER2和ERBB3)与EGFR TKI的联合治疗可以通过减少旁路信号通路的激活来有效地克服TKI耐药。
尽管本研究不支持阿法替尼联合西妥昔单抗在广泛的EGFR突变型肺癌人群中应用,但未来对EGFR TKI与EGFR单克隆抗体的组合的研究应集中在优化剂量和治疗时间上,以提高对该组合的耐受性并完成足够的治疗。此外,这种联合方式可能对某些特定的人群是值得进一步研究的。阿法替尼是一种泛HER抑制剂,与受体的胞内区域结合,而西妥昔单抗则与胞外区域结合;EGFR的双重抑制可能在特别依赖于该受体信号通路的肿瘤中更有用。一项奥希替尼联合耐昔妥珠单抗用于奥希替尼耐药的EGFR突变型肿瘤研究的初步结果支持这一假设,研究表明联合治疗对携带EGFR C797S耐药突变的肿瘤具有良好的活性,因此肿瘤仍然依赖突变的EGFR信号通路。这种组合能否有效防止奥希替尼在未经治肿瘤中耐药的发生仍有待明确。此外,临床前研究表明,对EGFR TKIs耐药的其他EGFR突变类型可能对TKI联合西妥昔单抗的治疗反应良好,包括本研究未纳入的EGFR20外显子插入突变。最后,最新的证据表明,西妥昔单抗对不同EGFR突变类型的敏感性可能不同,对EGFR19外显子缺失突变的敏感性降低。鉴于在TKI中加入EGFR抗体对EGFR突变型肺癌总体人群缺乏益处,鉴定疗效预测的生物标记物至关重要。
一个重要的悬而未决的问题是,与TKI单药治疗相比,双重EGFR抑制时耐药机制是否不同。耐药机制因使用的药物不同而不同,EGFR T790M突变是一代和二代TKIs而非三代TKI的主要耐药机制。目前尚不清楚一种TKI与西妥昔单抗联合应用时是否仍然如此,尽管临床前数据显示T790M仍将是重要的耐药机制且三代TKI(如奥希替尼)在阿法替尼联合西妥昔单抗耐药后很可能仍具有活性。在本项研究中,基于组织和血液的循环肿瘤DNA检测将为联合治疗的耐药机制提供更多见解。
结论
在阿法替尼基础上加用西妥昔单抗未能改善临床结局,反而增加了毒性。有必要对EGFR突变型肺癌进行更多的联合治疗研究,以延缓耐药并提高生存率。
参考文献
Goldber B, Redman W, Lilenbaum R, et al. Randomized Trial of Afatinib Plus Cetuximab Versus Afatinib Alone for First-Line Treatment of EGFR-Mutant Non–Small-Cell Lung Cancer: Final Results From SWOG S1403. [J] Journal of Clinical Oncology. 13 Oct. 2020