IMpower110研究:阿替利珠单抗一线单药挑战PD-L1高表达晚期NSCLC
免疫治疗在晚期非小细胞肺癌(NSCLC)的综合治疗中占据越发重要的地位,PD-1单抗类药物已经获批一线单药治疗晚期NSCLC,改写了传统化疗作为一线首选方案的历史。PD-L1单抗同样在晚期NSCLC治疗中表现出色,阿替利珠单抗先后获批单药或联合其他治疗用于特定晚期NSCLC的二线及一线治疗。近日,《新英格兰医学杂志》(The New England Journal of Medicine)刊发了一项重磅国际多中心III期随机对照研究IMpower110的最终数据,结果表明PD-L1抑制剂阿替利珠单抗单药一线方案相较于化疗能显著延长PD-L1高表达晚期NSCLC患者的总生存期,且安全性更佳,为晚期NSCLC初治癌患者提供了又一个超越化疗的更佳选择。

研究背景
NSCLC的全身治疗已从传统的单一化疗模式发展为如今的综合治疗模式,抗血管治疗、靶向治疗、免疫治疗等突破性疗法不断刷新着NSCLC患者的生存记录。对于存在EGFR、ALK等驱动基因阴性突变的患者,以PD-1/PD-L1抑制剂为代表的免疫治疗类药物可能是改写患者命运的新希望。随着不少高水平的临床研究结果逐步揭晓,免疫治疗在NSCLC综合治疗中的地位越发重要,譬如帕博利珠单抗已经被美国食品药品监督管理局(FDA),欧盟药品审评局(EMEA)以及中国药品监督管理局(NMPA)等权威监管机构批准一线单药用于PD-L1表达阳性驱动基因突变阴性的晚期NSCLC患者[1]。就在今年5月,美国FDA再次批准了另一种PD-1抑制剂纳武利尤单抗联合CTLA-4抑制剂伊匹木单抗的双免疫方案用于PD-L1表达阳性驱动基因突变阴性晚期NSCLC患者一线治疗[2],再次凸显了免疫类药物在NSCLC治疗中的核心地位。
上述已经跻身NSCLC治疗一线阵营的免疫类药物均为PD-1抑制剂,作为与PD-1单抗并驾齐驱的PD-L1单抗类药物表现如何呢?阿替利珠单抗作为第一个被FDA批准上市的PD-L1单抗[3],已获批晚期尿路上皮癌的二线治疗及晚期三阴性乳腺癌一线联合治疗的适应症[3],并于2019年3月成为全球首个获批广泛期小细胞肺癌一线方案的免疫类药物[4],这对于治疗手段极为有限的广泛期小细胞肺癌具有里程碑式的意义。阿替利珠单抗在NSCLC治疗中也有出色的表现,在Ⅱ期和Ⅲ期临床研究中单药使用就能有效延长多线治疗失败NSCLC患者的中位生存期(overall survival,OS)[5],那么阿替利珠单抗是否能像PD-1单抗一样,在NSCLC一线治疗方案中独挑大梁呢?IMpower110研究的最终结果揭晓了阿替利珠单抗一线挑战含铂双药化疗方案治疗晚期NSCLC患者的数据,表明阿替利珠单抗相较于化疗能显著延长晚期PD-L1高表达NSCLC患者的OS这一至关重要的核心指标。至此,晚期NSCLC患者一线治疗方案将再次改写。
研究方法
IMpower110试验是一项国际多中心、开放标签、随机对照Ⅲ期临床研究。研究共纳入了 572名晚期NSCLC初治患者,绝大部分患者驱动基因突变为阴性(wild type,WT),其中有18名患者因为驱动基因突变阳性而被排除纳入疗效分析数据,所有患者按照1:1比例随机分配至阿替利珠单抗治疗组(阿替利珠单抗1200 mg静脉滴注,三周一疗程;n = 285)和化疗组(培美曲塞/吉西他滨联合铂类方案4~6个周期后维持或支持治疗;n = 287)。研究评估终点为PD-L1高表达组群的OS,次要终点为无疾病进展生存期(PFS),客观缓解率(ORR),反应持续时间(DOR)以及药物安全性(不良反应AE)。值得一提的是,研究者对目前常用的三种PD-L1检测抗体22C3、SP263和SP142进行了一致性分析,并将肿瘤突变负荷(TMB)也进行了疗效预测分析。
研究结果
阿替利珠单抗相较化疗显著延长OS,PD-L1高表达组可延长7.1个月
与传统含铂双药方案相比,阿替利珠单抗一线治疗能显著改善PD-L1高表达晚期NSCLC患者的中位OS,两组的OS分别为20.2个月和13.1月(HR = 0.59,95% CI:0.40, 0.89,P = 0.01),阿替利珠单抗可延长OS达7.1个月,两组的12个月OS率分别为64.9% vs. 50.6%(图1)。但在PD-L1中高表达组OS未能达到预先设定的临界值(18.2个月vs.14.9个月),总体组群(不论PD-L1表达水平)的OS数据(17.5个月vs.14.1个月)未纳入统计学分析。
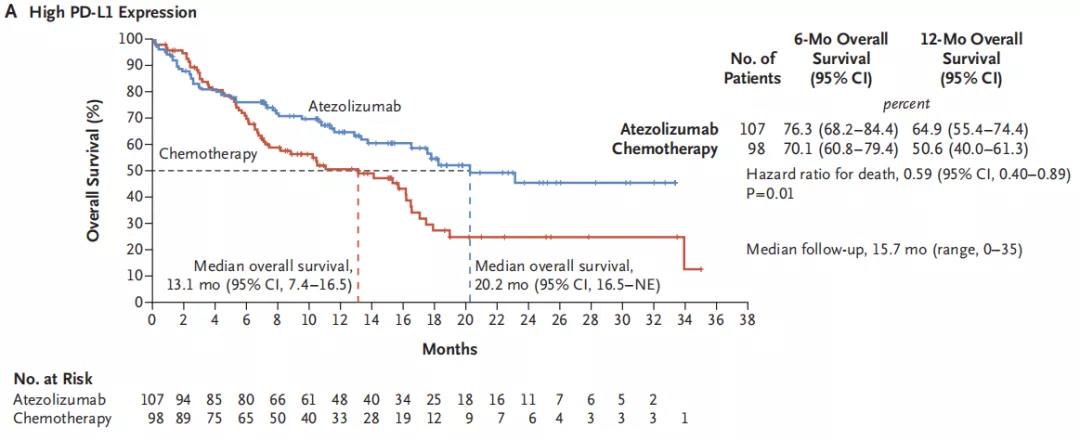
PD-L1高表达患者阿替利珠单抗一线单药组PFS,ORR均优于传统化疗组
在PD-L1高表达组群中,两个治疗组的中位PFS分别为8.1月和5.0月(HR = 0.63,95% CI:0.45, 0.88),ORR分别为38.3%和28.6%;对于PD-L1表达为中高水平的患者,两组中位PFS分别为7.2月和 5.5月(HR = 0.67,95% CI:0.52, 0.88),ORR分别为30.7%和32.1%,总体组群两个治疗组的ORR分别29.2%和31.8%。
阿替利珠单抗相较化疗3级以上AE发生率更小,安全性更佳
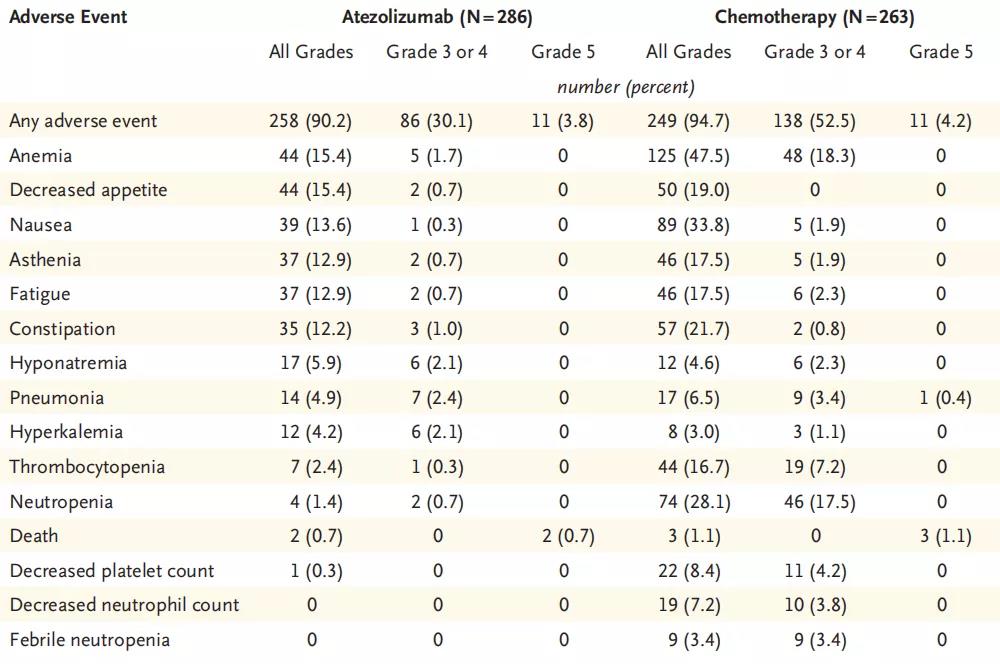
阿替利珠单抗组和化疗组的AE发生率分别为90.2%和94.7%接受化疗的患者,但阿替利珠单抗组3级以上AE发生率明显更少(30.1% vs.52.5%),尤其是血液系统毒性在化疗组更常见。两组的严重AE发生率分别为28.3%和28.5%,5级AE发生率分别为3.8%和4.2%。
对于临床医师最为关心的免疫相关不良反应,在本研究中阿替利珠单抗组40.2%的患者出现了免疫相关AE,化疗组的发生率则为16.7%,两组的3级以上免疫相关AE发生率分别为6.6%和1.5%,最常见的免疫相关AE分别为肝功异常,皮疹和甲状腺功能减退(图2)。
PD-L1检测单抗表达一致性分析和TMB疗效预测分析
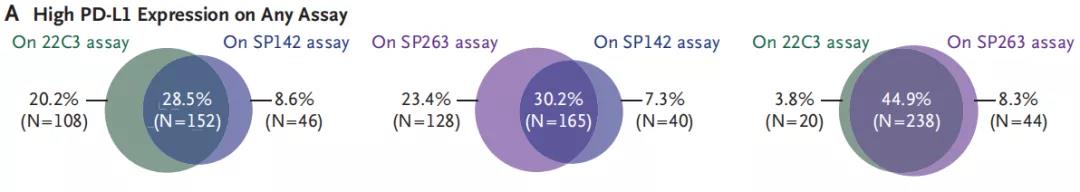
研究者对于PD-L1高表达的定义为病理组织使用免疫组化方法检测的PD-L1阳性细胞占比≥50%;中到高水平表达为PD-L1阳性细胞占比≥1%,<50%,PD-L1表达得分<1%被认为是低水平表达。三种检测抗体所测得的PD-L1表达水平一致性见图2。
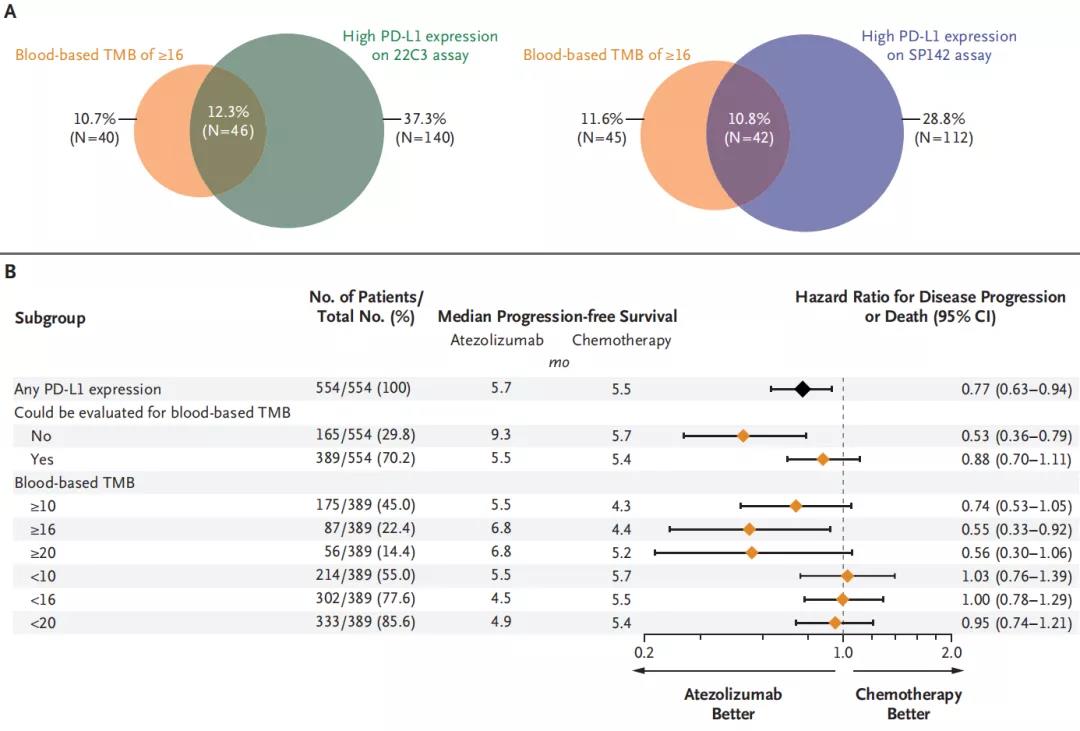
在总体554名患者中有389名患者进行了血液TMB检测,其中 22.4%的患者TMB得分≥16分,TMB评分显示出了同PD-L1表达一样的疗效预测作用。对于TMB得分高于16分的患者组群,阿替利珠单抗治疗组和化疗组的中位OS分别为13.9个月和8.5个月,两组的PFS分别为6.8个月和4.4个月(图3)。
讨论
肺癌作为全世界发病率最高的恶性肿瘤,一直是免疫治疗类药物研发最炽手可热的领域,目前的免疫治疗类药物可谓百花齐放,肺癌患者和临床医师的选择越来越多。对于晚期NSCLC的治疗,PD-1抑制剂帕博利珠单抗和纳武利尤单抗因为高级别的证据支持已经跃升一线单免疫的治疗方案,占据免疫治疗半壁江山的PD-L1单抗是否也能交出亮眼的成绩呢?
早在2016年,阿替利珠单抗就因在Ⅲ期随机对照研究中(OAK试验)超越化疗的(OS:13.8个月vs.9.6个月)数据被FDA批准用于铂类化疗进展后的晚期NSCLC患者,这是阿替利珠单抗在NSLCL治疗领域的初次试水[5]。在2018年,阿替利珠单抗再次被FDA批准其联合贝伐单抗、紫杉醇及铂类(ABCP)的综合治疗方案用于转移性非鳞NSCLC患者的一线治疗,这一批准基于一项国际多中心III期随机对照研究IMpower150,在此项研究中,使用贝伐单抗+化疗的方案以及在此基础上联合阿替利珠单抗的中位PFS分别为6.8个8.3个月,中位OS分别为14.2个月和19.7个月,且对EGFR/ALk TKI治疗失败的驱动基因突变阳性的非鳞NSCLC患者,联合阿替利珠单抗的方案同样能显著改善OS(29.4个月vs.18.1个月),此外,对于不同PD-L1表达水平的患者组群均可观察到联合免疫治疗的生存获益[6]。
在IMpower110试验中,研究者对于PD-L1单抗进行了更大胆的探索,单药挑战晚期NSCLC患者一线治疗并取得了振奋人心的成绩。对比含铂双药化疗这一传统标准一线方案,阿替利珠单药对于PD-L1高表达的患者延长了长达7.1个月的OS,且ORR和PFS也全面超越化疗,3级以上AE发生率也明显更低,和KEYNOTE-042研究(该研究推动PD-1单抗帕博利珠单抗获批晚期NSCLC一线方案)揭晓的结果一样[7],免疫治疗真正的受益群体还是PD-L1高表达的患者组群。基于IMpower110的研究结果,美国FDA于今年6月批准阿替利珠单抗用于一线治疗PD-L1高表达、驱动基因突变阴性的转移性NSCLC成人患者[8]。IMpower110研究还分析了不同抗体对于PD-L1检测的效能,结果表明 22C3 和 SP263单抗的检测结果具有高度一致性,而SP142相比之下敏感度就有所欠缺。该研究结果也支持TMB评分能较好地预测免疫治疗疗效这一立论,因为该研究中TMB评分≥16分的患者生存获益更加显著,尤其是PFS获益,但TMB作为免疫治疗生物标志物需要更进一步的研究支持。
IMpower110的研究结果让晚期NSCLC患者的一线治疗又有了新的选择。各种免疫治疗药物的问世和适应症的不断获批让临床医师在选择治疗方案时不禁出生“乱花渐欲迷人眼”的困惑:同为一线单药方案,PD-1单抗和PD-L1单抗谁才是更优之选?PD-L1单抗是否能作为PD-1单抗耐药后的挽救措施?PD-1单抗联合PD-L1单抗或者二者序贯是否有进一步生存获益?PD-1/PD-L1单抗联合化疗或者抗血管治疗是否比免疫单药一线更能改善生存期?我们期待这些问题能早日揭晓答案,为晚期NSCLC患者制定出更优化的治疗措施。
参考文献
[1] https://www.merck.com/?s=Pembrolizumab
[2] https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-nivolumab-plus-ipilimumab-and-chemotherapy-first-line-treatment-metastatic-nsclc
[3] https://search.usa.gov/search?utf8=%E2%9C%93&affiliate=fda1&sort_by=&query=Atezolizumab
[4] https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-atezolizumab-extensive-stage-small-cell-lung-cancer
[5] A. Rittmeyer, F. et al., Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer(OAK): a phase 3, open-label, multicentre randomised controlled trial;[J].The Lancet, December 2016.
[6] Socinski MA,,et al. IMpower150 final analysis:Efficacy of atezolizumab+ bevacizumab and chemotherapy in first-line(1L) metastatic nonsquamous non-small cell lung cancer(NSCLC) across key subgroups[EB/OL]. 2020 AACR,abstract CT216.
[7] Mok TSK,, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-smallcell lung cancer(KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial;[J].The Lancet , April 2019
[8] https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-atezolizumab-first-line-treatment-metastatic-nsclc-high-pd-l1-expression
[9] Roy S. Herbst et al, Atezolizumab for First-Line Treatment of PD-L1–Selected Patients with NSCLC;[J].The New England Journal of Medicine, October 2020