CLDN18.2靶点新药,Zolbetuximab或突破胃癌一线治疗疗效瓶颈
晚期胃和胃食管交界(G/GEJ)以及食管腺癌(EC)的全身治疗以化疗为主,疗效已达瓶颈,临床需求远未被满足。针对胃癌靶点的研究探索一直在进行中,以期突破治疗困境。CLDN18.2是在胃癌中发现的“新兴”靶点,针对该靶点的药物在相关研究中表现出了一定的潜力。FAST研究是一项Ⅱ期随机临床试验,旨在评估Zolbetuximab+表柔比星+奥沙利铂+卡培他滨(EOX)一线治疗CLDN18.2阳性晚期G/GEJ或EC的疗效和安全性,并与单独EOX治疗进行比较,结果显示Zolbetuximab与化疗联合治疗CLDN18.2高表达G/GEJ/EC,有生存获益。该研究的结果发表于近期的《临床肿瘤学年鉴》(Annals of Clinical Oncology)。
研究背景
CLDN18.2是什么?
胃和胃食管交界(G/GEJ)以及食管腺癌(EC)死亡率很高,由于临床表现不特异,诊断时多已为晚期,预后较差。化疗是其标准治疗,多采用铂类/氟尿嘧啶类方案。虽各种靶向治疗、免疫治疗和新型化疗用于G/GEJ和EC治疗,仍少有患者一线治疗后可生存2年。改善晚期GC/GEJ和EC的生存仍是未满足的医疗需求。
紧密连接蛋白属于紧密连接分子家族,参与上皮层通透性、屏障功能和极性的调节。正常组织的紧密连接蛋白18.2(CLDN18.2)只存在于胃粘膜细胞的紧密连接中,静脉注射的抗体多不能到达紧密连接超分子复合物中的CLDN18.2表位。由于细胞极性紊乱与恶性转化相关,所以CLDN18.2表位暴露并可与单克隆抗体靶向结合,胃癌和胃转移癌中CLDN18.2表达保持不变。
Zolbetuximab是什么?
Zolbetuximab是一类嵌合单克隆免疫球蛋白G1抗体,可与CLDN18.2结合,通过抗体依赖细胞毒(ADCC)和补体依赖细胞毒(CDC)作用介导肿瘤细胞死亡。已有研究显示,Zolbetuximab单药治疗经过多线治疗的CLDN18.2阳性G/GEJ安全有效。临床前数据显示,Zolbetuximab和细胞毒药物具有很强的协同作用。最近发表的Ⅱa MONO研究显示,Zolbetuximab单药治疗CLDN18.2阳性晚期G/GEJ,耐受性良好,具有抗肿瘤活性。
研究方法
FAST是一项Ⅱ期随机研究,在6个国家的49家中心进行。
入组标准
晚期G/GEJ和EC患者,年龄≥18,≥40%肿瘤细胞有中到强的CLDN18.2表达。
治疗方案
患者接受一线表柔比星+奥沙利铂+卡培他滨(EOX,Q3W,组1,n=84),或Zolbetuximab+EOX(负荷量800mg/m2,然后600mg/m2,Q3W)(组2,n=77)治疗。组3(探索性的)为入组已经开始后又加设的一个组,治疗方案为Zolbetuximab+EOX(1000mg/m2,Q3W,n=85)。
主要终点
主要终点为无进展生存(PFS),次要终点为总生存(OS)。
研究结果
组2患者PFS和OS双改善,获益与CLDN18.2表达相关
组2患者的PFS(HR=0.44,95%CI 0.29~0.67,P<0.0005)和OS(HR=0.55,95%CI 0.39~0.77,P<0.0005)较组1患者明显改善,显著的PFS获益主要表现在≥70%的肿瘤细胞中至强CLDN18.2表达的患者(HR=0.38,95%CI 0.23~0.62,P<0.0005)(图1)。
与组1患者相比,组3患者的PFS也有显著改善(HR=0.58,95%CI 0.39~0.85,P=0.0114),与是否高表达CLDN18.2无关,OS未见明显改善。
多数与Zolbetuximab+EOX相关的不良事件(AE)为1~2级,包括恶心、呕吐、中性粒细胞减少、贫血,≥3级AE无明显增加。
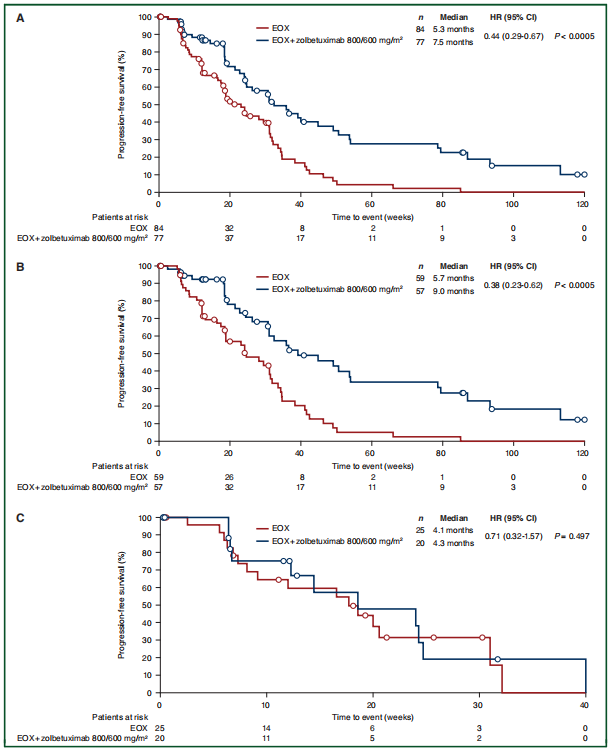
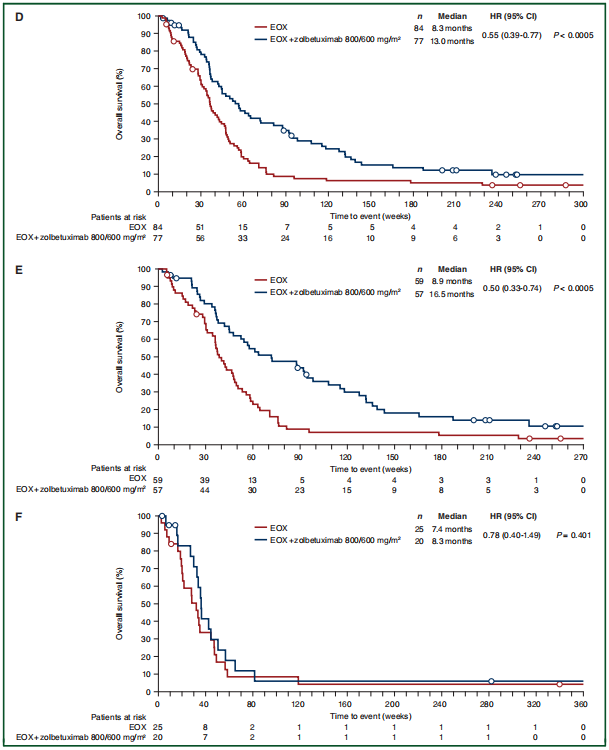
图1. PFS(A~C)和OS(D~F)(A)所有患者;(B) ≥70%肿瘤细胞CLDN18.2阳性患者;(C)40%~69%肿瘤细胞CLDN18.2阳性患者;(D)所有患者;(E)≥70%肿瘤细胞CLDN18.2阳性患者;(F)40%~69%肿瘤细胞CLDN18.2阳性患者
讨论
组2中,全体患者以及≥70%肿瘤细胞中到强CLDN18.2表达患者的PFS显著改善
这项研究显示,与单独EOX相比,EOX+Zolbetuximab(800mg/m2,随后600mg/m2)治疗,组2全组患者以及≥70%肿瘤细胞中到强CLDN18.2表达患者的PFS改善同时具有统计学和临床意义,Zolbetuximab+EOX治疗也与OS显著改善相关。PFS和OS的HR表明进展和死亡风险降低约50%。结果的改善可能与Zolbetuximab通过CDC和ADCC对CLDN18.2阳性肿瘤细胞的强细胞毒作用有关。正常胃粘膜细胞中,CLDN18.2表位存在于正常上皮细胞间的紧密连接超分子复合物中,恶性转化后,CLDN18.2在80%原发性胃癌和胃癌转移中仍有表达,因此可作为抗体结合和招募免疫系统的靶点。
对照组EOX的OS率低于历史研究,可能与CLDN18.2阳性患者的选择无关
REAL-2研究显示,与表柔比星+顺铂+5-FU(ECF)相比,一线EOX可改善晚期胃癌的OS(中位11.2个月和 9.9个月;HR 0.80,95% CI 0.66~0.97;P=0.02)。这项研究中,EOX治疗患者的中位OS为8.3个月,REAL-2和FAST研究中位OS的差异可能是FAST研究中患者疾病负荷更高所致,因为REAL-2研究中EOX组基线转移性疾病与局部晚期疾病的比例分别为75.7%和24.3%,FAST研究EOX组中分别为95.2%和4.8%。这项研究中EOX的OS率可能与CLDN18.2阳性患者的选择无关。最近研究显示,原发肿瘤或转移淋巴结中CLDN18.2表达对EC患者的OS无显著影响(P=0.5)。与此同时另有研究表明,CLDN18表达减少可能是胃癌预后不良的孤立指标。因此,尽管CLDN18.2是一种重要的治疗标志物,但尚不清楚它是否对预后有影响。
探索性分析
探索性分析显示,与3组相比,组2患者发生导致停用Zolbetuximab的AE的中位时间更长,提示AE导致的停药倾向于更早发生于3组,可能源于较高的Zolbetuximab剂量,但缺少充足数据支持这个结果。正在进行的Zolbetuximab联合化疗的Ⅲ期研究旨在评估较低剂量Zolbetuximab的疗效,因为这项Ⅱ期研究已证实其疗效以及良好的安全性。
CLDN18.2高表达患者疗效改善,支持CLDN18.2表达与Zolbetuximab治疗活性间的关系
由于临床前模型中Zolbetuximab的细胞毒活性对表达CLDN18.2的肿瘤具有高度特异性,因此这项研究采用了生物标志物富集人群的设计。既往胃癌研究显示,≥40%肿瘤细胞表达CLDN18.2的患者Zolbetuximab治疗有获益,其中近2/3患者(72%,n=116/161)有≥70%肿瘤细胞中到强的CLDN18.2表达。由于CLDN18.2在胃癌表达的异质性,这项研究采用≥40%肿瘤细胞中到强的CLDN18.2表达作为入组标准,以富集更可能从CLDN18.2靶向治疗中获益的患者。40%~69%肿瘤细胞中到强的CLDN18.2表达的患者没有PFS和OS显著改善,但该亚组患者数量较少。重要的是,与所有患者相比,≥70%肿瘤细胞中到强的CLDN18.2表达的患者的PFS和OS的改善幅度更大。CLDN18.2高表达患者的疗效改善支持CLDN18.2表达与Zolbetuximab治疗活性间的关系。
Zolbetuximab安全性可接受
即使经过长时间治疗,Zolbetuximab的安全性亦可接受,AE可控。最常发生的AE是胃肠道反应(恶心和呕吐),一般为轻到中度,这些结果与既往单药Zolbetuxiab治疗时的AE一致,表明联合化疗不增加Zolbetuximab预期外毒性。Zolbetuximab+ EOX治疗患者的贫血和中性粒细胞减少报道更频繁,它们通常与化疗相关。此外,由于Zolbetuximab+EOX治疗患者的生存明显长于EOX治疗患者,AE监测时间延长,这可能也是AE(如贫血、中性粒细胞减少症)频率更高的原因。Zolbetuximab+EOX因AE而终止治疗的比率较低,呕吐是两组治疗终止的最常见原因。
未来研究前景
总之,这项随机Ⅱ期研究显示,在生物标志物富集的晚期胃食管癌患者中,与EOX相比,Zolbetuximab+EOX具有良好的获益/风险比,PFS和OS延长具有临床意义。这些数据为CLDN18.2作为潜在的治疗靶点提供了强有力的证据。两项双盲、多中心Ⅲ期临床研究已启动,在生物标志物富集的患者中比较一线化疗+Zolbetuximab和单独化疗治疗,SPOTLIGHT研究比较Zolbetuximab+mFOLFOX6与安慰剂+mFOLFOX6治疗不可切除或转移性CLDN18.2阳性、人表皮生长因子受体2阴性G/GEJ,GLOW研究与SPOTLIGHT类似,采用的化疗方案是卡培他滨/奥沙利铂。
参考文献
Sahin U, TürECi Ö, Manikhas G, et al. FAST: a randomised phase II study of zolbetuximab(IMAB362) plus EOX versus EOX alone for first-line treatment of advanced CLDN18.2-positive gastric and gastro-oesophageal adenocarcinoma [J]. Ann Oncol, 2021,32(5):609-619. doi:10.101/j.annonc.2021.02.005