前列腺癌筛查中国专家共识(2021年版)
1 前列腺癌流行病学特征
随着中国经济水平提高、人民生活水平改善和人均寿命延长,中国前列腺癌的发病率呈显著上升趋势,正逐步成为影响中国中老年男性健康的重要疾病[1]。2015年中国前列腺癌的总体发病率为10.23/10万人,死亡率为4.36/10万人[2]。2020年世界癌症报告数据显示,前列腺癌位居男性恶性肿瘤发病率的第6位,死亡率的第9位[3]。据世界卫生组织国际癌症研究机构统计预测,2020年中国前列腺癌发病率约15.6/10万人,新发病例超11万人,死亡人数超5万人[4]。其中一线城市前列腺癌发病率更高,北京、上海和广州的前列腺癌发病率分别达到19.30/10万人、32.23/10万人和17.57/10万人[5]。
中国初诊前列腺癌患者的临床分期与西方发达国家相比有很大差异[6]。以美国为例,在初诊前列腺癌患者中,临床局限性病例占76%,局部淋巴结转移病例占13%,远处转移病例仅占6%(其余5%为未知分期病例)[7]。而中国的多中心研究资料显示,仅1/3的初诊前列腺癌患者属于临床局限性前列腺癌,初诊时多数患者已处于中晚期,导致中国前列腺癌患者的总体预后远差于西方发达国家[6]。“早筛、早诊、早治”是提高肿瘤患者5年生存率行之有效的方法之一。研究[8]表明,推行前列腺癌筛查策略的国家,如日本,前列腺癌患者5年生存率迅速提升,平均每年提升约11.7%,5年生存率已达93.0%,而中国每年提升仅3.7%,5年生存率仅为69.2%。因此,对高危人群进行筛查、早期诊断和治疗是提高中国前列腺癌患者总生存率的有效手段。
2 前列腺癌筛查研究
前列腺癌筛查运用快速、简便、廉价的检查方法将健康人群中前列腺癌高危人群和低危人群鉴别开来,是从健康人群中早期发现可疑前列腺癌人群的一种措施,并非对疾病做出诊断。从理论上讲,前列腺癌的筛查有助于实现前列腺癌的早期发现、早期诊断、早期治疗,可提高前列腺癌的治疗效果,改善预后。但基于来自欧美的多项大规模、高水平的随机对照研究的结果[9-15],对于前列腺癌筛查是否能够提高患者总生存率以及降低前列腺癌特异性死亡率这一问题,却得出了存在争议的结论。
前列腺癌、肺癌、结直肠癌和卵巢癌筛查试验(PLCO试验)共纳入76 685名55~74岁的健康男性,随机分为筛查组和对照组。筛查组连续6年开展基于前列腺特异性抗原(prostate-specific antigen,PSA)检测的前列腺癌筛查;对照组采用常规随访和治疗方案(实际上有部分患者在常规随访和治疗中也进行了PSA检测),随访发现,PSA>4 μg/L的人群需要进一步诊治。随访7年后,两组间总生存率和前列腺癌特异性生存率差异无统计学意义[9];随访13和16年后,结果差异亦无统计学意义[10-11]。在该研究中,由于PSA检测的理念已被美国家庭医师广泛接受,对照组中有77%的患者接受了PSA检测,因此严重干扰了研究结果,极大地降低了筛查组的生存优势。
欧洲前列腺癌筛查随机对照研究(ERSPC研究)共纳入182160名50~74岁的健康男性,随机分为筛查组和对照组。筛查组每4年进行1次PSA检测,对照组不开展筛查,随访发现,PSA>3 μg/L的人群需要进一步诊治。随访9年后,对亚组(162 388名55~69岁的健康人群)进行分析结果显示,筛查组的前列腺癌特异性死亡率下降了20%,但两组死亡率差异无统计学意义[12]。在分别随访11、13和16年后,结果差异亦无统计学意义[13-15]。经校正后,与对照组相比,筛查组前列腺癌死亡率降低27%;筛查组和对照组前列腺癌特异性死亡率分别为0.34/1 000人年和0.54/1 000人年,筛查组人群死于前列腺癌的相对风险下降了21%。该研究提示,对781名健康个体开展基于PSA检测的前列腺癌筛查,经过长期随访,检出27例前列腺癌患者后,将会避免1人死于前列腺癌。
最新的一项有关筛查的真实世界研究分析了美国监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results,SEER)数据库引进PSA筛查后对于前列腺癌死亡率和转移性前列腺癌发生率的影响,在真实世界中进行PSA筛查后,前列腺癌患者死亡率降低37%,高于ERSPC试验的21%,转移性前列腺癌发生率降低62%,高于ERSPC试验的47%[16],说明前列腺癌筛查在真实世界中更能显著地降低转移性前列腺癌的发生率和死亡率。
基于PSA检测的前列腺癌筛查可使接受筛查的人群生存获益。值得注意的是,以上两项随机对照研究的假阳性率分别为12.9%和12.5%,导致了过度诊断;PSA异常的筛查阳性者后续需接受前列腺穿刺活检以确诊或排除前列腺癌,而穿刺活检可能会导致一些并发症,包括感染、血尿、血精、排尿困难等[17-19]。
以往国内有关前列腺癌筛查的研究较少,但近年来由泌尿外科医师牵头针对社区无症状人群、基于血清PSA检测的前列腺癌筛查研究顺利开展,并报道了初步的研究结果。
复旦大学附属肿瘤医院团队于2017—2018年对上海的13个社区及上海、江苏的3个筛查基地共2 159名受试者进行了PSA筛查,接受筛查者的中位年龄为70.0岁(45~80岁),其中PSA异常者为271人(12.7%),但仅57名(2.64%)PSA异常者接受了前列腺穿刺活检,最终确诊的前列腺癌患者为34例(占筛查总人群的1.57%),即每检出1例前列腺癌患者,需筛查63.5名男性。研究发现,本次筛查的穿刺意愿率较低,有接近80%的PSA异常患者未接受穿刺,因此本次筛查的前列腺癌检出率可能远远被低估[20]。该研究使用国产便携式微流控PSA检测仪器,在基层社区进行大规模筛查,初步证实了便携式PSA检测仪器进行PSA筛查的可行性与有效性。
南京大学医学院附属鼓楼医院团队[21]报道了2018年在南京16所社区卫生服务中心进行的前列腺癌筛查“PSA-多参数磁共振成像(multi- parameter magnetic resonance imaging,mpMRI)-靶向穿刺”模式的探索,共纳入6 903名受试者,中位年龄为66岁(50~95岁),其中PSA异常者为835人(12.1%),最终确诊的前列腺癌患者为79例(占筛查总人群的1.14%)。该研究进一步证实,随着年龄的增加,PSA异常率及前列腺癌穿刺阳性率也会进一步增加,且研究中使用的MRI/超声检查融合靶向活检极大地提高了临床有意义前列腺癌的检出率。但835名PSA异常者中仅有35.4%的受试者接受了mpMRI检查,推荐进行穿刺活检的受试者中有63.2%实施了穿刺活检术,提示实际的发病率可能远高于目前的检出率。尽管目前mpMRI并未推荐应用于前列腺癌筛查,但是该研究为这种“精准筛查”模式进行了初步探索并提供了参考。以上研究显示,血清PSA筛查(将PSA≥4 μg/L定义为异常值)对中国老年男性具有较高的阳性预测值,且由于价格低廉,检测方便,依然是目前前列腺癌筛查最常用的手段。由于中国男性局部晚期及晚期前列腺癌患者占比远高于西方发达国家,因此通过血清PSA检测可以有效筛地选出更多的临床显著性前列腺癌。
3 前列腺癌筛查中的关键问题
3.1 普通人群的筛查年龄
既往研究表明,随着年龄的增加,男性患前列腺癌的风险也随之增加[22]。基于中国人群的研究表明,50~59、60~69和70~79岁的前列腺癌发病率分别是11.6%、16.4%和23.1%[23]。国外各指南和共识对于前列腺癌筛查的起始年龄推荐不尽相同。美国预防服务工作组(United States Preventive Services Task Force,USPSTF)及美国泌尿学会(American Urological Association,AUA)指南均推荐对55~70岁男性进行筛查,美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)早期诊断指南则推荐开始筛查的年龄为40~45,终止筛查的年龄为75岁。欧洲泌尿外科学会(European Association of Urology,EAU)指南推荐对50岁以上的男性进行筛查,当预期寿命<15年时则终止筛查[24-26]。
目前关于前列腺癌筛查的起始年龄依然存在争议。国外研究[22]表明,PSA筛查可以降低50~54岁男性的转移性前列腺癌发生的风险和前列腺特异性死亡率,并建议前列腺癌筛查应不晚于50~54岁。而对于60岁时PSA水平<1 ng/mL的男性,不建议进一步筛查,在60岁时PSA水平>2 ng/mL的男性进行筛查也是有益的[27]。
3.2 前列腺癌家族史及携带BRCA2突变人群的筛查年龄
前列腺癌是高度遗传性的疾病,根据北欧长期随访研究,遗传因素占前列腺癌发病风险的42%~45%[28]。对于年龄>45岁且伴有前列腺癌家族史的男性,前列腺癌患病率为3.5%,而无家族史的男性则为1.45%[29]。因此,对于年龄>45 岁且存在前列腺癌家族史的男性,建议尽早开始进行前列腺癌筛查。
研究[30]表明,12%的转移性前列腺癌患者中存在16个基因的胚系突变,其中包括BRCA2(5.3%)。中国人群中DNA损伤修复基因胚系突变在前列腺癌中的发生率为9.8%,其中BRCA2突变发生率为6.3%[31]。研究提示,BRCA2胚系突变是转移和前列腺癌特异性生存率差的孤立预测因子[32-33]。在男性BRCA2突变携带者中进行前列腺癌筛查,与非突变携带者相比,有助于在更早期发现预后更差的癌症[34-35]。因此,对于携带BRCA2基因突变的男性,应该将前列腺癌筛查的年龄相应提前。
3.3 在筛查过程中如何增加初筛阳性人群的转化率
在国内前列腺癌筛查模式前期的探索中发现,初筛阳性人群比例是接近的,约为12%,但最终接受进一步诊治,特别是前列腺穿刺的比例仅有20%~30%[20-21],绝大部分的初筛阳性人群在PSA初步筛查后并未到专业医疗机构完成后续诊治。有研究[36]发现,患者就诊实施率与其居住地与专业医疗机构间的距离呈负相关。因此,专业前列腺癌诊疗资源的可及性也是前列腺癌筛查工作在国内推进的重要障碍。另外,在初筛阳性患者接受后续诊治的过程中,其经济负担也必须纳入筛查工作顺利实施的考量;从长期来看,中国还需要更多的资金投入到前列腺癌筛查研究中,获取更多的数据,进而获得更多的产业和政策支持。
3.4 中国人群筛查模式的探索和选择
3.4.1 社区服务站模式
以发起筛查的医疗机构为核心,就近与附近社区合作进行前列腺癌筛查活动。社区长期招募前列腺癌高危人群,医疗机构的筛查团队进入社区,受试者统一在社区内采集血液样本并及时预处理,可以采取体外快速检测或送回相应医疗机构进行检测。最终筛查结果由社区通知到患者本人及家属,PSA异常者可定向转诊。
3.4.2 筛查基地模式
招募区域内适宜医疗机构作为合作单位,建立“前列腺癌筛查基地”,初步筛查并招募前列腺癌高危人群。由“筛查基地”统一采集血液样本并预处理,在基地检测,或统一运送回区域中心检测。根据检测结果反馈并指导受试者于区域内适宜医疗机构进行进一步诊治,并在各级医疗机构间实现双向转诊。
3.4.3 筛查门诊模式
在有资质的医院、固定时间开设“前列腺癌筛查专病门诊”,主动吸引前列腺癌高危人群进入医院,进行一对一健康咨询及前列腺癌筛查,筛查结果可通知到患者本人或家属。该模式的优势在于主动就诊的受试者对自身健康较为关注,因此PSA异常受试者的转诊率较高,依从性较好。
4 前列腺癌筛查专家共识
本共识编写组专家结合最新文献报道和中国前列腺癌早期诊断的现状,形成以下“前列腺癌筛查中国专家共识”:
⑴ 筛查的目的和意义:增加高危人群的前列腺癌检出率,发现早期前列腺癌。降低筛查人群的前列腺癌死亡率,同时不影响筛查人群的生活质量。
⑵ 知情同意:需要对受试者详细阐明前列腺癌筛查的风险和获益,并签署知情同意书后才能开展筛查。
⑶ 前列腺癌筛查的方法:① 推荐定期进行血清PSA检测;② 不推荐将PCA3检测、p2PSA检测、4Kscore、前列腺健康指数、MRI检查等作为前列腺癌筛查的常规手段;③ 开展筛查活动时,可集中收集并保存受试者血清样本后带回医院统一进行PSA检测,或采用便携式PSA检测仪器进行快速检测(微流控技术、荧光免疫层析法等)。需注意的是,快速PSA检测的结果仅作为初筛时的参考,而不作为疾病诊断的依据,受试者需转诊至医院进行PSA的复测确认。
⑷ 前列腺癌筛查的人群:① 对身体状况良好,且预期寿命10年以上的男性开展基于血清PSA检测的前列腺癌筛查;② 血清PSA检测每2年进行1次,根据受试者的年龄和身体状况决定PSA检测的终止时间;③ 对前列腺癌高危人群要尽早开展血清PSA检测,高危人群包括:年龄>50岁的男性,年龄>45岁且有前列腺癌家族史的男性,年龄>40岁时PSA>1 μg/L的男性,携带BRCA2基因突变且年龄>40岁的男性。
⑸ PSA筛查后的随访:将PSA≥4 μg/L定义为异常值。当受试者PSA<4 μg/L时,建议进行每2年1次的随访;当受试者PSA≥4 μg/L时,应及时通知到受试者本人或家属,并建议受试者转诊至医院进行进一步诊断、治疗和随访。
5 前列腺癌筛查及PSA异常人群的转诊路径
前列腺癌筛查路径见图1,PSA异常人群转诊路径见图2。
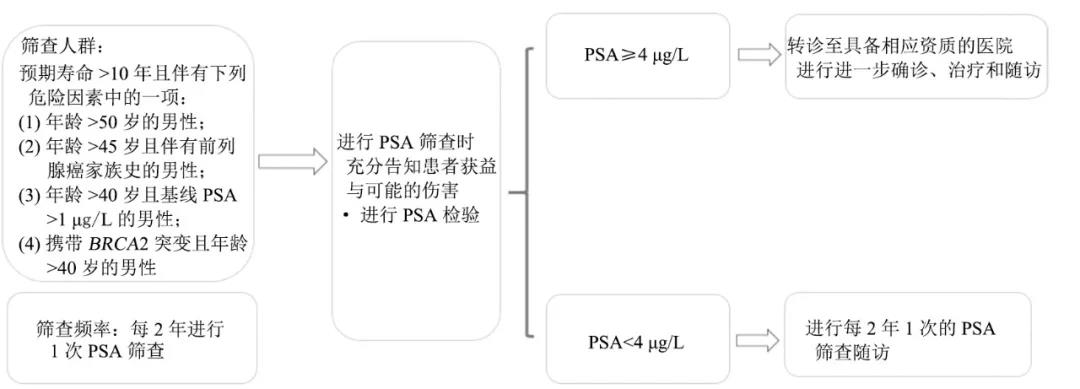
图 1 前列腺癌筛查路径
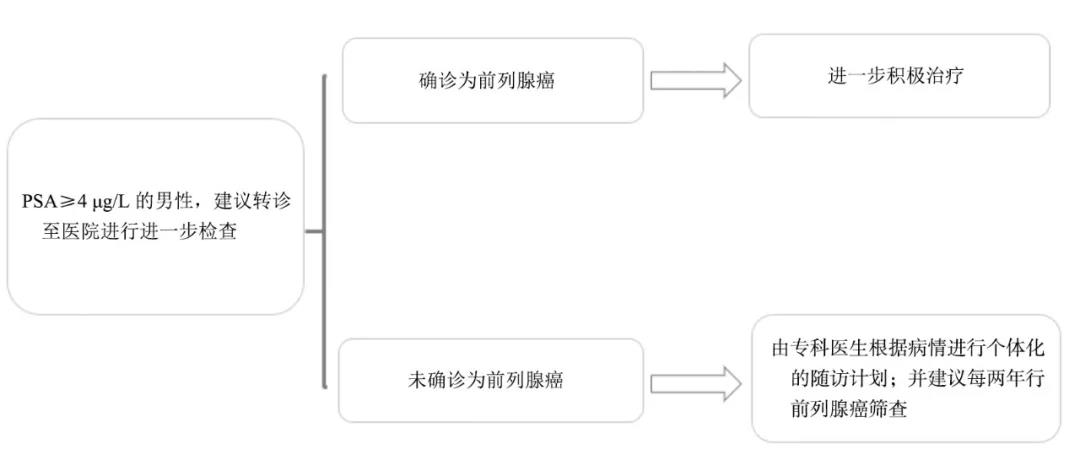
图 2 PSA异常人群转诊路径
[参考文献]
叶定伟, 朱 耀. 中国前列腺癌的流行病学概述和启示 [J]. 中华外科杂志, 2015, 53(4): 249-252. YE D W, ZHU Y. Epidemiology of prostate cancer in China: an overview and clinical implication[J]. Chin J Surg, 2015, 53(4): 249-252.
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28.
ZHENG R S, SUN K X, ZHANG S W, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28.
World Cancer Report: Cancer Research for Cancer Prevention [EB/OL].(2020-06-20). https://publications.iarc.fr/586
Latest global cancer data: cancer burden rises to 19.3 million new cases and 10.0 million cancer deaths in 2020[EB/OL].(2020-12-15). https://www.iarc.fr/faq/latest-global-cancerdata-2020-qa/
韩苏军, 张思维, 陈万青, 等. 中国前列腺癌发病现状和流行趋势分析[J]. 临床肿瘤学杂志, 2013, 18(4): 330-334.
HAN S J, ZHANG S W, CHEN W Q, et al. Analysis of the status and trends of prostate cancer incidence in China[J]. Chin Clin Oncol, 2013, 18(4): 330-334.
马春光, 叶定伟, 李长岭, 等. 前列腺癌的流行病学特征及晚期一线内分泌治疗分析[J]. 中华外科杂志, 2008, 46(12): 921-925.
MA C G, YE D W, LI C L, et al. Epidemiology of prostate cancer from three centers and analysis of the first-fine hormonal therapy for the advanced disease[J]. Chin J Surg, 2008, 46(12): 921-925.
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33.
ZHU Y, MO M, WEI Y, et al. Epidemiology and genomics of prostate cancer in Asian men[J]. Nat Rev Urol, 2021. Online ahead of print.
ANDRIOLE G L, CRAWFORD E D, GRUBB R L, et al. Mortality results from a randomized prostate-cancer screening trial[J]. N Engl J Med, 2009, 360(13): 1310-1319.
ANDRIOLE G L, CRAWFORD E D, GRUBB R L 3rd, et al. Prostate cancer screening in the randomized prostate, lung, colorectal, and ovarian cancer screening trial: mortality results after 13 years of follow-up[J]. J Natl Cancer Inst, 2012, 104(2): 125-132.
PINSKY P F, MILLER E, PROROK P, et al. Extended follow-up for prostate cancer incidence and mortality among participants in the prostate, lung, colorectal and ovarian randomized cancer screening trial[J]. BJU Int, 2019, 123(5): 854-860.
SCHRÖDER F H, HUGOSSON J, ROOBOL M J, et al. Screening and prostate-cancer mortality in a randomized European study[J]. N Engl J Med, 2009, 360(13): 13201328.
SCHRÖDER F H, HUGOSSON J, ROOBOL M J, et al. Prostate-cancer mortality at 11 years of follow-up[J]. N Engl J Med, 2012, 366(11): 981-990.
SCHRÖDER F H, HUGOSSON J, ROOBOL M J, et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer(ERSPC) at 13 years of follow-up[J]. Lancet, 2014, 384(9959): 20272035.
HUGOSSON J, ROOBOL M J, MÅNSSON M, et al. A 16-year follow-up of the European Randomized Study of Screening for Prostate Cancer[J]. Eur Urol, 2019, 76(1): 43-51.
WELCH H G, ALBERTSEN P C. Reconsidering prostate cancer mortality-the future of PSA screening[J]. N Engl J Med, 2020, 382(16): 1557-1563.
LOEB S, CARTER H B, BERNDT S I, et al. Complications after prostate biopsy: data from SEER-Medicare[J]. J Urol, 2011, 186(5): 1830-1834.
LOEB S, VAN DEN HEUVEL S, ZHU X, et al. Infectious complications and hospital admissions after prostate biopsy in a European randomized trial[J]. Eur Urol, 2012, 61(6): 11101114.
NAM R K, SASKIN R, LEE Y, et al. Increasing hospital admission rates for urological complications after transrectal ultrasound guided prostate biopsy[J]. J Urol, 2013, 189(1 Suppl): S12-S18.
顾成元, 秦晓健, 黄永墙, 等. 中国部分省市前列腺癌精准筛查初步结果分析[J]. 中华医学杂志, 2019, 99(42): 32923297.
GU C Y, QIN X J, HUANG Y Q, et al. The prostate cancer precision screening program: a preliminary report after recruitment of 2159 men[J]. Natl Med J China, 2019, 99(42): 3292-3297.
梁 静, 赵晓智, 时静妍, 等. 南京地区前列腺癌筛查 “PSA-mpMRI-靶向穿刺”模式的初步探索[J]. 中华男科学杂志, 2019, 25(9): 815-822. LIANG J, ZHAO X Z, SHI J Y, et al. Combination of serum PSA assay, multi-parametric MRI and targeted prostate biopsy for prostate cancer screening in Nanjing[J]. Natl J Androl, 2019, 25(9): 815-822.
CARLSSON S, ASSEL M, ULMERT D, et al. Screening for prostate cancer starting at age 50-54 years. a population-based cohort study[J]. Eur Urol, 2017, 71(1): 46-52.
WU T T, HUANG J K. The clinical usefulness of prostatespecific antigen(PSA) level and age-specific PSA reference ranges for detecting prostate cancer in Chinese[J]. Urol Int, 2004, 72(3): 208-211.
GROSSMAN D C, CURRY S J, OWEBS D X, et al. Screening for prostate cancer: US Preventive Services Task Force recommendation statement[J]. JAMA, 2018, 319(18): 19011913.
CARTER H B, ALBERTSEN P C, BARRY M J, et al. Early detection of prostate cancer: AUA Guideline[J]. J Urol, 2013, 190(2): 419-426.
MOTTET N, VAN DEN BERGH RCN, BRIERS E, et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer-2020 Update. Part 1: screening, diagnosis, and local treatment with curative intent [J]. Eur Urol, 2021, 79(2):243262.
CARLSSON S, ASSEL M, SJOBERG D, et al. Influence of blood prostate-specific antigen levels at age 60 on benefits and harms of prostate cancer screening: population based cohort study [J]. BMJ, 2014, 348: g2296.
LICHTENSTEIN P, HOLM N V, VERKASALO P K, et al. Environmental and heritable factors in the causation of cancer: analyses of cohorts of twins from Sweden, Denmark, and Finland [J]. N Engl J Med, 2000, 343(2): 78-85.
ALBRIGHT F, STEPHENSON R A, AGARWAL N, et al. Prostate cancer risk prediction based on complete prostate cancer family history[J]. Prostate, 2015, 75(4): 390-398.
PRITCHARD C C, MATEO J, WALSH M F, et al. Inherited DNA-repair gene mutations in men with metastatic prostate cancer[J]. N Engl J Med, 2016, 375(5): 443-453.
WEI Y, WU J L, GU W J, et al. Germline DNA repair gene mutation landscape in Chinese prostate cancer patients[J]. Eur Urol, 2019, 76(3): 280-283.
CASTRO E, GOH C, OLMOS D, et al. Germline BRCA mutations are associated with higher risk of nodal involvement, distant metastasis, and poor survival outcomes in prostate cancer [J]. J Clin Oncol, 2013, 31(14): 1748-1757.
LEONGAMORNLERT D, SAUNDERS E, DADAEV T, et al. Frequent germline deleterious mutations in DNA repair genes in familial prostate cancer cases are associated with advanced disease[J]. Br J Cancer, 2014, 110(6): 1663-1672.
PAGE E C, BANCROFT E K, BROOK M N, et al. Interim results from the IMPACT study: evidence for prostate-specific antigen screening in BRCA2 mutation carriers[J]. Eur Urol, 2019, 76(6): 831-842.
MANO R, TAMIR S, KEDAR I, et al. Malignant abnormalities in male BRCA mutation carriers: results from a prospectively screened cohort[J]. JAMA Oncol, 2018, 4(6): 872-874.
李冬冬, 郭 威, 郭轶斌, 等. 居住地距最近医疗机构的距离对居民就医行为的影响[J]. 中国卫生统计, 2020, 37(2): 269-271.
LI D D, GUO W, GUO Y B, et al. The influence of the distance from the place of residence to the nearest medical institution on residents’ medical treatment behavior[J]. Chin J Heal Stat, 2020, 37(2): 269-271.