免疫检查点抑制剂治疗非小细胞肺癌的真实世界研究进展
免疫检查点抑制剂治疗非小细胞肺癌的真实世界研究进展
黄陈军 朱蔚友 林玉 朱陵君
( 江苏省人民医院)
摘要
目前,已有多种免疫检查点抑制剂(immune checkpoint inhibitor,ICI)基于随机对照临床试验(randomized controlled trial,RCT)获批用于治疗晚期非小细胞肺癌(non-small cell lung cancer,NSCLC),为晚期NSCLC患者带来新的希望。但RCT结果的适用性受限于严格的入组标准和特定临床环境,而真实世界研究可以整合真实世界数据,进行较长时间的临床观察和随访,其产生的证据与RCT产生的证据互补。ICI已在全球多个国家和地区上市数年,积累了一定的真实世界用药经验。本文将回顾近年来ICI用于治疗NSCLC患者的大型扩大用药项目和多中心回顾性研究中的主要有效性和安全性结果,以及在特殊人群中的用药经验,以期为中国临床用药提供参考。
前言
在所有癌症中, 肺癌的发病和死亡病例数高居首位。我国肺癌的发病率和死亡率均高于全球平均水平[1-2]。肺癌患者中非小细胞肺癌(non-small cell lung cancer, NSCLC)占80%~85%[3]。大多数NSCLC患者在诊断时已处于ⅢB~Ⅳ期, 预后不佳且疾病负担沉重[4-5]。缺乏特效药物的驱动基因阴性患者在标准化疗后的中位生存时间不足1年[6-7]。晚期NSCLC患者存在巨大的尚未满足的治疗需求, 尤其是老年等特殊人群的治疗选择则更为有限[8]。
以免疫检查点抑制剂(immune checkpoint inhibi-tor, ICI)为代表的新型免疫治疗药物为这些患者带来新的希望。基于大型随机对照临床试验(randomized controlled trial, RCT)结果, 已有3种ICI-纳武利尤单抗、帕博利珠单抗和阿替利珠单抗获批用于治疗晚期NSCLC。但RCT数据的适用性有限, 真实世界研究(real-world study, RWS)获得的数据有利于观察药物在更广泛人群中的使用情况。ICI已在国外上市近5年, 积累了一定的真实世界数据。本文拟对现有ICI用于NSCLC患者的RWS进行综述, 尤其关注大型扩大用药项目(expanded access program, EAP)和多中心回顾性研究对RCT结果的验证, 以及在不同特殊人群中的用药经验。
01
RWS与RCT的人群和用药差异
RCT的局限性包括严格入组与排除标准可导致试验人群对目标人群的代表性不佳、采用标准干预与临床实践用药不完全一致、有限的样本量和较短的随访时间导致对罕见不良事件观测不足等, 其研究结论在外推于实际临床应用时面临挑战[9]。而反映患者在真实医疗环境下实施具体医疗干预后最终临床结果的真实世界证据(real-world evidence, RWE)可在RCT的基础上提供辅助和补充。
与ICI治疗NSCLC的关键RCT相比, 大多数较大规模RWS中纳入患者的年龄较大, 美国东部肿瘤协作组(ECOG)体能状态≥2分、有中枢神经系统(cen-tral nervous system, CNS)转移、既往接受过二线以上治疗的患者较多(表 1)[10-19]。Yoo等[20]研究显示, 接受纳武利尤单抗或帕博利珠单抗临床常规治疗的NSCLC患者中, 因既往治疗史、组织学诊断、体能评分、疾病转移、合并症和合并用药等原因不符合RCT纳入标准的比例高达67.9%~69.9%。Harvey等[21]利用美国临床肿瘤学会(ASCO) CancerLinQ数据库进行的分析显示, 真实世界原始队列中有47.7%的患者不符合RCT传统纳入标准中脑转移、既往/并发癌症和肾功能标准中的一项或多项。
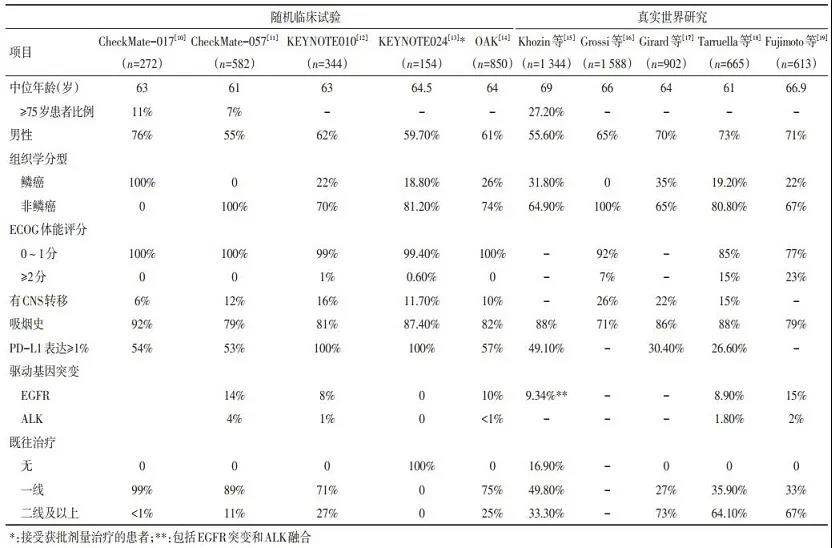
RCT与RWS在用药情况方面也存在一定差异。在关键RCT中, 患者接受ICI治疗的中位用药次数为6~10.5次[10-11, 13], 而RWS中略少(4~8次)[16, 22-25], 可能与临床实践中接受治疗患者的体能状态相对较差、既往接受过多线治疗有关, RWS无法保障追踪到患者所有治疗记录的局限性也有一定影响。在临床实践中, 患者联用其他抗癌药物、跨治疗线使用同种ICI, 或使用多种ICI序贯治疗的情况更为复杂, 在ICI治疗进展后的用药也多种多样。与RCT相比, RWS更有利于观察后续用药的影响[26]。
02
RWS中NSCLC患者接受ICI治疗的有效性
2.1 总体有效性和预测因素
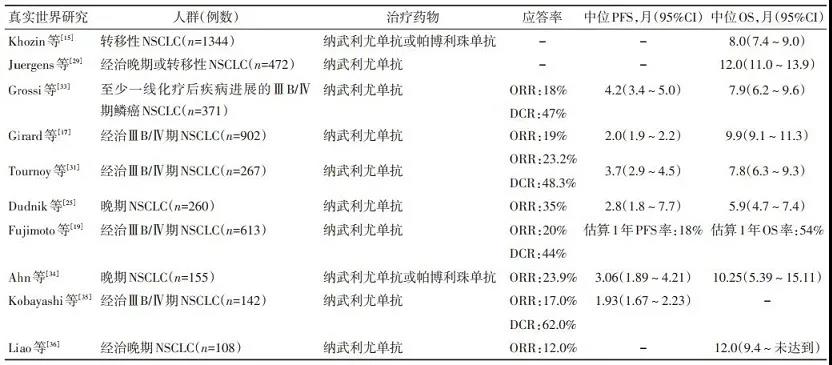
尽管存在上述差异, 但目前RWS中观察到的总体有效性与RCT结果相似。例如Allan等[27]的研究显示, 30例接受纳武利尤单抗二线治疗的亚裔(主要为华人, 其中30%的患者≥75岁)患者中位总生存(overall survival, OS)为12.7个月, 1年OS率为52%, 与在中国开展的Ⅲ期CheckMate-078研究结果相似(中位OS为12.0个月, 1年OS率为50%)。总体而言, 以欧美患者为主的RWS中位OS为5.9~12.3个月[15-18, 25, 28-33], 亚洲患者中位OS为10.25~12.7个月[19, 27, 34-37]。主要RWS中的有效性结果如表 2所示。RWS报告的治疗应答和生存结局与关键RCT结果相似, 验证了ICI在晚期NSCLC患者人群中的有效性。
RWS中报告的预后预测因素主要包括体能状态、驱动基因突变等。不同研究中关于远处转移、吸烟史等因素预测意义的结论并不统一。
2.2 特殊人群有效性
2.2.1 老年患者 老年患者的免疫系统随年龄增长会出现各种衰退性改变, 而且常由于合并症等原因导致抗肿瘤治疗选择有限, 因此尤其值得关注。大多数RCT中纳入的老年患者(>75岁)较少, 难以得出对特定年龄组疗效的肯定结论[38-39]。真实世界数据有助于在上述问题上提供补充。
在不同RWS中, ≥75岁患者的OS与 < 75岁患者相当或略短, 老年患者的客观缓解率(objective responserate, ORR)和疾病控制率(disease control rate, DCR)与年轻患者相似或略高[29, 33, 40]。考虑到老年患者因癌症以外原因死亡风险较高, 这些结果并不令人意外。Sabatier等[41]的研究显示, 既往接受过多线治疗可能影响老年患者ICI治疗后的生存获益, 仅接受过一线治疗的老年患者OS较长, 但该结果受多方面影响, 例如经过多次治疗的患者体能降低。这些复杂因素的相互关系尚待进一步探讨。
2.2.2 体能状态较差患者 在RWS中, ECOG≥2分患者接受ICI治疗后的OS通常不如0~1分患者(3~7个月vs.9~12个月), 多变量分析显示体能状态是预后不佳的孤立预测因素[17, 25, 29, 31]。这些结果基本符合CheckMate-153[42]、CheckMate-171[43]等探索性临床试验中对体能状态不佳患者的观察结果。ECOG≥ 2分晚期NSCLC患者尚无理想的治疗选择, 该人群中有无其他治疗获益的预测因素尚待进一步探索。由于大多数情况下患者的体能状态与接受的系统治疗线数相关, 尽早应用ICI治疗可能有利于达到更好的疗效。
2.2.3 CNS转移患者 现有程序性死亡分子1(pro-grammed death-1, PD-1)或程序性死亡分子配体1(programmed death ligand-1, PD-L1)抗体均为大分子蛋白, 通常无法透过血脑屏障, 但可通过激活免疫细胞发挥作用。外周免疫细胞可以通过脉络丛和脑脊液进入CNS, 而且肿瘤可能破坏血脑屏障, 使免疫细胞和大分子更容易透过[44]。
多项RWS显示, 临床实践中接受ICI治疗的NSCLC CNS转移患者可能有潜在获益。一些小型研究显示, 伴CNS转移的晚期NSCLC患者在纳武利尤单抗治疗后的颅内病灶客观缓解率为9%~10%[45-46]。较大规模RWS的亚组分析显示, 存在CNS转移的患者接受ICI治疗后的有效性与总人群相似[47]。Sone等[48]报告, 既往接受CNS病灶放疗的患者在ICI治疗后获得了较长的OS。与之相似, Song等[37]报告5例存在CNS转移的患者ICI治疗后ORR高达40%, OS为11~29个月, 研究者认为伴CNS转移患者既往接受放疗可能有助于提高抗原提呈和免疫细胞对抗肿瘤的效率并开放血脑屏障, 从而增强ICI在CNS中的治疗效果。此外, Patruni等[49]利用美国国家癌症数据库(NCDB)进行的回顾性分析显示, 接受ICI治疗是存在CNS转移NSCLC患者生存结局改善的孤立预测因素。
上述研究结果提示, 对于存在CNS转移, 尤其是接受过局部放疗的NSCLC患者, ICI是一种合理的后续系统治疗选择。
2.2.4 肝转移患者 一些回顾性研究[34, 50]显示, 存在肝转移的患者接受ICI治疗后缓解率和无进展生存(progression-free survival, PFS)不如无肝转移的患者。但肝转移与年龄较轻、体能较差和多处转移等基线因素相关, 多变量分析显示肝转移非孤立预测因素。上述结果提示ICI对于存在肝转移的NSCLC患者仍有一定的治疗效果, 临床实践中应充分考虑患者的基线情况后选择合适的方案。
2.2.5 驱动基因阳性患者 多项RWS显示, 携带EGFR突变/ALK重排的经治NSCLC患者接受ICI治疗的预后不如驱动基因阴性的患者[15, 19, 34-35, 51]。KRAS突变状态对ICI的疗效无明显影响[52-53]。一些针对EGFR突变/ALK重排患者的小型回顾性研究显示, 既往酪氨酸激酶抑制剂治疗时间(>1年)[54], 以及肿瘤微环境中的免疫状态(CD4+T细胞和Foxp3阳性细胞密度较高)[55]与ICI治疗后患者PFS相关, 提示虽然此类患者ICI治疗的总体疗效不佳, 但仍有部分患者可在ICI治疗中获益。不同突变对ICI疗效的影响机制和预测意义尚待进一步探索。
2.2.6 合并自身免疫病患者 合并自身免疫病的肿瘤患者并不少见, 但通常被ICI治疗的RCT排除在外。Khozin等[56]报告, 对CancerLinQ数据库进行分析显示, 在2 402例接受任何ICI治疗的晚期NSCLC患者中的531例(22%)存在自身免疫病。有无自身免疫病患者的中位OS无显著性差异, 分别为11.5个月和12.8个月(P=0.130), 其他临床结局也相似。
2.3 临床实践中疗效相关问题
2.3.1 "假性进展" 在RWS中, ICI治疗后先出现疾病进展表现, 而后肿瘤退缩的"假性进展"情况鲜有发生, 占所有接受ICI治疗患者中的2%~3%[57-58]。出现假性进展患者的OS长于出现典型进展的患者, 与达到疾病缓解的患者相当[58]。Crinò等[59]报告65例根据实体瘤疗效评价标准(RECIST)判断为疾病进展的NSCLC鳞癌患者继续接受纳武利尤单抗治疗, 其中26例后续肿瘤缩小或病灶稳定, 该人群的ORR为8%, DCR为40%, 中位OS为10个月。Ricciuti等[60]的研究显示, 进展后继续治疗的NSCLC患者OS长于未继续治疗的患者(17.8个月vs.3.7个月, P < 0.000 1), 多变量分析显示首次出现进展时停用纳武利尤单抗与生存时间较短相关。
因此, 虽然临床实践中的NSCLC患者接受ICI治疗后假性进展少见, 但对于怀疑假性进展的患者, 不应仅基于RECIST判断的疾病进展而停药, 必要时可参考iRECIST、免疫相关疗效评价标准(irRC)等肿瘤特异性免疫应答标准综合判断。
2.3.2 ICI治疗停药患者的后续治疗和生存结局 Schvartsman等[61]报告的小规模回顾性研究显示, 纳武利尤单抗二线治疗失败后的NSCLC患者后续接受多西他赛等挽救性单药化疗, 可达到较高的应答率(39%), 与相同人群一线化疗时37%的ORR相近。Yano等[62]报告, 26例NSCLC患者因疾病进展或不良事件停用纳武利尤单抗后再接受化疗或TKI治疗, ORR可达34.6%, 进展后生存时间为12.6个月。NSCLC患者ICI进展后挽救治疗药物的选择和临床获益值得进一步评估。
2.3.3 合并用药的影响 微生物菌群可影响人体的抗肿瘤免疫应答, 因此有研究探讨了合用抗生素对ICI疗效的影响。Kaderbhai等[63]报告, 在首次纳武利尤单抗给药前3个月内或治疗期间接受过抗生素治疗的NSCLC患者的ORR与无抗生素暴露患者相似(26.7% vs.22.0%), 中位PFS也无显著性差异。而Hakozaki等[64]的研究得出的结论略有不同, 该研究显示纳武利尤单抗治疗前接受抗生素治疗的NSCLC患者临床结局不如未接受抗生素治疗的患者(中位PFS:1.2个月vs.4.4个月, 中位OS:8.8个月vs.未达到; 均P < 0.05), 但多变量分析显示既往抗生素治疗情况并非PFS的孤立预测因素。合并抗生素治疗对ICI疗效的影响尚待进一步评估。
03
RWS中NSCLC患者接受ICI治疗的安全性
3.1 总体安全性
RWS中治疗相关不良事件(treatment-related ad-verse event, TRAE)发生率为29%~44.5%, ≥3级TRAE发生率为6%~20.9%[16-19, 30-31, 33, 36]; 免疫相关不良事件(immune-related adverse event, irAE)发生率为12.2%~38.1%, ≥3级irAE发生率为1.4%~5.16%[28, 30, 34]。RWS中不良事件发生率略低于RCT中观察到的结果, 可能在一定程度上受真实世界环境中不良事件报告不足或对irAE识别能力不足等影响。
一些RWS显示, 在临床实践中接受ICI治疗的NSCLC患者部分特定irAE的发生率可能高于RCT结果, 例如甲状腺功能减低、垂体炎和血液irAE[65-67], 在治疗过程中应重视监测上述不良反应, 尽早识别并进行合理的管理。
3.2 特殊人群安全性
3.2.1 老年患者 现有证据显示老年患者接受ICI治疗的安全性和耐受性与总人群相似。2015年7月至2016年9月, 法国药物警戒网络报告的280例irAE中, 91例(35.2%)发生于老年患者, 老年和较年轻患者的irAE发生率和发生模式总体相似[41]。Grossi等[33]报告, < 65岁、65~75岁和≥75岁患者的TRAE发生率相当(所有级别:32% vs.28% vs.29%, 3~4级:3% vs.9% vs.3%), 因TRAE停药比例均较低(4%~5%)。在Gomes等[40]开展的前瞻性研究中, ≥70岁和45~69岁NSCLC患者接受ICI治疗后3~4级irAE的发生率也无显著性差异, 共病评分或老年综合评估结果等因素与irAE的发生均无明显相关性。
3.2.2 自身免疫病患者 Khozin等[56]的研究显示, 存在自身免疫病且接受ICI治疗的晚期NSCLC患者irAE发生率略高于无自身免疫病的患者(27.1% vs.26.0%), 尤其是内分泌(4.9% vs.3.2%)、胃肠道(8.9% vs.7.6%)、血液(3.8% vs.2.4%)和一般irAE(10.4% vs.8.3%), 提示应注意监测该患者人群。自身免疫病对irAE的影响尚待进一步研究。
3.2.3 既存肺纤维化和间质性肺病患者 在接受PD-1抑制剂治疗的患者中, 免疫相关肺炎是一种相对常见且可能威胁生命的irAE。不同RWS中报告的免疫相关肺炎或呼吸系统irAE发生率为0.9%~14.6%[17-19, 25, 28, 30-31, 33-36, 68-69]。Yamaguchi等[69]报告, 基线肺纤维化评分≥1分患者治疗相关肺炎的发生率高于0分患者(35.1% vs.5.8%), 多因素回归分析显示纤维化评分≥1分是发生PD-1抑制剂治疗相关肺炎的孤立危险因素。Kanai等[70]报告, 存在间质性肺病(interstitial lung disease, ILD)的NSCLC患者接受纳武利尤单抗治疗后所有级别(31% vs.12%)和严重(19% vs.5%)免疫相关肺炎的发生率均高于无ILD患者, 但无患者因免疫相关肺炎死亡, 两组中均有50%的患者随时间推移肺炎情况好转。上述研究结果提示, 既存肺纤维化和ILD的患者在PD-1抑制剂治疗期间发生免疫相关肺炎的风险升高, 需谨慎处理, 大多数患者经糖皮质激素和/或免疫抑制剂等治疗后症状可以改善。
3.2.4 CNS转移患者 存在CNS转移的NSCLC患者接受ICI治疗的安全性可接受。Gauvain等[45]报告43例存在CNS转移的NSCLC患者接受纳武利尤单抗治疗后, 5例发生神经系统不良事件, 包括1例4级短暂性脑缺血发作和1例3级神经功能缺损, 两例患者均无需停药。Geier等[46]报告在77例存在CNS转移的患者中, 无患者发生神经系统不良事件。
3.2.5 脏器功能不全患者 基线脏器功能不全的恶性肿瘤患者大多被排除在RCT之外, 而这些患者的抗肿瘤治疗选择非常有限。Kanz等[71]报告, 27例基线存在肾脏、肝脏、心脏功能不全的恶性肿瘤(包括肾细胞癌、黑色素瘤、NSCLC、小细胞肺癌和尿路上皮癌)患者在ICI治疗后, 8例患者(30%)因脏器功能恶化需要住院或延迟给药, 2例发生3级irAE(肝炎和结肠炎)。其中大多数患者的器官功能恶化与治疗无关, 且在支持性治疗后好转。上述结果显示基线存在脏器功能障碍的患者可以考虑ICI治疗, 但需加强临床监测。
04
总结和展望
自证据分级的概念提出以来, 在药物治疗研究领域普遍认为RWS的证据等级低于严格设计的RCT。但RWS的优势在于可以解答一些RCT中难以设计的问题。对真实世界数据进行规范分析产生的RWE可成为RCT证据的有力补充, 综合形成完整而严谨的证据链, 提高药物研发、监管和使用的科学性和效率。因此, 应将RWS和RCT产生的证据视为不同的证据类型, 为临床问题提供参考。
现有的RWS验证了RCT中观察到的ICI用于NSCLC患者的有效性和安全性, 并在老年、体能状态不佳、存在不同部位转移、合并其他疾病等特殊患者人群的治疗效果和安全性, 以及"假性进展"、后续治疗等一系列临床关注的问题上提供了补充。此外, 从RWS中可以看到, 目前仍存在许多值得进一步研究的领域, 例如其他特殊人群的治疗效果、irAE对ICI疗效的影响机制, 以及在免疫治疗优势不明显的患者中进一步寻找可靠的生物标志物以明确相对优势的人群等。如何进一步利用不同的数据来源开展高质量的RWS, 形成更可靠的RWE也是未来研究的方向。目前ICI在我国大陆上市时间较短, 尚缺乏用于NSCLC的真实世界数据, 未来期待看到更多中国的RWS结果和高质量的RWE, 为中国临床医生的实际用药提供参考。
End
参考文献:
[1]
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492
[2]
Ferlay J, Ervik M, Lam F, etal. Global cancer observatory: cancer today[EB/OL].[2020-02-21].https://gco.iarc.fr/today.
[3]
中华人民共和国国家卫生健康委员会.原发性肺癌诊疗规范(2018年版)[EB/OL].[2020-02-21].http://www.nhc.gov.cn/ewebeditor/uploadfile/2018/12/20181225162102206.docx.
[4]
Jiang T, Ren S, Li X, et al. The changing diagnostic pathway for lung cancer patients in Shanghai, China[J]. Eur J Cancer, 2017, 84: 168-172. DOI:10.1016/j.ejca.2017.07.036
[5]
Goldstraw P, Chansky K, Crowley J, et al. The IASLC lung cancer staging project:Proposals for revision of the TNM stage groupings in the forthcoming(8th) edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009
[6]
Jackman DM, Miller VA, Cioffredi LA, et al. Impact of epidermal growth factor receptor and KRAS mutations on clinical outcomes in previously untreated non-small cell lung cancer patients:results of an online tumor registry of clinical trials[J]. Clin Cancer Res, 2009, 15(16): 5267-5273. DOI:10.1158/1078-0432.CCR-09-0888
[7]
Gridelli C, Ciardiello F, Gallo C, et al. First-line erlotinib followed by second-line cisplatin-gemcitabine chemotherapy in advanced nonsmall cell lung cancer:the TORCH randomized trial[J]. J Clin Oncol, 2012, 30(24): 3002-3011. DOI:10.1200/JCO.2011.41.2056
[8]
Gomes F, Tay R, Chiramel J, et al. The role of targeted agents and immunotherapy in older patients with non-small cell lung cancer[J]. Drugs Aging, 2018, 35(9): 819-834. DOI:10.1007/s40266-018-0573-z
[9]
国家药品监督管理局药品审评中心.真实世界证据支持药物研发的基本考虑(征求意见稿)[EB/OL].[2020-02-21]. http://www.cde.org.cn/attachmentout.do?mothed=list&id=7877.
[10]
Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamouscell non-smallcell lung cancer[J]. N Engl J Med, 2015, 373(2): 123-135. DOI:10.1056/NEJMoa1504627
[11]
Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small cell lung cancer[J]. N Engl J Med, 2015, 373(17): 1627-1639. DOI:10.1056/NEJMoa1507643
[12]
Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1 positive, advanced non-smallcell lung cancer(KEYNOTE-010):a randomised controlled trial[J]. Lancet, 2016, 387(10027): 1540-1550. DOI:10.1016/S0140-6736(15)01281-7
[13]
Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1 positive non-small cell lung cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. DOI:10.1056/NEJMoa1606774
[14]
Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small cell lung cancer(OAK):a phase 3, open-label, multicentre randomised controlled trial[J]. Lancet, 2017, 389(10066): 255-265. DOI:10.1016/S0140-6736(16)32517-X
[15]
Khozin S, Carson KR, Zhi J, et al. Real-world outcomes of patients with metastatic non-small cell lung cancer treated with programmed cell death protein 1 inhibitors in the year following U.S. regulatory approval[J]. Oncologist, 2019, 24(5): 648-656. DOI:10.1634/theoncologist.2018-0307
[16]
Grossi F, Crinò L, Delmonte A, et al. Real-world results in non-squamous non-small cell lung cancer patients:Italian nivolumab expanded access program[J]. J Thorac Oncol, 2017, 12(11 Suppl 2): S1841.
[17]
Girard N, Valette A, Cadranel J, et al. IFCT-1502 CLINIVO:Real-life experience with nivolumab in 600 patients(pts) with advanced nonsmall cell lung cancer(NSCLC):efficacy and safety of nivolumab and post-nivolumab treatment in the French expanded access program(EAP)[J]. Ann Oncol, 2017, 28(Suppl 5): 463.
[18]
Tarruella MM, Campilo J, Béjar JFG, et al. GECP 1605/NIVEX TRIAL nivolumab in the real world:Spanish expanded access program experience in pretreated advanced NSCLC[J]. Ann Oncol, 2018, 29(Suppl 8): viii531.
[19]
Fujimoto D, Yoshioka H, Kataoka Y, et al. Efficacy and safety of nivolumab in previously treated patients with non-small cell lung cancer:A multicenter retrospective cohort study[J]. Lung Cancer, 2018, 119: 14-20. DOI:10.1016/j.lungcan.2018.02.017
[20]
Yoo SH, Keam B, Kim M, et al. Generalization and representativeness of phase Ⅲ immune checkpoint blockade trials in non-small cell lung cancer[J]. Thorac Cancer, 2018, 9(6): 736-744. DOI:10.1111/1759-7714.12641
[21]
Harvey RD, Rubinstein WS, Ison G, et al. Impact of broadening clinical trial eligibility criteria for advanced non-small cell lung cancer patients:Real-world analysis[J]. J Clin Oncol, 2019, 37(suppl 15): 108.
[22]
Ksienski D, Wai ES, Croteau N, et al. Efficacy of nivolumab and pembrolizumab in patients with advanced non-small cell lung cancer needing treatment interruption because of adverse events:A retrospective multicenter analysis[J]. Clin Lung Cancer, 2019, 20(1): e97-e106.
[23]
Montana M, Garcia ME, Ausias N, et al. Efficacy and safety of nivolumab in patients with non-small cell lung cancer:a retrospective study in clinical practice[J]. J Chemother, 2019, 31(2): 90-94. DOI:10.1080/1120009X.2018.1551753
[24]
Schouten RD, Muller M, de Gooijer CJ, et al. Real life experience with nivolumab for the treatment of non-small cell lung carcinoma:data from the expanded access program and routine clinical care in a tertiary cancer centre-The Netherlands Cancer Institute[J]. Lung Cancer, 2018, 126: 210-216. DOI:10.1016/j.lungcan.2017.11.012
[25]
Dudnik E, Moskovitz M, Daher S, et al. Effectiveness and safety of nivolumab in advanced non-small cell lung cancer:The real-life data[J]. Lung Cancer, 2018, 126: 217-223. DOI:10.1016/j.lungcan.2017.11.015
[26]
Khozin S, Abernethy AP, Nussbaum NC, et al. Characteristics of realworld metastatic non-small cell lung cancer patients treated with nivolumab and pembrolizumab during the year following approval[J]. Oncologist, 2018, 23(3): 328-336. DOI:10.1634/theoncologist.2017-0353
[27]
Allan V, Mungul A, Diaz J, et al. Real world effectiveness of nivolumab in Asian patients in the United States Flatiron Health database[J]. Value Health, 2019, 22(Suppl 2): S57.
[28]
Khozin S, Zhi J, Jun M, et al. Real-world characteristics and outcomes of patients with advanced non-small cell lung cancer(aNSCLC) receiving immune checkpoint inhibitor[J]. J Clin Oncol, 2019, 37(Suppl 15): 9110.
[29]
Juergens RA, Mariano C, Jolivet J, et al. Real-world benefit of nivolumab in a Canadian non-small cell lung cancer cohort[J]. Curr Oncol, 2018, 25(6): 384-392.
[30]
Dixmier A, Debieuvre D, Raspaud C, et al. EVIDENS:An observational study of nivolumab-treated patients in advanced non-small cell lung cancer(NSCLC) in a real-world setting:Initial results on 1394 patients[J]. Ann Oncol, 2018, 29(Suppl 8): viii532.
[31]
Tournoy KG, Thomeer M, Germonpré P, et al. Does nivolumab for progressed metastatic lung cancer fulfill its promises? An efficacy and safety analysis in 20 general hospitals[J]. Lung Cancer, 2018, 115: 49-55. DOI:10.1016/j.lungcan.2017.11.008
[32]
Afzal MZ, Dragnev K, Shirai K. A tertiary care cancer center experience with carboplatin and pemetrexed in combination with pembrolizumab in comparison with carboplatin and pemetrexed alone in non-squamous non-small cell lung cancer[J]. J Thorac Dis, 2018, 10(6): 3575-3584. DOI:10.21037/jtd.2018.06.08
[33]
Grossi F, Crinò L, Logroscino A, et al. Use of nivolumab in elderly patients with advanced squamous non-small cell lung cancer:results from the Italian cohort of an expanded access programme[J]. Eur J Cancer, 2018, 100: 126-134. DOI:10.1016/j.ejca.2018.05.015
[34]
Ahn BC, Pyo KH, Xin CF, et al. Comprehensive analysis of the characteristics and treatment outcomes of patients with non-small cell lung cancer treated with anti-PD-1 therapy in real-world practice[J]. J Cancer Res Clin Oncol, 2019, 145(6): 1613-1623. DOI:10.1007/s00432-019-02899-y
[35]
Kobayashi K, Nakachi I, Naoki K, et al. Real-world efficacy and safety of nivolumab for advanced non-small cell lung cancer:a retrospective multicenter analysis[J]. Clin Lung Cancer, 2018, 19(3): e349-e358.
[36]
Liao B, Chiang C, Chen P, et al. Efficacy and safety of nivolumab therapy for advanced NSCLC in the expanded access named patient program in Taiwan[J]. J Thorac Oncol, 2017, 12(11 Suppl 2): S2425-S2426.
[37]
Song P, Zhang J, Shang C, et al. Real-world evidence and clinical observations of the treatment of advanced non-small cell lung cancer with PD-1/PD-L1 inhibitors[J]. Sci Rep, 2019, 9(1): 4278.
[38]
Sgambato A, Casaluce F, Gridelli C. The role of checkpoint inhibitors immunotherapy in advanced non-small cell lung cancer in the elderly[J]. Expert Opin Biol Ther, 2017, 17(5): 565-571. DOI:10.1080/14712598.2017.1294157
[39]
Lee CK, Man J, Lord S, et al. Clinical and molecular characteristics associated with survival among patients treated with checkpoint inhibitors for advanced non-small cell lung carcinoma:asystematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(2): 210-216. DOI:10.1001/jamaoncol.2017.4427
[40]
Gomes F, Woolley S, Califano R, et al. Elderly lung cancer patients on immunotherapy:Preliminary results from the ELDERS study[J]. J Thorac Oncol, 2017, 12(11 Suppl 2): S1841-S1842.
[41]
Sabatier R, Nicolas E, Paciencia M, et al. Nivolumab in routine practice for older patients with advanced or metastatic non-small cell lung cancer[J]. J Geriatr Oncol, 2018, 9(5): 494-500. DOI:10.1016/j.jgo.2018.02.011
[42]
Spigel DR, McCleod M, Jotte RM, et al. Safety, Efficacy, and patientreported health-related quality of life and symptom burden with nivolumab in patients with advanced non-small cell lung cancer, including patients aged 70 years or older or with poor performance status(CheckMate 153)[J]. J Thorac Oncol, 2019, 14(9): 1628-1639. DOI:10.1016/j.jtho.2019.05.010
[43]
Felip E, Ardizzoni A, Ciuleanu T, et al. CheckMate 171:A phase 2 trial of nivolumab in patients with previously treated advanced squamous non-small cell lung cancer, including ECOG PS 2 and elderly populations[J]. Eur J Cancer, 2020, 127: 160-172. DOI:10.1016/j.ejca.2019.11.019
[44]
Cheng H, Perez-Soler R. Leptomeningeal metastases in non-small cell lung cancer[J]. Lancet Oncol, 2018, 19(1): e43-e55. DOI:10.1016/S1470-2045(17)30689-7
[45]
Gauvain C, Vauléon E, Chouaid C, et al. Intracerebral efficacy and tolerance of nivolumab in non-small cell lung cancer patients with brain metastases[J]. Lung Cancer, 2018, 116: 62-66. DOI:10.1016/j.lungcan.2017.12.008
[46]
Geier M, Descourt R, Corre R, et al. Real-life intracerebral efficacy of nivolumab in non-small cell lung cancer patients with brain metastases[J]. J Thorac Oncol, 2018, 13(Suppl 10): S384-S385.
[47]
Crinò L, Bronte G, Bidoli P, et al. Nivolumab and brain metastases in patients with advanced non-squamous non-small cell lung cancer[J]. Lung Cancer, 2019, 129: 35-40. DOI:10.1016/j.lungcan.2018.12.025
[48]
Sone T, Kasahara K, Shirasaki H, et al. A retrospective analysis of the efficacy of immune checkpoint inhibitors(ICIs) to advanced non-small cell cancer(NSCLC) patients(pts) with central nerve system(CNS) metastasis[J]. J Clin Oncol, 2018, 36(Suppl 15): e21042.
[49]
Patruni S, Khattab A, Abel S, et al. A comparative analysis of survival in patients with non-small cell lung cancer with brain metastases receiving intracranial radiation with and without immunotherapy[J]. J Clin Oncol, 2019, 37(Suppl 15): 9025.
[50]
Shiroyama T, Suzuki H, Tamiya M, et al. Clinical characteristics of liver metastasis in nivolumab-treated patients with non-small cell lung cancer[J]. Anticancer Res, 2018, 38(8): 4723-4729. DOI:10.21873/anticanres.12779
[51]
Lin SY, Yang CY, Liao BC, et al. Tumor PD-L1 Expression and clinical outcomes in advanced-stage non-small cell lung cancer patients treated with nivolumab or pembrolizumab:Real-world data in Taiwan[J]. J Cancer, 2018, 9(10): 1813-1820. DOI:10.7150/jca.24985
[52]
Passiglia F, Cappuzzo F, Alabiso O, et al. Efficacy of nivolumab in pretreated non-small cell lung cancer patients harbouring KRAS mutations[J]. Br J Cancer, 2019, 120(1): 57-62.
[53]
Mazieres J, Drilon A, Lusque A, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations:results from the IMMUNOTARGET registry[J]. Ann Oncol, 2019, 30(8): 1321-1328. DOI:10.1093/annonc/mdz167
[54]
Sakamoto H, Tanaka H, Shiratori T, et al. The efficacy of immune checkpoint inhibitors in advanced non-small cell lung cancer harboring driver mutations[J]. Mol Clin Oncol, 2019, 10(6): 610-614.
[55]
Sato M, Watanabe S, Tanaka H, et al. Retrospective analysis of antitumor effects and biomarkers for nivolumab in NSCLC patients with EGFR mutations[J]. PLoS One, 2019, 14(4): e0215292. DOI:10.1371/journal.pone.0215292
[56]
Khozin S, Walker MS, Jun M, et al. Real-world outcomes of patients with advanced non-small cell lung cancer(aNSCLC) and autoimmune disease(AD) receiving immune checkpoint inhibitors(ICIs)[J]. J Clin Oncol, 2019, 37(Suppl 15): 110.
[57]
Katz SI, Hammer M, Bagley SJ, et al. Radiologic Pseudoprogression during anti-PD-1 therapy for advanced non-small cell lung cancer[J]. J Thorac Oncol, 2018, 13(7): 978-986. DOI:10.1016/j.jtho.2018.04.010
[58]
Fujimoto D, Yoshioka H, Kataoka Y, et al. Pseudoprogression in previously treated patients with non-small cell lung cancer who received nivolumab monotherapy[J]. J Thorac Oncol, 2019, 14(3): 468-474. DOI:10.1016/j.jtho.2018.10.167
[59]
Crinò L, Bidoli P, Delmonte A, et al. Italian cohort of nivolumab expanded access program in squamous non-small cell lung cancer:Results from a real-world population[J]. Oncologist, 2019, 24(11): e1165-e1171.
[60]
Ricciuti B, Genova C, Bassanelli M, et al. Safety and efficacy of nivolumab in patients with advanced non-small cell lung cancer treated beyond progression[J]. Clin Lung Cancer, 2019, 20(3): 178-185.
[61]
Schvartsman G, Peng SA, Bis G, et al. Response rates to single-agent chemotherapy after exposure to immune checkpoint inhibitors in advanced non-small cell lung cancer[J]. Lung Cancer, 2017, 112: 90-95. DOI:10.1016/j.lungcan.2017.07.034
[62]
Yano Y, Kurebe H, Edahiro R, et al. Post-progression survival after cessation of treatment with nivolumab for advanced non-small cell lung cancer:A retrospective study[J]. PLoS One, 2018, 13(8): e0203070. DOI:10.1371/journal.pone.0203070
[63]
Kaderbhai C, Richard C, Fumet JD, et al. Antibiotic use does not appear to influence response to nivolumab[J]. Anticancer Res, 2017, 37(6): 3195-3200.
[64]
Hakozaki T, Okuma Y, Omori M, et al. Impact of prior antibiotic use on the efficacy of nivolumab for non-small cell lung cancer[J]. Oncol Lett, 2019, 17(3): 2946-2952.
[65]
Cathcart-Rake EJ, Sangaralingham L, Shah N, et al. Immunotherapyrelated toxicities:more common than originally reported[J]. ? J Clin Oncol, 2018, 36(Suppl 34): 184.
[66]
Campredon P, Mouly C, Lusque A, et al. Incidence of thyroid dysfunctions during treatment with nivolumab for non-small cell lung cancer:Retrospective study of 105 patients[J]. Presse Med, 2019, 48(4): e199-e207. DOI:10.1016/j.lpm.2018.10.019
[67]
Delanoy N, Michot JM, Comont T, et al. Haematological immune-related adverse events induced by anti-PD-1 or anti-PD-L1 immunotherapy:a descriptive observational study[J]. Lancet Haematol, 2019, 6(1): e48-e57. DOI:10.1016/S2352-3026(18)30175-3
[68]
Naqash AR, Owen DH, Ricciuti B, et al. Immune pneumonitis-related treatment discontinuations and outcomes in metastatic non-small cell lung cancer treated with nivolumab:A pooled analysis from a multiinstitutional international collaboration[J]. J Clin Oncol, 2019, 37(Suppl 8): 118.
[69]
Yamaguchi T, Shimizu J, Hasegawa T, et al. Pre-existing pulmonary fibrosis is a risk factor for anti-PD-1-related pneumonitis in patients with non-small cell lung cancer:A retrospective analysis[J]. Lung Cancer, 2018, 125: 212-217. DOI:10.1016/j.lungcan.2018.10.001
[70]
Kanai O, Kim YH, Demura Y, et al. Efficacy and safety of nivolumab in non-small cell lung cancer with preexisting interstitial lung disease[J]. Thorac Cancer, 2018, 9(7): 847-855. DOI:10.1111/1759-7714.12759
[71]
Kanz BA, Pollack MH, Johnpulle R, et al. Safety and efficacy of anti-PD-1 in patients with baseline cardiac, renal, or hepatic dysfunction[J]. J Immunother Cancer, 2016, 4: 60. DOI:10.1186/s40425-016-0166-5