速速收藏!结直肠癌患者免疫治疗专家共识(中文版)发布!
结直肠癌患者免疫治疗专家共识
王峰 1,王梓贤 1,陈功 1,骆卉妍 1,张东生 1,邱妙珍 1,王德深 1, 潘志忠 2,沈琳 3,李进 4,张苏展 5,徐瑞华 1
1中山大学肿瘤防治中心肿瘤内科,华南肿瘤学国家重点实验室,肿瘤医学协同创新中心,广州,510060;
2 中山大学肿瘤防治中心结直肠外科,华南肿瘤学国家重点实验室,肿瘤医学协同创新中心,广州,510060;
3 北京大学肿瘤医院消化肿瘤内科,北京,100142;
4 同济大学附属上海市东方医院肿瘤内科,上海,200120;
5 浙江大学医学院附属第二医院肿瘤外科,浙江,310009
通讯作者:徐瑞华,E-mail:xurh@sysucc.org.cn
背景
在过去的数十年里,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs) 在多个瘤种取得成功。目前,免疫治疗已经成为结肠直肠癌(colorectal cancer, CRC)治疗领域的研究热点[1,2]。
研究表明,对于错配修复缺陷(mismatch repair-deficient, dMMR)或微卫星高度不稳定(microsatellite instability-high, MSI-H)的转移性结直肠癌(metastatic colorectal cancer, mCRC)患者而言,单独阻滞程序性细胞死亡蛋白-1(programmed cell death protein-1 PD-1)或联合使用抗细胞毒性T淋巴细胞相关蛋白(anti-cytotoxic T-lymphocyte-associated protein 4, anti-CTLA-4)的治疗均能够实现持久响应[3-6]。
然而,在患者亚组中检测出dMMR/MSI-H 状态的最佳诊断方法和以抗PD-1为基础的最佳治疗方式依然存在争议。此外,大多数转移性结直肠癌病例为非错配修复缺陷(mismatch repair-proficient, pMMR)或微卫星稳定(microsatellite stable, MSS)状态,通常无法从ICIs中获益[3,7],由此也催生许多研究探寻在这一患者亚组中有效的联合治疗方案。不仅如此,在非转移性结直肠癌患者中也已经开始开展基于抗 PD-1的治疗探索,并取得了一些鼓舞人心的初步证据[8]。
2020 年 6 月 16 日在中国广州,来自中国临床肿瘤学会结直肠癌委员会的肿瘤内科医生和外科医生们在座谈会上针对结直肠癌患者的免疫治疗进行了一系列探讨。在此总结出几项专家共识,并列出了相关的临床证据(表 1),以此指导如何在真实世界中使用 ICIs 治疗结直肠癌患者。
表 1 结直肠癌患者抗 PD-1 治疗专家共识
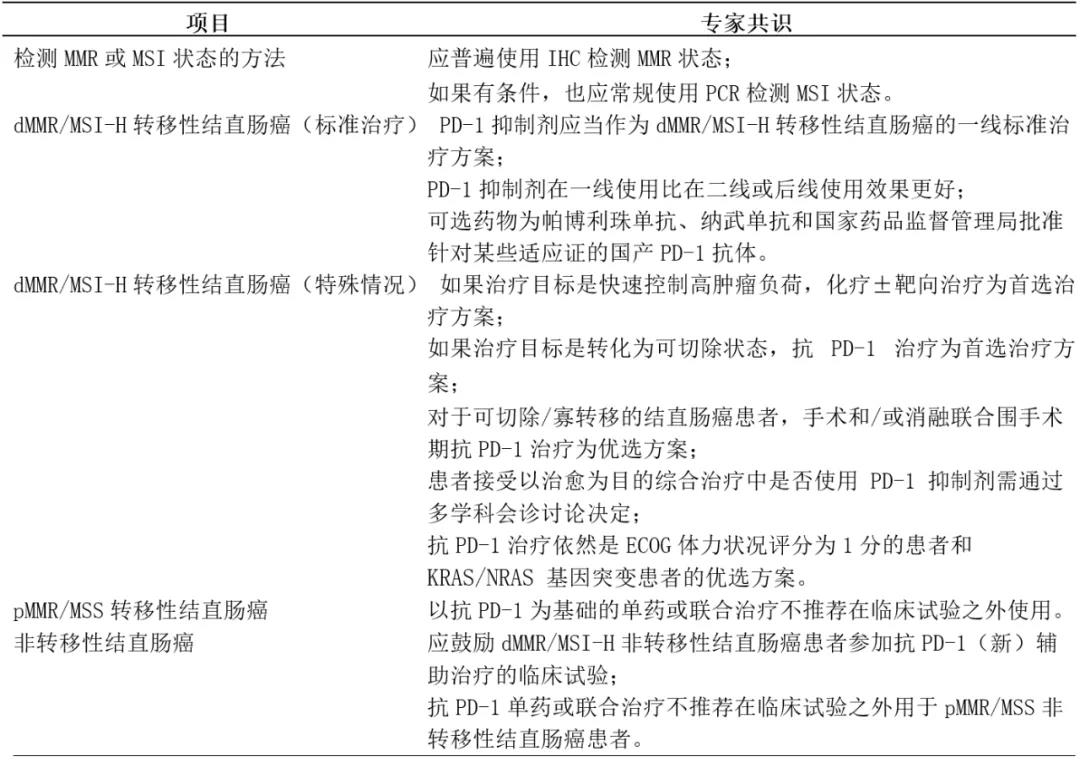
1 检测 MMR 或 MSI 状态的方法
在中国临床肿瘤学会结直肠癌委员会关于检测 dMMR/MSI-H 状态的最新的共识(2019年10月23日)中,讨论了三种潜在的选择方法:针对 MMR 蛋白的免疫组化(immunohistochemistry, IHC)、针对微卫星位点的多重荧光聚合酶链式反应(polymerase chain reaction, PCR)和基于MSI算法的二代测序(next-generation sequencing, NGS)——每种方法都有其优势和缺陷[9]。
另外,虽然IHC和PCR对于检测MMR/MSI状态通常有超过90%的一致性,但既往研究表明,dMMR/MSI-H的转移性结直肠癌对PD-1抑制剂的原发耐药很大程度上可以归因于对MMR/MSI状态的错误诊断,而且大部分误诊病例只使用了以上三种检测手段中的一种(一般是IHC或PCR)[10]。免疫组化由于其价格低廉且可操作性高被普遍用于检测MMR状态,而PCR也通常在拥有相应平台的机构中被常规用作检测MSI水平的方法。对于IHC和PCR结果不一致或怀疑对抗PD-1治疗存在原发性耐药的 dMMR/MSI-H的肿瘤,应考虑进行中心审查、遗传咨询或采用第三种诊断方法(即 NGS)。
2 抗 PD-1 治疗对于初治的 dMMR/MSI-H 转移性结直肠癌患者是标准治疗策略
最近,Ⅲ期随机临床试验KEYNOTE-177的第二次中期分析的结果显示[11],与对照组(即双药化疗±靶向治疗:FOLFOX或FOLFIRI±西妥昔单抗或贝伐珠单抗)相比,帕博利珠单抗作为一线治疗可显著提高 dMMR/MSI-H的转移性结直肠癌患者无进展生存(progression-free survival, PFS)期(中位 PFS期为16.5个月对 比8.2个月;HR为0.60;P=0.0002)。在不同年龄、性别、种族、地区、分期和 BRAF 状态的亚组中,帕博利珠单抗治疗组均较对照组显示出PFS优势。此外,帕博利珠单抗治疗组 3 度以上的不良事件发生率也明显低于对照组。
由于 KEYNOTE-177 的总体生存(overall survival, OS)数据(在高交叉率的背景下)还未公布,帕博利珠单抗是否可用于二线或后线治疗尚未明确。不过,帕博利珠单抗PFS曲线的尾端在2年后趋于稳定,且两年 PFS率高达48%[11],这表明很大一部分患者可能已经被帕博利珠单抗的初始治疗“治愈”了。进一步地,帕博利珠单抗的客观有效率(objective response rate, ORR)在一线治疗中(KEYNOTE-177: ORR=44%)明显比二线或后线的治疗数据高(KEYNOTE-164:ORR=33%)[4]。总的来说,会议成员一致同意PD-1抑制剂应作为 dMMR/MSI-H 转移性结直肠癌患者一线治疗的标准方案。
基于现有的证据,PD-1抑制剂用于前线治疗比用于二线或后线治疗能够取得更好的效果。在单臂研究CheckeMate142中纳武利尤单抗对 dMMR/MSI-H 的转移性结直肠癌显示出与帕博利珠单抗相似的疗效和耐受性。虽然帕博利珠单抗和纳武单抗均可在中国使用,但还没有PD-1抗体被国家药品监督管理局(National Medical Products Administration, NMPA)所批准用于转移性结直肠癌的治疗。因此,帕博利珠单抗、纳武单抗和国家药品监督管理局批准针对某些适应证的国产PD-1单抗均可以考虑作为 dMMR/MSI-H转移性结直肠癌患者的可选治疗策略。
CheckMate 142 研究显示[5],一线使用纳武利尤单抗联合伊匹木单抗较纳武单抗单药显著提升了ORR(55%对比 31%)并且毒性可控[4]。然而,目前中国还无法使用CTLA-4抑制剂,而且PD-1和CTLA-4双重阻断的安全性和有效性需要进一步研究确认以得出可靠的治疗建议。
3 为 dMMR/MSI-H 转移性结直肠癌抗 PD-1 治疗的真实世界实践制定个体化策略
虽然PD-1抑制剂很可能成为dMMR/MSI-H转移性结直肠癌患者的一线标准治疗方案,但在真实世界实践中,仍然需要对这部分患者制定个体化的 PD-1抑制剂使用策略。基于KEYNOTE-177研究的数据和其他相关的临床证据,我们总结了针对下列情况中优选治疗策略的专家共识。
3.1 以快速控制高肿瘤负荷为目标
虽然PD-1抑制剂在二线或后线治疗中起效较慢(中位起效时间从 2.8个月至 4.3个月不等)[3,4,6],KEYNOTE-177研究显示一线使用帕博利珠单抗对比化疗±靶向治疗可取得相似的中位起效时间(2.2个月对比2.1个月)[11]。但是,该研究中的PFS曲线显示,在随机分组后的前六个月,使用帕博利珠单抗治疗的患者趋于更短的PFS期,而疾病控制率也显著低于化疗±靶向治疗组(65%对比75%)[11]。因此,当治疗目标是快速控制高肿瘤负荷的时候,可以考虑采用化疗±靶向治疗作为首选治疗。根据肿瘤原发灶的位置和 RAS/BRAF状态推荐使用 ORR 较高的方案(例如左半、RAS/BRAF 野生型的肠癌采用双药化疗+西妥昔单抗治疗、RAS或BRAF基因突变的肠癌采用三药化疗+贝伐珠单抗治疗)。
此外,化疗±靶向治疗同期联合使用帕博利珠单抗目前由于欠缺相关有效数据并可能增加毒副作用,还不应被列为此种情况下的常规方案。抗PD-1 治疗可在初始的化疗±靶向治疗控制疾病以后再考虑引入。
3.2 治疗目标为转化疾病为可切除状态
目前,采用PD-1抑制剂转化疾病为可切除状态的数据非常有限,前不久公布的KEYNOTE-177研究的两组中只有约10%的患者接受以治愈为目的的手术。不过,帕博利珠单抗组的ORR明显高于化疗±靶向治疗组(44%比 33%),并且使用帕博利珠单抗可带来更大范围的肿瘤退缩。不仅如此,帕博利珠单抗比化疗±靶向治疗的患者耐受性更好,对那些有治愈机会的患者来说极具价值。所以,抗PD-1单药可以被考虑作为治疗目标是转化疾病为可切除状态的优选方式。这些患者抗PD-1治疗的持续时间应通过多学科讨论来确定。另外,化疗±靶向治 疗同期使用帕博利珠单抗目前由于欠缺相关有效数据并可能增加毒副作用,还不应被列为此种情况下的常规方案。
3.3 针对可切除/寡转移肿瘤
KEYNOTE-177 研究中关于对可切除/寡转移的结直肠癌患者采用帕博利珠 单抗对比化疗±靶向治疗的有效性数据有待公布。先前的随机性研究未显示出围手术期或辅助性 FOLFOX 方案化疗对未选择性微卫星状态的可切除/寡转移的结直肠癌患者可带来OS的提升[12-14],但是对于 dMMR/MSI-H 可切除/寡转移的结直肠癌患者使用新辅助或辅助化疗的价值尚未明确。正基于此,相比于化疗,手术和/或消融联合围手术期抗PD-1治疗可作为dMMR/MSI-H的可切除/寡转移肿瘤的结直肠癌患者的优选方案。这部分患者使用帕博利珠单抗的最佳治疗疗程尚不明确,需要通过多学科讨论来决定。
3.4 针对美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG) 体力状况评分为 1 分或 2 分的患者
之前研究结果表明,体力状况欠佳的患者难以从抗PD-1治疗中获益[15,16]。与此类似,KEYNOTE-177 研究显示,帕博利珠单抗无法给 ECOG 体力状况评分为1分的患者带来显著的PFS提升,而且排除了评分为 2分的患者[11]。不过, 帕博利珠单抗的3度及以上不良反应发生率相对较低,在评分为1分的患者中其 PFS 也与对照组相当(HR为0.84,95% CI:0.57-1.24)。因此,抗PD-1治疗作为ECOG状态评分为1分的患者的优选方案。ECOG 体力状况评分为2分的患者目前尚缺乏使用抗PD-1 治疗的证据;但是,对于肿瘤引起的体力状况较差的患者, 抗 PD-1 治疗可以考虑作为可选方案。
3.5 针对 KRAS/NRAS 基因突变的肿瘤
KEYNOTE-177的亚组分析显示帕博利珠单抗对于患有KRAS/NRAS基因突变肿瘤患者的疗效会下降[11]。然而,在研究队列中,有30%的患者 RAS状态未知,并且有KRAS/NRAS基因突变的患者数也相对较少(n=74),因此对于该结论还需进一步的研究加以证实。有趣的是,CheckMate142研究表明KRAS/NRAS基因突变的患者使用纳武单抗的 ORR明显比KRAS/NRAS野生型的患者低(27%比41%)[5],而 KEYNOTE-164研究则显示不同RAS状态患者的使用帕博利珠单抗的 ORR相近(RAS突变型对比RAS野生型为37%对比42%)[4]。考虑到帕 博利珠单抗相比于化疗±靶向治疗具有较好的安全性和相当的PFS,抗 PD-1治疗可作为KRAS/NRAS基因突变的患者亚群的优选治疗方案。
4 使用抗 PD-1 治疗 pMMR/MSS 转移性结直肠癌
众所周知,单药阻断PD-1在pMMR/MSS转移性结直肠癌患者中收效甚微 [3,7]。目前的研究主要聚焦两种提升抗PD-1治疗对pMMR/MSS转移性结直癌有效性的策略:一是确定能有效预测抗PD-1治疗疗效的生物标志物,二是通过联合治疗克服肿瘤对PD-1阻断的耐药现象。
基于 KEYNOTE-158 研究的数据,美国食品与药物监督管理局(FDA)最近加速批准了帕博利珠单抗用于治疗高肿瘤突变负荷(high tumor mutational burden, TMB-H,即 FoundationOne CDx 检测结果为 TMB≥10 mut/Mb)的晚期实体瘤[17,18]。但由于该研究未纳入 pMMR/MSS转移性结直肠癌,因此仍不清楚这一结果是否可应用于 pMMR/MSS转移性结直肠癌[17]。
有趣的是,最近一个单臂临床研究报道了一些转移性结直肠癌患者(经FoundationOne CDx检测 TMB≥9 mut/Mb。)使用帕博利珠单抗的ORR达到了11%(25/27MSS,2/27未明确)[19]。迄今为止,由于现存的全外显子测序技术和NGS检测中应用的生物信息学算法五花八门,似乎不太可能建立起一个统一的TMB阈值来指导PD-1抑制剂在结直肠癌患者中的使用,所以中国的NMPA仍没有批准任何检测TMB的技术。
总的来说,PD-1抑制剂目前不推荐在临床研究之外作为pMMR/MSS转移性结直肠癌患者的常规治疗手段。一些以抗PD-1为基础的联合治疗方案(比如纳武利尤单抗+瑞戈非尼)在单臂的Ⅰ/Ⅱ期临床研究中显示了治疗 pMMR/MSS 转移性结直肠癌的潜力[20,21],但还需要Ⅲ期随机对照实验的进一步证明。目前为止,只有两个相关的Ⅲ期研究报道了相关的疗效数据[22,23]。遗憾的是,这两个临床试验都显示阿替珠单抗无论是联合使用化疗+贝伐珠单抗或联合使用cobimetinib(一种MEK抑制剂)都无法提高对上述类型患者的疗效。
因此,除了研究人群以外,以抗PD-1为基础的单药治疗或联合治疗方案并不推荐常规应用于 pMMR/MSS 转移性结直肠癌患者。
5 抗 PD-1 治疗在非转移性结直肠癌中的应用
现有证据表明,dMMR/MSI-H非转移性结直肠癌患者从新辅助FOLFOX 方案治疗中获益有限(29%的患者出现进展)[24,25]。而新辅助放化疗在dMMR/MSI-H和 pMMR/MSS 的直肠癌中疗效相近(有效率均大于90%)[25]。
在单臂NICHE 研究中[8],新辅助治疗配合短期使用纳武利尤单抗+伊匹木单抗在Ⅰ~Ⅲ期dMMR 结肠癌患者中达到了100%的病理缓解率和 95%(19/20)的显著病理缓解率[6]。值得注意的是,即便是pMMR/MSS的患者使用该方案后也有27%(4/15)的病理缓解率以及 20%(3/15)的显著病理缓解率。此外,近期单臂VOLTAGE研究结果也显示[26],在新辅助放化疗后使用纳武利尤单抗给局部进展的MSI-H和 MSS的直肠癌患者分别带来60%(3/5)和 30%(11/37)的病理性完全缓解。对于接受根治性切除的Ⅱ期 dMMR/MSI-H的结肠癌患者使用5-氟尿嘧啶单药作为辅助治疗可能是不利的[27]。然而,奥沙利铂作为辅助治疗对于Ⅲ期结肠癌的疗效似乎并不受MMR/MSI状态的影响[28]。目前,关于 dMMR/MSI-H结直肠癌的抗PD-1辅助治疗的研究正在进行中(NCT02912559),结果令人期待。
总而言之,鼓励dMMR/MSI-H非转移性结直肠癌患者参与以抗PD-1为基 础的新辅助或辅助治疗临床研究中。对于患有基线可切除、局部进展的dMMR/MSI-H结肠癌患者,可以考虑将抗PD-1新辅助治疗(需注意 CTLA-4 抑制剂尚未在中国上市)作为合适的治疗选项。另外,以抗PD-1 为基础的单药或联合治疗不推荐在临床研究之外作为 pMMR/MSS 转移性结直肠癌患者的常规治疗手段。
鸣谢
感谢来自德国德累斯顿Carl Gustav Carus大学医院Gunnar Folprecht 医生和来自英国伦敦学院大学医院的Kai-Keen Shiu医生对建立此专家共识的建议和帮助。
参考文献
1. Ganesh K, Stadler ZK, Cercek A, et al. Immunotherapy in colorectal cancer: rationale, challenges and potential. Nat Rev Gastroenterol Hepatol 2019; 16(6): 361-75.
2. Wu T, Wu X, Wang HY, Chen L. Immune contexture defined by single cell technology for prognosis prediction and immunotherapy guidance in cancer. Cancer Commun(Lond) 2019; 39(1): 21.
3. Le DT, Uram JN, Wang H, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 2015; 372(26): 2509-20.
4. Le DT, Kim TW, Van Cutsem E, et al. Phase II Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: KEYNOTE-164. J Clin Oncol 2020; 38(1): 11-9.
5. Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer(CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017; 18(9): 1182-91.
6. Overman MJ, Lonardi S, Wong KYM, et al. Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol 2018; 36(8): 773-9.
7. Overman MJ, Kopetz S, Lonardi S, et al. Nivolumab ± ipilimumab treatment(Tx) efficacy, safety, and biomarkers in patients(Pts) with metastatic colorectal cancer(mCRC) with and without high microsatellite instability(MSI-H): results from the CheckMate-142 study. Ann Oncol 2016; 27: vi158.
8. Chalabi M, Fanchi LF, Dijkstra KK, et al. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med 2020; 26(4): 566-76.
9. Committee of Colorectal Cancer CSoCO, Genetics Group of The Committee of Colorectal Cancer CA-CA, Genetics Committee of The Committee of Colorectal Cancer CMDA. [Consensus on the detection of microsatellite instability in colorectal cancer and other related solid tumors in China]. Zhonghua Zhong Liu Za Zhi 2019; 41(10): 734-41.
10. Cohen R, Hain E, Buhard O, et al. Association of Primary Resistance to Immune Checkpoint Inhibitors in Metastatic Colorectal Cancer With Misdiagnosis of Microsatellite Instability or Mismatch Repair Deficiency Status. JAMA Oncol 2019; 5(4): 551-5.
11. Andre T, Shiu K-K, Kim TW, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high/mismatch repair deficient metastatic colorectal cancer: The phase 3 KEYNOTE-177 Study. J Clin Oncol 2020; 38(18_suppl): LBA4.
12. Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative FOLFOX4 chemotherapy and surgery versus surgery alone for resectable liver metastases from colorectal cancer(EORTC 40983): long-term results of a randomised, controlled, phase 3 trial. The Lancet Oncology 2013; 14(12): 1208-15.
13. Mitry E, Fields AL, Bleiberg H, et al. Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: a pooled analysis of two randomized trials. J Clin Oncol 2008; 26(30): 4906-11.
14. Kanemitsu Y, Shimizu Y, Mizusawa J, et al. A randomized phase II/III trial comparing hepatectomy followed by mFOLFOX6 with hepatectomy alone for liver metastasis from colorectal cancer: JCOG0603 study. J Clin Oncol 2020; 38(15_suppl): 4005.
15. Carbone DP, Reck M, Paz-Ares L, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer. N Engl J Med 2017; 376(25): 2415-26.
16. Dall'Olio FG, Maggio I, Massucci M, Mollica V, Fragomeno B, Ardizzoni A. ECOG performance status ≥2 as a prognostic factor in patients with advanced non small cell lung cancer treated with immune checkpoint inhibitors-A systematic review and meta-analysis of real world data. Lung Cancer 2020; 145: 95-104.
17. Marabelle A, Fakih MG, Lopez J, et al. Association of tumour mutational burden with outcomes in patients with select advanced solid tumours treated with pembrolizumab in KEYNOTE-158. Ann Oncol 2019; 30: v477-v8.
18. Yan L, Zhang W. Precision medicine becomes reality-tumor type-agnostic therapy. Cancer Commun(Lond) 2018; 38(1): 6.
19. Meiri E, Garrett-Mayer E, Halabi S, et al. Pembrolizumab(P) in patients(Pts) with colorectal cancer(CRC) with high tumor mutational burden(HTMB): Results from the Targeted Agent and Profiling Utilization Registry(TAPUR) Study. J Clin Oncol 2020; 38(4_suppl): 133-.
20. Fukuoka S, Hara H, Takahashi N, et al. Regorafenib Plus Nivolumab in Patients With Advanced Gastric or Colorectal Cancer: An Open-Label, Dose-Escalation, and Dose-Expansion Phase Ib Trial(REGONIVO, EPOC1603). J Clin Oncol 2020; 38(18): 2053-61.
21. Ghiringhelli F, Chibaudel B, Taieb J, et al. Durvalumab and tremelimumab in combination with FOLFOX in patients with RAS-mutated, microsatellite-stable, previously untreated metastatic colorectal cancer(MCRC): Results of the first intermediate analysis of the phase Ib/II MEDETREME trial. J Clin Oncol 2020; 38(15_suppl): 3006.
22. Grothey A, Tabernero J, Arnold D, et al. Fluoropyrimidine(FP) + bevacizumab(BEV) + atezolizumab vs FP/BEV in BRAFwt metastatic colorectal cancer(mCRC): Findings from Cohort 2 of MODUL – a multicentre, randomized trial of biomarker-driven maintenance treatment following first-line induction therapy. Ann Oncol 2018; 29: viii714-viii5.
23. Eng C, Kim TW, Bendell J, et al. Atezolizumab with or without cobimetinib versus regorafenib in previously treated metastatic colorectal cancer(IMblaze370): a multicentre, open-label, phase 3, randomised, controlled trial. The Lancet Oncology 2019; 20(6): 849-61.
24. Morton D. FOxTROT: An international randomised controlled trial in 1053 patients evaluating neoadjuvant chemotherapy(NAC) for colon cancer. On behalf of the FOxTROT Collaborative Group. Ann Oncol 2019; 30: v198.
25. Cercek A, Dos Santos Fernandes G, Roxburgh CS, et al. Mismatch Repair-Deficient Rectal Cancer and Resistance to Neoadjuvant Chemotherapy. Clin Cancer Res 2020.
26. Yuki S, Bando H, Tsukada Y, et al. Short-term results of VOLTAGE-A: Nivolumab monotherapy and subsequent radical surgery following preoperative chemoradiotherapy in patients with microsatellite stable and microsatellite instability-high locally advanced rectal cancer. J Clin Oncol 2020; 38(15_suppl): 4100.
27. Sargent DJ, Marsoni S, Monges G, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol 2010; 28(20): 3219-26.
28. Tougeron D, Mouillet G, Trouilloud I, et al. Efficacy of Adjuvant Chemotherapy in Colon Cancer With Microsatellite Instability: A Large Multicenter AGEO Study. J Natl Cancer Inst 2016; 108(7).