NADIM研究:新辅助免疫联合化疗,部分III期非小细胞肺癌可能变为可治愈性疾病
导读:IIIa期非小细胞肺癌(NSCLC)患者的治疗极具差异性,对于潜在可手术治疗的患者,术前给予新辅助治疗是标准的治疗策略,目前免疫治疗为基础的治疗策略包括免疫单药及免疫联合化疗等。近期,The Lancet Oncology杂志发表了NADIM研究的数据,《肿瘤瞭望》对研究全文进行编译,以飨读者。
研究背景
约20%的晚期非小细胞肺癌患者诊断为IIIa-N2期,尽管这部分患者可以接受手术治疗,但部分患者的预后仍然较差,三年OS率仅为30%,病理学缓解是新辅助治疗一个潜在的替代终点,但是考虑到患者完全病理学缓解率较低,化疗时仅为4%左右,目前多采用主要病理学缓解作为替代指标。2018年的一项研究发现,术前接受2个周期Nivolumab新辅助治疗可以获得45%的主要病理学缓解率,其中10%的患者出现完全病理学缓解;2020年的一项研究发现,在免疫治疗的基础上联合化疗作为新辅助治疗手段,主要病理学缓解率达到57%,其中,33%的患者出现完全病理学缓解。但是,两项研究都纳入了I期或II期的患者,我们提出假设,认为新辅助化疗联合免疫治疗可以提高IIIa期患者完全病理学缓解率,并最终提高这部分患者的治愈率。
研究设计
这是一项开放标签、多中心、单臂、II期临床研究,在西班牙18家医院进行。符合入组标准的患者为年龄≥18周,组织病理学或细胞病理学确认的、未经治疗的IIIa期非小细胞肺癌患者,患者PS评分0~1分,且不携带EGFR或ALK基因突变。既往有自身免疫性疾病、感染性疾病或接受免疫抑制剂治疗的患者不允许入组。所有患者接受诊断性活检以及病理分期评估,评估手段包括纵膈淋巴结活检及纵膈镜检查等,但并不要求患者必须为N2,患者入组前须接受PETCT以及增强脑CT或脑核磁的检查。符合入组标准的患者接受Nivolumab(为固定剂量360 mg)联合紫杉醇(200 mg/m2)及卡铂(AUC=5)治疗,治疗每21天一个周期,每周期第一天给药。接受三周期治疗后,手术在最后一个周期治疗结束后42~49天内进行。接受手术治疗后3~8周,患者接受Nivolumab术后维持治疗,前4个月治疗剂量修正为240 mg,每两周一次,随后再次修正为480 mg,每四周一次,直至满12个月。第1年每3个月随访一次,第2年每4个月随访一次,随后每6个月随访一次。Nivolumab不允许进行剂量调减。主要病理学缓解定义为残存肿瘤细胞数≤10%,若残存肿瘤细胞数>10%,定义为不完全病理学缓解,若患者不存在镜下可见的肿瘤细胞,则定义为完全病理学缓解。PD-L1检测基于22C3抗体进行。该研究的主要终点为24个月的PFS率,次要终点为3年的OS率、病理及影像缓解率、肿瘤降期率以及完全性手术切除率。
手术相关的终点定义为手术后30天内发生的死亡或相关并发症的发生率。安全性分析的截止时间为末次给药后100天内发生的不良反应。
研究结果
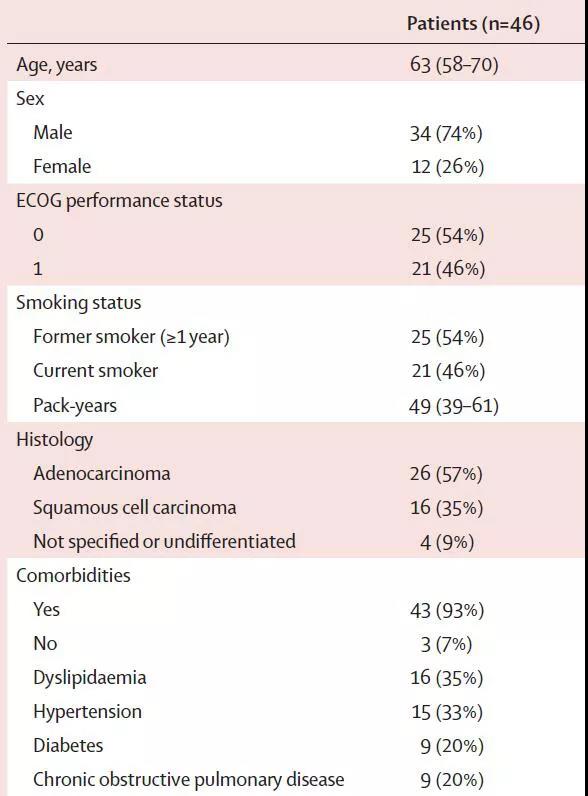
从2017年4月至2018年8月,共计51例患者符合入组标准,46例患者入组,所有患者均接受至少1周期的新辅助治疗,组成修订的ITT人群,89%的患者接受手术,所有的患者均为R0切除,没有手术相关的死亡出现。41例接受手术的患者,90%的患者至少接受了1周期的Nivolumab术后辅助治疗,因此纳入符合方案集。ITT人群的中位年龄为63周,54%的患者PS评分为1分,57%的患者为腺癌,35%为鳞癌(图1)。
中位辅助治疗时间为10.8个月,29%的患者出现术后相关的并发症,最常见的并发症为呼吸道感染、心律失常及支气管瘘。数据截止时间为2020年1月,85%的患者仍然存活或疾病未见复发。中位随访时间为24个月,在修订的ITT人群或符合方案集人群中,中位OS均未达到。
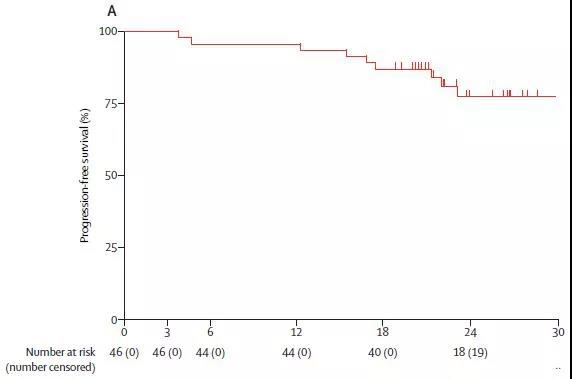
在修正的ITT人群中,12个月PFS率为95.7%,18个月PFS率为87%,24个月的PFS率为77.1%,符合方案集人群中,12个月、18个月和24个月的PFS率分别为100%、91.9%和87.9%(图2)。
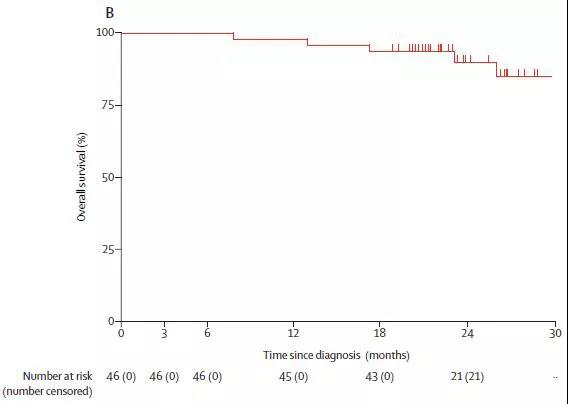
在修订的ITT人群中,12个月、18个月和24个月的OS率分别为97.8%、93.5%和89.9%,在符合方案集人群中,12个月、18个月和24个月的OS率分别为100%、97.3%和97.3%。接受术后辅助Nivolumab治疗的患者中,89%的患者无疾病复发的相关表现(图3)。
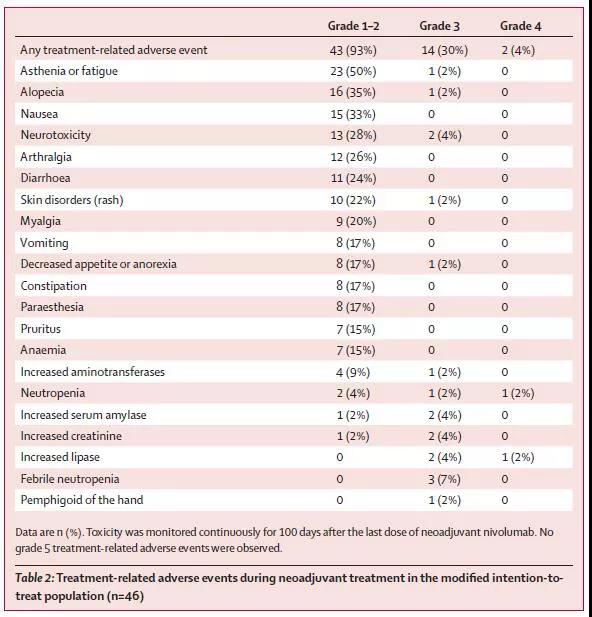
事后分析未发现临床病理特点和PFS的相关性,93%的患者出现新辅助治疗相关的不良反应,其中3度及以上不良反应发生率为30%,最常见的1~2度治疗相关不良反应为疲乏50%、恶心33%、中性粒细胞下降28%、腹泻24%、皮疹22%。最常见的3度及以上不良反应发生率包括脂肪酶升高7%,粒细胞下降7%等。在新辅助治疗阶段无不良反应导致治疗中止、手术延迟或死亡。然而,有7%的患者因不良反应导致未能接受Nivolumab的术后辅助治疗。事后分析未发现PFS和不良反应之间的相关性,在术后辅助治疗阶段,14%的患者因不良反应导致治疗终止(图4)。
基于RECIST 1.1标准,76%的患者出现客观反应,其中,4%的患者评估为CR,72%的患者评估为PR,24%的患者评估为SD,没有患者评估为PD;患者的主要病理学缓解率为83%,其中63%的患者达到病理学完全缓解,分别有33%和73%的影像学评估为SD或PR的患者,最后证实为病理学完全缓解。90%的患者出现疾病的降期,并未发现临床病理特点和病理学缓解率的相关性。
在事后分析中,15%的患者出现疾病进展,5%的患者死亡。34例评估为主要病理学缓解的患者,18个月PFS率为97.1%,24个月的PFS率为88.4%;而7例不完全病理学缓解的患者,18个月和24个月的PFS率均为57.1%,26例病理学完全缓解的患者18个月和24个月的PFS率均为96.2%。但PFS在不完全病理学缓解和完全病理学缓解的患者中无差异(P=0.52)。达到主要病理学缓解或完全病理学缓解的患者中,18个月和24个月的OS率均为100%,而不完全病理学缓解瘤的患者仅为85.7%,差异有统计学意义。
PD-L1≥1%的患者,12个月和18个月的PFS率分别为94.4%和75.8%。基于AUC曲线发现,PD-L1的最佳截断值为45%,此时预测主要病理学缓解的敏感性和特异性分别为65%和100%。29例患者拥有TMB的检测数据,未发现PFS和TMB有关系,9例患者携带与不良预后有关的基因,尤其是STK11、KEAP1及EGFR基因突变,并未发现这些基因突变与病理学缓解率有关,但是与较差的PFS有关,中位分别为21.4个月和未达到(P=0.027),研究同样未发现TMB水平与PD-L1的表达相关(P=0.38)。事后分析发现,携带STK11、KEAP1及EGFR基因突变联合较高的肿瘤突变负荷,可以识别可获得更长PFS的患者。
研究结论
这项研究发现,在Nivolumab治疗的基础上,进一步联合铂类药物为基础的化疗作为IIIa期患者的新辅助治疗手段是可行的。新辅助免疫联合化疗有可能将部分III期患者变为可治愈性疾病。
参考文献:
Provencio M et al. Lancet Oncol. 2020 Sep 24;S1470-2045(20)30453-8.
DOI: 10.1016/S1470-2045(20)30453-8.
文献来源:
https://pubmed.ncbi.nlm.nih.gov/32979984/
