范磊教授 Alexander研究I期结果解读
编者按:抗原嵌合T细胞(CAR-T)是继放化疗、靶向治疗后淋巴瘤、白血病领域革命性的新型治疗方式,而今年ESMO上公布的Alexander研究则进一步公布了关于复发难治性淋巴瘤中的治疗效果。
Phase I Alexander studyof AUTO3, the first CD19/22 dual targeting CAR.T cell, with pembrolizumab in patients with relapsed/refractory(r/r) DLBCL(AUTO3,Alexander研究:首个CD19/22双靶向CAR.T细胞疗法联合帕博利珠单抗治疗复发性/难治性(r/r)DLBCL患者的疗效)
背景
以CD19为靶点的CAR-T细胞疗法在r/r DLBCL患者中有效,但由于CD19缺失或PD-L上调经常导致的复发。在本项研究中,我们评估了AUTO3的安全性和有效性,这是一种靶向CD19/22的CAR-T疗法,PD-1阻断持续时间有限。
方法
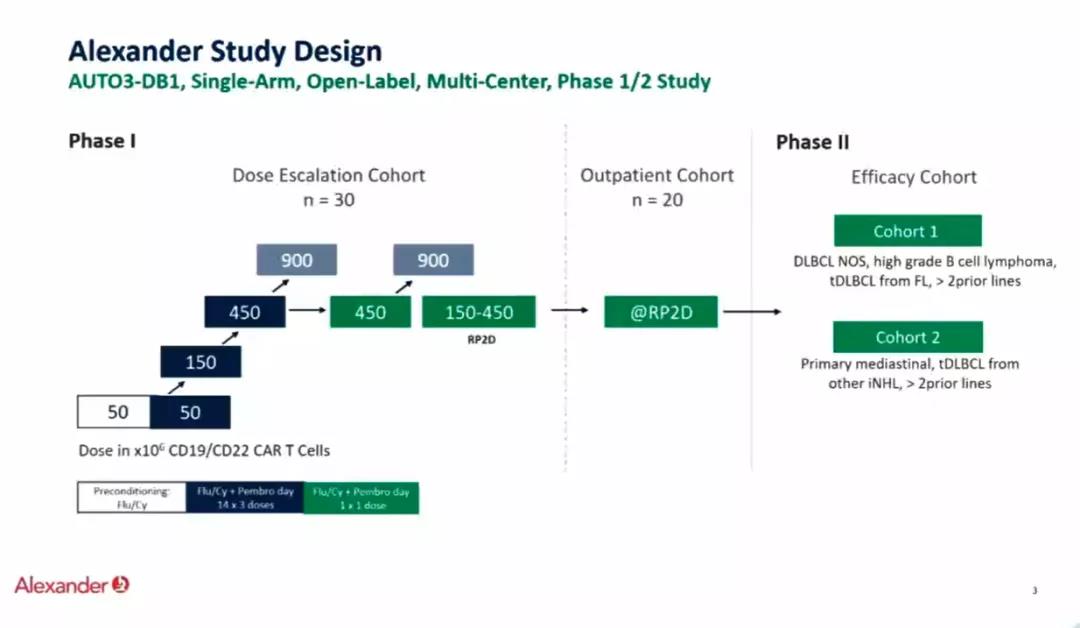
使用CliniMACS Prodigy以半自动和封闭工艺生产细胞产品。r/r DLBCL(NOS)或转化(tDLBCL)患者(≥18岁);ECOG < 2,器官功能充分的患者有资格参加研究。AUTO3前淋巴细胞耗竭为Flu/Cy。允许使用桥接治疗。探索的3个剂量水平为50、150和450 x 106 CAR T细胞。患者接受AUTO3单药治疗,或从D14开始接受3次帕博利珠单抗(pem)200 mg q 3w给药(方案A),或在D-1接受单次pem 200 mg给药(方案B)。主要终点是DLT和3-5级不良事件(AE)的频率,次要终点包括ORR、CRR和生物标志物。
结论
在给予大剂量下AUTO3(50 x 106)联合帕博丽珠单抗包括完全缓解患者无任何级别的CRS或NT。
点评
目前率先应用于临床的CAR-T-CD19在急性B淋巴细胞白血病(B-ALL)、弥漫大B细胞淋巴瘤(DLBCL)等复发难治患者取得非常显著疗效,其中B-ALL有效率(ORR)超过90%,并且大部分患者为完全缓解(CR)甚至MRD阴性;DLBCL的ORR在50%-70%,CR率在30-50%之间。但是目前CART治疗也存在部分问题:首先,近期疗效方面有部分病人临床效果欠佳,不能达到CR;其次,中远期疗效方面,治疗未见疗效尤其是未能达到完全缓解患者容易出现疾病的复发,中远期疗效有待提高;最后治疗相关毒副作用,尤其是肿瘤负荷较高患者更易出现严重CRS和CRES等,导致治疗相关副作用甚至死亡。
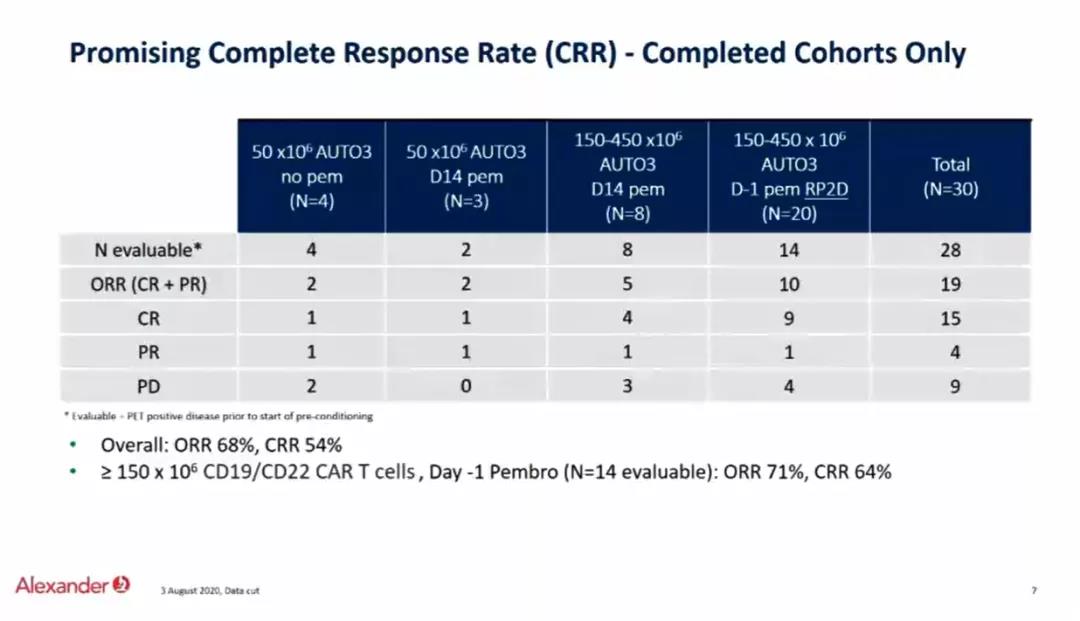
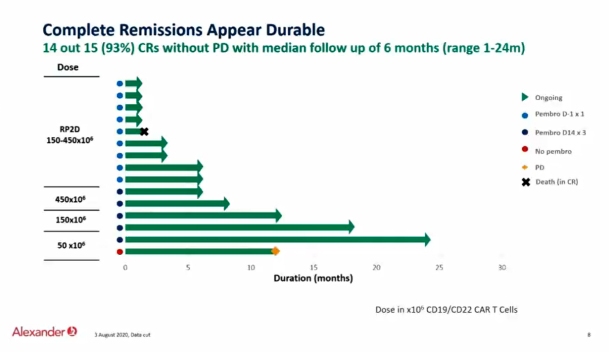
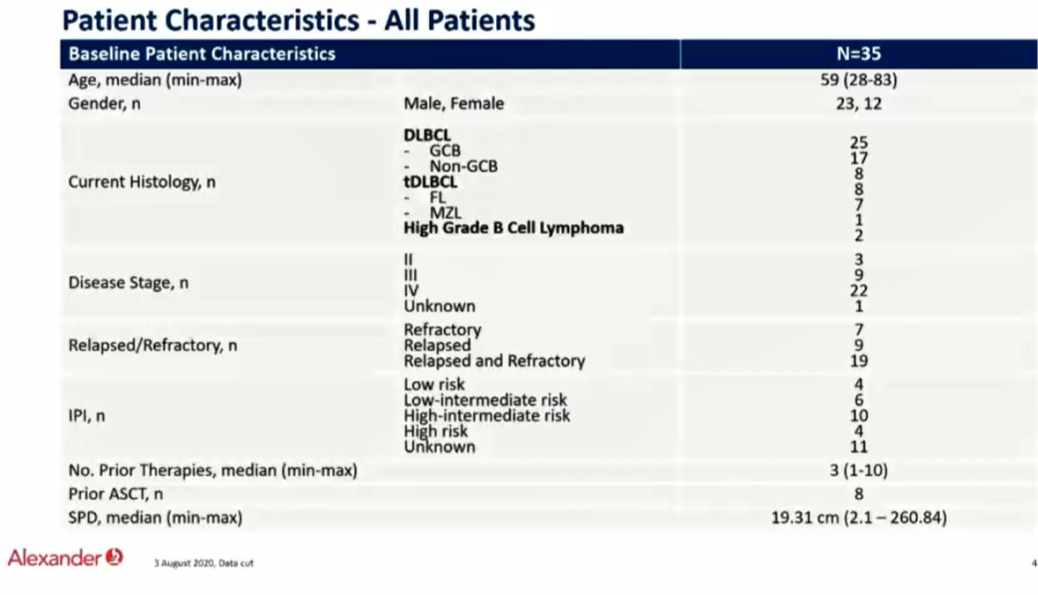
本次ESMO会议上的Alexander临床研究,使用了针对CD19-CD22的双靶点CART(AUTO3),并且结合PD1单抗pembrolizumab治疗复发难治DLBCL患者,本研究为I期临床研究,纳入18岁以上复发难治DLBCL和转化淋巴瘤患者,分为三个剂量组50、150和450 X106 CART细胞。患者分别单独输入CART细胞(CD19-CD22)、每三周一次的pembrolizumab 200mg(D14天开始,A组)和单一剂量pembrolizumab 200mg(D-1 B组)。一共23例患者入组并接受AUTO3细胞输注。中位年龄57,中位前续治疗3线,87%为难治性病变,发生率超过25%的≥3级治疗不良反应为中性粒细胞减少(87%)、血小板减少(57%)和贫血(48%)。严重不良反应大多数血液系统相关并且可逆。在16例剂量大于50 X106 CART细胞组,ORR为69%,CR为56%,所有CR患者中位随访3月。在8例B组病人中(单一剂量pembrolizumab 200mg D-1)ORR为75%,CR为63%。
CART细胞治疗作为革命性的治疗方式,在复发难治B细胞肿瘤患者取得了显著效果,但是仍然存在较大提升空间,目前CART细胞治疗主要方向是针对多个肿瘤靶点、改善和提升CART细胞功能、延长CART细胞在体内存留时间、降低肿瘤微环境对于CART细胞的影响,本次Alexander临床研究,结合双靶点CART(AUTO3)和PD1单抗,在传统CART的基础上提升治疗靶向性,同时降低肿瘤微环境对于CART细胞影响,从本研究公布的I期数据看,该策略治疗安全性较好,并且较高细胞剂量组疗效显著,但是由于入组患者较少,并且随访期较短,其他后续的临床数据公布。