中肿黄欣 蓝春燕教授团队JCO发文 为晚期 复发宫颈癌治疗带来新方案
宫颈癌是我国女性生殖系统的高发癌症,复发或转移后的预后很差,一线含铂治疗进展后,后续的治疗相当选择有限且疗效不佳,亟需开发新的治疗方法。中山大学附属肿瘤医院的黄欣、蓝春燕教授独辟蹊径,以阿帕替尼联合卡瑞利珠单抗用于晚期/复发宫颈癌二线及以上治疗,客观缓解率(ORR)高达55.6%,疾病控制率(DCR)82.2%,中位无进展生存期(PFS)8.8个月。该项Ⅱ期研究的初步结果早在2020年3月就入选了美国妇科肿瘤学会(SGO)年会的口头报告;10月15日,肿瘤学顶级期刊《临床肿瘤学杂志》(Journal of Clinical Oncology;JCO;影响因子32.985)在线发表了该研究的最终结果,充分体现了国际同行对该研究结果的高度认可。

研究方法
这是一项开放标签的单臂Ⅱ期研究,在中国的4个研究中心开展。
入组标准为:组织学证实的转移性、复发或持续性宫颈癌患者,既往至少接受过1线系统治疗后进展;有可测量病灶(根据RECIST 1.1);东部肿瘤协作组(ECOG)评分为0或1;心、肝、肾、骨髓和凝血功能良好。主要的排除标准为:未控制的高血压;先前用过阿帕替尼、抗PD-1/PD-L1或CTLA-4抗体;有自身免疫性疾病史或处于疾病活动期;活动性脑转移;活动性乙肝或丙肝。
治疗方案为卡瑞利珠单抗200mg静脉注射,q2w;阿帕替尼250m持续口服qd,4周为1周期。治疗直至疾病进展、出现不可接受的毒性或撤回知情同意,其中卡瑞利珠单抗最多用24个月。卡瑞利珠单抗不允许减量;在出现毒性且经支持治疗不能缓解时,允许阿帕替尼暂停用药或减量(最多减量2次)。第1次减量至250mg每日1次用2天停1天,再次减量至250mg隔日1次。阿帕替尼一旦减量,则以后不再加量。
疗效评估由研究者和影像科医生按RECIST 1.1进行,前10个周期(40周)每2周期(8周)评估一次,此后每3周期(12周)评估一次。肿瘤缓解必须在至少4周后重复评估确认。不良事件(AE)评估贯彻整个治疗期间及治疗终止后30天,严重的AE评估需延续至治疗终止后90天。
PD-L1阳性定义为CPS≥1。
主要终点为ORR,所有的缓解均经过二次评估确认。次要终点包括无进展生存(PFS)、总生存(OS)、缓解持续时间、疾病控制率(DCR)、安全性和耐受性。
研究采用Simon两阶段优化设计,17%的 ORR为无效假设,这是帕博利珠单抗在PD - 1阳性晚期宫颈癌的历史缓解率,预期的备择ORR为35%。第一阶段先入组16例患者,如果观察到3例以上缓解者,则进入第二阶段,继续入组28例患者。如在44例患者中观察到超过12例缓解者,则研究结果视为阳性。
ORR评估在意向性治疗(ITT)人群(定义为所有入组患者)和疗效评估人群(定义为接受了至少1剂研究治疗且至少进行了1次基线后肿瘤评估的患者)中进行。安全性评估在接受了至少1剂研究治疗的患者中进行(安全性人群)。
研究结果
疗效
从2019年1月21日至8月1日,共入组45例患者并给予了研究治疗,此45例构成ITT和安全性人群。其中3例(6.7%)患者在第一次基线后评估前终止治疗,1例由于靶病灶严重感染而无法评估,因此疗效评估人群包含41例患者。
入组患者的中位年龄51.0,57.8%的患者先前接受过针对复发或转移性疾病的≥2线化疗。10例(22.2%)接受过贝伐珠单抗。
数据截止时(2020年4月30日),中位随访时间为11.3个月。29例(64.4%)患者终止治疗,原因大多为疾病进展(n=19,2.2%)。
在第一阶段入组的16例患者中,8例患者获得确认的缓解,ORR超过了预先设定的界值,因此研究进入第二阶段。
ITT人群中,25例(55.6%)获得确认的客观缓解,其中2例(4.4%)完全缓解(CR),23例(51.1%)部分缓解(PR);DCR为82.2%(表1)。疗效评估人群的结果与之相似(表1)。疗效评估人群中,33例(80.5%)的患者靶病灶较基线时退缩。25例获得确认的客观缓解的患者中,达到缓解的中位时间为1.9个月,中位缓解持续时间尚未达到。这25例患者中,16例(64%)仍在持续缓解中,71.5%的缓解者持续缓解至少6个月,66.5%的缓解者持续缓解至少12个月。
表1. 肿瘤疗效评估结果
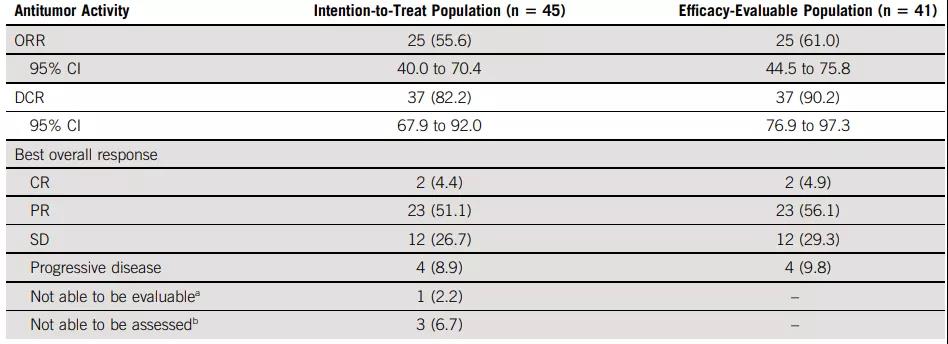
中位PFS 8.8个月,6个月的PFS率57.0%(图1)。中位OS未达到,9个月的OS率为69.2%(图2)。
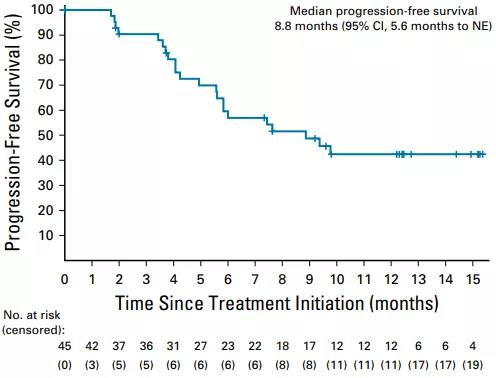
图1. PFS结果
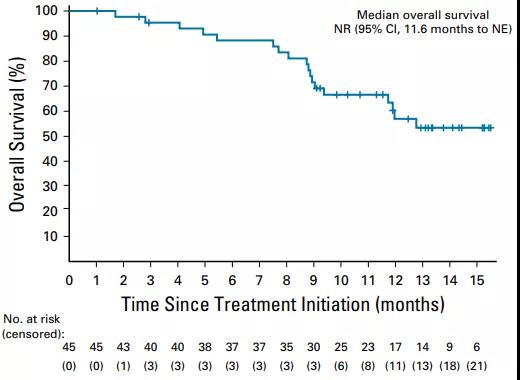
图2. OS结果
安全性和耐受性
治疗相关不良事件(AE)发生率为95.6%,其中3或4级发生率为71.1%,最常见的AE为高血压(24.4%)、贫血(20.0%)和乏力(15.6%)。无治疗相关性死亡发生。
45例患者中,44例(97.8%)接受了至少1个完整周期的阿帕替尼治疗;42例(93.3%)需要1次或以上暂停用药;33例(73.3%)需减量,其中4例(12.1%)需1次减量,29例(87.9%)需2次减量。
与卡瑞利珠单抗相关的潜在免疫相关AE发生率为33.3%。最常见的潜在免疫相关AE包括1~2级甲状腺功能减退(22.2%)和皮肤毛细血管内皮反应性增生(8.9%)。
事后分析
PD-L1阳性与PD-L1阴性患者的ORR无差别(69.0% vs 50.0%,P=0.281),但PD-L1阳性患者的PFS更长(图3)。鳞癌患者较腺癌患者的ORR更高(77.8% vs 28.6%),PFS也更长。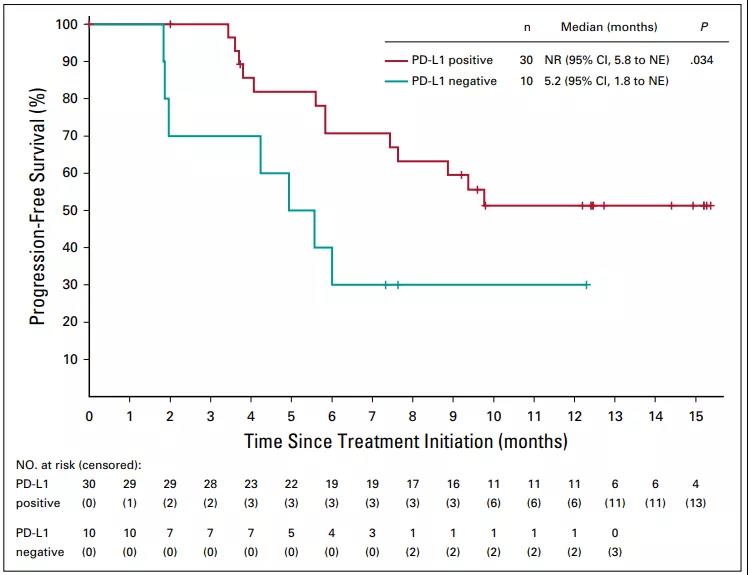
图3. PD-L1阳性与PD-L1阴性患者的PFS
结论与讨论
卡瑞利珠单抗联合阿帕替尼用于晚期宫颈癌有前景,但尚需随机对照研究验证
据我们所知,这是首个评估抗PD-1抗体联合VEGFR抑制剂用于晚期宫颈癌患者的研究。卡瑞利珠单抗联合阿帕替尼用于晚期宫颈癌显示出有希望的疗效前景,且安全性可控。
晚期宫颈癌一线化疗进展后的治疗选择相当少,免疫检查点抑制剂在这类患者中的有效率为14.6%~26%,阿帕替尼单药在所有组织类型中的有效率为14.6%~15.4%,在鳞癌中的有效率为48%。本研究中联合治疗的ORR在所有组织类型中达到55.6%,在鳞癌中达到77.8%,提示卡瑞利珠单抗与阿帕替尼联用可能有协同作用。当然这一协同作用尚需在更大规模的随机对照研究中加以验证。
联合治疗的毒性可控
本研究中,卡瑞利珠单抗和阿帕替尼的安全性与既往报道的其他抗PD-1/PD-L1抗体和VEGF通路抑制剂一致。多数AE(主要与阿帕替尼相关)是可控的。与阿帕替尼相关的最常见AE是高血压(84.4%);甲状腺功能减退是最常见的免疫相关AE(22%),这与既往报道的卡瑞利珠单抗及其他PD-1抑制剂的AE一致。值得指出的是,卡瑞利珠单抗和阿帕替尼的一些潜在的叠加毒性应该加以注意,比如肝毒性、疲劳和腹泻。本研究中,通过阿帕替尼暂停和减量,所有患者的肝毒性和腹泻都得到了缓解。
最佳剂量和给药计划尚需进一步探索
到目前为止,口服VEGFR抑制剂与PD-1/PD-L1抑制剂联合治疗的最佳剂量仍不清楚。本研究中,73.3%的患者阿帕替尼减量,高于先前的仑伐替尼联合帕博利珠单抗用于子宫内膜癌的研究(62.9%的患者仑伐替尼减量)。在第3周期治疗中,只有35.6%的患者能够耐受阿帕替尼250mg qd的起始剂量,提示未来的临床试验或许应考虑更低的起始剂量。
临床前数据显示,VEGF通路抑制剂产生的血管正常化过程是以剂量依赖性方式发生的。大剂量的抗血管生成药物导致血管正常化窗口期缩短。相反,低剂量的抗血管生成药物可以延长血管正常化的过程,从而减少肿瘤缺氧,增强免疫细胞向肿瘤的浸润。然而,低剂量的阿帕替尼是否会带来持久的疗效?答案尚未明,这一组合的最佳剂量和给药计划尚需进一步探索。
事后分析的启示
事后分析显示,PD-L1阳性患者和PD-L1阴性患者中均观察到肿瘤缓解,但PD-L1阳性患者较PD-L1阴性患者的PFS更长,但毕竟样本量太小,并没有足够的效力判定二者之间究竟是否真的有差别。事后分析也显示无论组织学类型如何,均观察到抗肿瘤活性,但鳞癌患者的ORR和PFS较腺癌患者显著更好,既往的研究显示PD-L1阳性率在宫颈鳞癌高于宫颈腺癌。由于更高的PD-L1表达与抗PD-1/PD-L1治疗疗效更好相关,因此鳞癌的PD-L1高表达可能是该亚组疗效更好的部分原因。但是在本研究中,鳞癌和腺癌的PD-Ll表达并没有差异(P=0.251),这可能是由于可供比较的样本量有限。
总之,卡瑞利珠单抗联合阿帕替尼在晚期宫颈癌患者中具有良好的抗肿瘤活性和可控制的毒性,有必要进行更大规模的随机对照试验来验证该发现。
