T-DM1在HER2阳性转移性乳腺癌和脑转移乳腺癌患者中的疗效与安全性
HER2阳性脑转移乳腺癌患者代表了一类难治性人群,T-DM1在这部分人群中的小型临床研究中表现出了潜在的抗肿瘤活性。有研究指出T-DM1对比拉帕替尼联合卡培他滨可以改善曲妥珠单抗耐药的晚期转移性乳腺癌患者和既往接受过放疗的有症状的脑转移患者的总生存(OS)。2020年7月,《肿瘤学年鉴》(Annals of Oncology)杂志发表了T-DM1在HER2阳性转移性乳腺癌和脑转移乳腺癌患者中的研究结果。
研究背景
HER2阳性乳腺癌患者发展为中枢神经系统转移性疾病的风险很高,特别是脑转移;脑转移患者预后较差,HER2阳性转移性乳腺癌(MBC)和脑转移(BM)患者的治疗选择有限,既往研究表明含HER2靶向的系统性治疗可能改善HER2阳性MBC和BM患者的预后。
表皮生长因子EGFR/HER2靶向酪氨酸激酶抑制剂(TKIs)拉帕替尼和来那替尼(单药或联合卡培他滨)以及HER2特异的TKIs Tucatinib的研究报道了它们在HER2阳性MBC和BM患者中的抗肿瘤活性。在这些患者其他潜在抗肿瘤活性的药物中,有研究指出T-DM1对比拉帕替尼联合卡培他滨可以改善曲妥珠单抗耐药的晚期MBC和既往接受过放疗的有症状的BM患者的OS。两项小型的附加研究也指出了T-DM1在HER2阳性MBC和BM患者中有临床抗肿瘤活性。
KAMILLA是一项正在进行的国际单臂开放标签的Ⅲb期研究,评估既往接受过治疗的HER2阳性晚期乳腺癌患者中T-DM1的有效性和安全性。初步分析发现T-DM1耐受性良好,其疗效与之前的报道一致。该研究报道了来自KAMILLA队列1数据的研究结果,描述在基线有脑转移和无脑转移患者中T-DM1的安全性和有效性。
研究方法
KAMILLA研究队列1计划入组2000例患者,初步研究结果已报道,截至目前,队列2已招募182例患者,仅包括亚洲的患者,随访正在进行中。符合条件的患者为既往接受过HER2靶向治疗和化疗后疾病进展或者晚期乳腺癌治疗中或治疗后疾病进展或完成辅助治疗6个月内疾病进展。患者存在未治疗的、有症状的脑转移或者入组前结束放疗>14天已控制的脑转移也是符合条件的。患者签署知情同意书。受试者接受T-DM1 3.6mg/kg每3周一次(静脉注射),直至出现不可耐受的毒性、撤消知情同意或疾病进展。这项研究队列1探索性分析的目的是评估基线BM患者亚组中T-DM1的临床活性和安全性。主要研究终点是最佳总体缓解率[BOR:完全缓解(CR)+部分缓解(PR)]和临床获益率[CBR:CR+PR+疾病稳定(SD)持续时间≥6个月],以及无进展生存(PFS),OS和安全性。
研究结果
从2012年11月12日至2014年9月29日队列1共入组2003名患者,2002例患者接受T-DM1治疗,数据截至时(2017年1月31日),中位随访时间为20.6个月,在接受治疗的患者中,398例患者基线时存在BM,基线存在和不存在BM的患者两组人口统计学和疾病特征具有可比性(表1);两组使用T-DM1的中位持续时间分别为4.9个月和5.8个月。
表1. 基线人口统计学和疾病特征
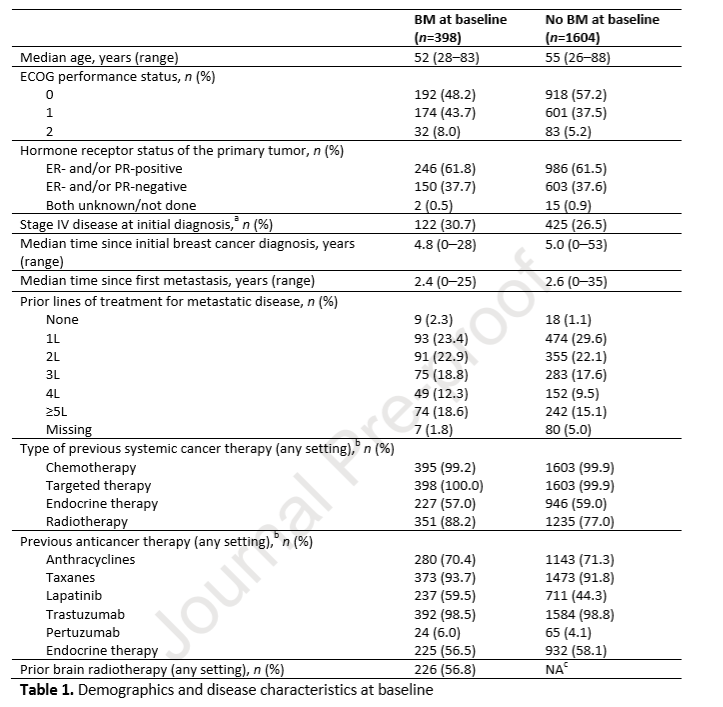
基线时可测量BM患者,根据RECIST 1.1版本评价总体肿瘤反应。在126例存在基线可测量脑转移的患者中,3例患者达到CR,24例达到PR,所有器官的BOR为21.4%(27/126;95%CI 14.6~29.6)(图1A和1B)。27例患者SD持续时间≥6个月,CBR为42.9%(54/126;95%CI 34.1~52.0),脑部靶病灶最大直径总和减少≥30%的人群占42.9%(54/126;95%CI 34.1~52.0),包括那些根据RECIST1.1标准总体疾病反应率评价为SD或疾病进展(PD)的患者。
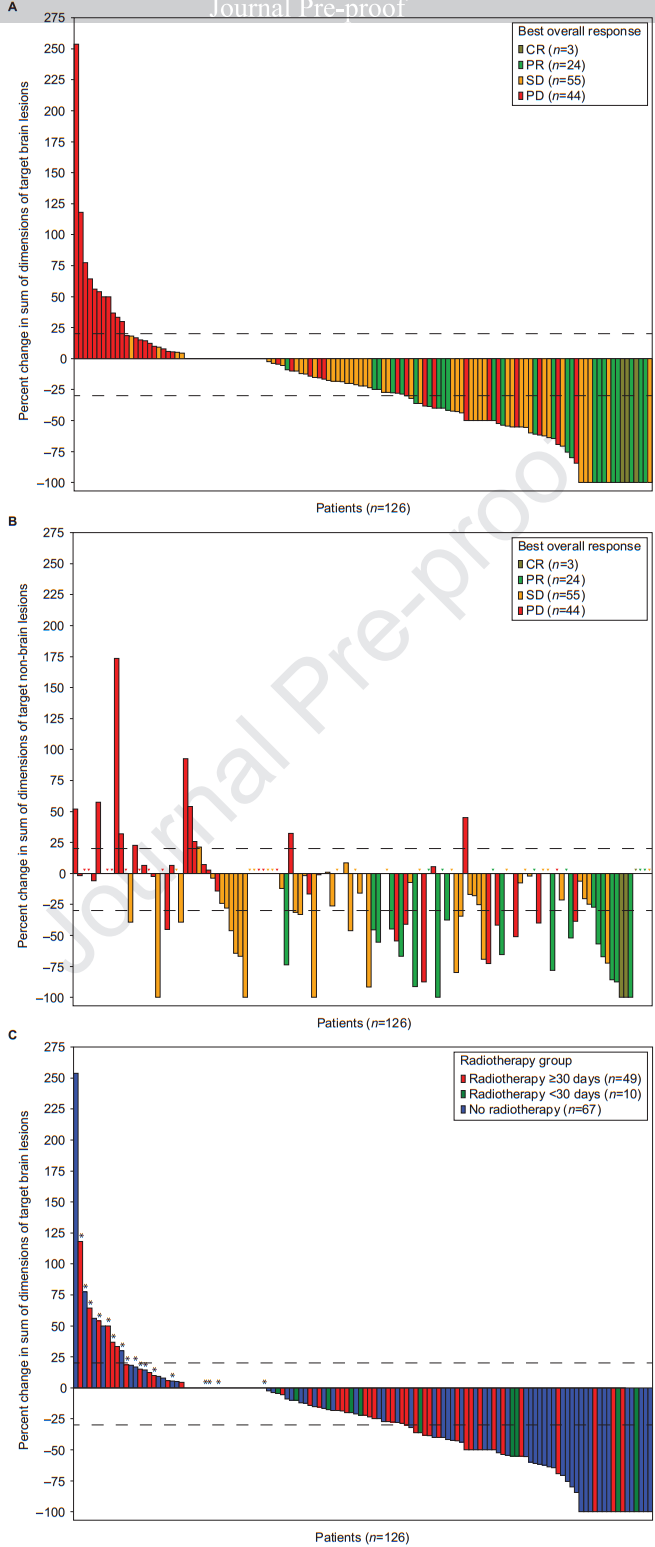
图1.(A)颅内靶病灶直径和变化比例;(B)非颅内靶病灶直径和变化比例;(C)放疗亚组颅内靶病灶直径和的变化比例
在126例存在可测量病灶的BM患者,颅内靶病灶最大直径总和减少≥30%的患者50%(5/10;95%CI 18.7~81.3) 基线前<30天接受脑部放疗,32.7%(16/49;95%CI 20.0~47.6)患者在基线前≥30天接受脑部放疗,49.3%(33/67;95% CI 36.9~61.8)的患者未接受过脑部放疗(图1C)。在54例颅内靶病灶最大直径总和减少≥30%的患者中,9例患者在CNS疾病进展后继续使用T-DM1,T-DM1的中位持续时间为9.5个月,图2显示了接受和未接受放疗的患者靶病灶的变化。
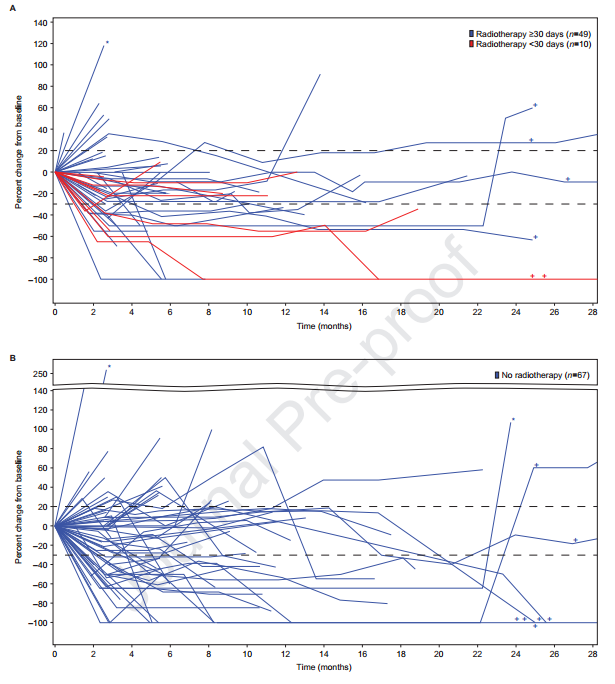
图2.(A)基线前≥30天接受脑部放疗和基线前<30天接受脑部放疗,颅内病灶的变化比例;(B)未放疗者颅内病灶变化的比例
总体人群生存结果显示,基线存在BM和无BM患者的中位PFS分别为 5.5个月 (95% CI 5.3~5.6个月)vs7.7个月(95% CI 6.8~8.1个月)(图3A);中位OS分别为18.9个月(95% CI 17.1~21.3个月)vs 30个月(95% CI 27.6~31.2个月)(图3B),通过探索性Cox模型评估了OS的潜在预后因素。在单变量分析中,基线时BM的存在与OS降低相关[估计HR=1.68(95%CI 1.46~1.93;P<0.0001)]。在多变量Cox分析中,基线时的脑内病变仍然是统计学上显著的变量。但是,调整后的BM效应估计值幅度较小[调整后的BM效应估计HR为1.18(95%CI 1.02~1.38;P=0.0268)];并且发现其他几个变量可能与OS降低有关,包括年龄较大,诊断出转移性疾病以来的时间较短,ECOG评分≥1,肝转移的存在,转移部位的数量较多以及既往MBC治疗的线数较多。
图3.(A)基线有或无BM患者的PFS;(B)基线有或无BM患者的OS
在T-DM1治疗期间,共有269例患者出现了新的脑转移病灶,包括基线存在BM患者中的28.9%,基线无BM患者中的9.6%。KAMILLA试验允许系统性疾病控制的情况下,新发脑转移病灶进行手术或放疗后继续使用T-DM1,研究者报道69例患者出现脑转移病灶进展后继续使用T-DM1,其中40例患者基线存在BM,29例基线无BM。这些患者中,随后的T-DM1治疗数据(进展后)有67例患者的数据可供使用,进展后T-DMI治疗中位持续时间为6.2个月。基线存在BM的患者(n=39)持续时间为8.8个月,基线无BM的患者(n=28)持续时间为6.2个月。
在安全性方面,在基线存在BM的患者中发生任何不良反应(AE)的患者比例为92.5%,发生严重AE的患者比例为28.4%;基线无BM的患者发生任何AE的患者比例为93.1%,发生严重AE的患者比例为19.6%。BM亚组各级别AE发生率相似。然而,基线BM的患者中,头痛和呕吐的比例略高,而基线无BM的患者发热的比例更高。基线BM的患者(n=208,52.3%)对比基线无BM的患者(n=701,43.7%),中枢神经系统的AEs的发生率更常见。
讨论与结论
KAMILLA研究为目前纳入HER2阳性晚期乳腺癌和接受T-DM1治疗的BM患者人数最多的研究(n=398)。根据RECIST标准评估脑转移灶的最大直径的总和缩小≥30%的患者达到42.9%,在T-DM1治疗期间出现新的脑转移灶的患者在经过脑转移灶的局部治疗后继续使用T-DM1,仍然可以获益。T-DM1的总体安全性在基线存在或不存在BM的患者之间也相似。尽管HER2阳性MBC的治疗取得了进展,但对于同时患有BM的患者治疗方法有限。这项针对HER2阳性的转移性乳腺癌和脑转移乳腺癌患者的前瞻性临床研究的探索性分析结果表明,T-DM1在这部分人群中活性和耐受性良好,T-DM1应该进一步被探索。