复发性流产与自身免疫性疾病
本文刊登于《中国实用妇科与产科杂志》2020,36(11):1040-1045
DOI:10.19538/j.fk2020110103
【引用本文】王海燕.复发性流产与自身免疫性疾病[J].中国实用妇科与产科杂志,2020,36(11):1040-1045.
作者:王海燕
基金项目:国家科技部课题(2017ZX09304012-012)
作者单位:北京大学第三医院妇产科生殖医学中心,北京 100191
电子信箱:wangquan1991@sina.com
自身免疫性疾病(autoimmune disease ,AID)约占复发性流产(recurrent spontaneous abortion,RSA)病因的15%,RSA的病因中最常见的AID为抗磷脂综合征(antiphospholipid syndrome,APS),另外还有系统性红斑狼疮(systemic lupuserythematosus,SLE)、干燥综合征(Sjogren’ssyndrome,SS)、类风湿关节炎(rheumatoidarthritis,RA)、系统性硬化症(systemicsclerosis,SSc)和未分化结缔组织病(undifferentiatedconnective tissue disease,UCTD)等。这些疾病产生自身抗体,可导致凝血和免疫功能紊乱,进而导致妊娠失败。AID合并RSA的患者妊娠前后需要妇产科与风湿免疫科共同管理,本文将分别介绍常见AID合并RSA的诊断和治疗。
1 RSA合并APS
1.1 定义及发病机制 APS是一种病因广泛,发病涉及临床多学科的AID,是由抗磷脂抗体(antiphospholipid antibody,APL)与自身磷脂抗原相互作用引起的动静脉血栓形成、动脉粥样硬化、RSA、胎死宫内等一系列症状的综合征。APS的发病机制主要包括由APL与内皮细胞、滋养层细胞、自然杀伤细胞等靶细胞上的自身抗原相互结合,进而产生炎症相关因子,激活补体后的级联反应为核心的机体免疫活动和损伤。这些免疫活动和损伤可导致血栓形成、滋养层细胞破坏等。最终将导致产科相关不良事件发生。
1.2 APS诊断标准 目前仍采用2006年悉尼国际APS会议修订的分类标准(见表1)。近几年学者们也逐渐认识到分类标准外一些临床表现和抗体检测,值得进一步关注。

1.3 APS治疗 目前,推荐主要的治疗方案为小剂量阿司匹林(low dose aspirin,LDA)联合低分子肝素(low molecular weight heparin,LMWH)抗凝治疗。孕前使用LDA,一旦发现妊娠,联合应用预防或者治疗剂量的LMWH至分娩前。有专家建议根据患者病史和抗磷脂抗体是否转阴决定LDA和LMWH的用药时间和剂量,没有血栓史、无其他自身免疫性疾病、既往仅早期流产史的低危患者可减少药物的使用时间和剂量。近年来,众多国际指南均推荐在使用LDA和LMWH的基础上添加羟氯喹治疗APS合并RSA,可获得更好的妊娠结局,必要时可添加小剂量糖皮质激素如醋酸泼尼松等。抗凝剂和免疫抑制剂的使用方法可参照《低分子肝素防治自然流产中国专家共识》及《复发性流产合并风湿免疫病免疫抑制剂应用中国专家共识》。
2 RSA合并SLE
2.1 定义及发病机制 SLE是一种多因素参与、自身免疫介导的弥漫性结缔组织病。遗传因素、性激素和环境因素相互作用,引起自身免疫调节功能紊乱,突出表现为B细胞功能亢进,产生多种自身抗体,导致多个系统和器官受累,血管病变是其基本病理变化之一,妊娠期常累及胎盘血管。SLE孕妇和胎儿发生严重并发症的风险明显高于正常人群。30%∼80%SLE患者血清中存在APL,这些患者发生严重产科并发症和不良妊娠结局风险更大,其中RSA是SLE最常见的妊娠并发症之一。
2.2 SLE的诊断标准 采用2012年SLICC制定的SLE诊断标准。见表2。

2.3 治疗 RSA合并SLE者首先应联合产科和风湿免疫科进行妊娠风险评估,已经妊娠者应评估继续妊娠的母胎风险,根据病情进行个体化治疗,必要时进行多学科联合诊治。对合并SLE的RSA患者推荐于备孕期即开始使用LDA及小剂量免疫抑制剂,对于APL阴性且无高危因素的SLE患者可在妊娠晚期给予预防剂量的LMWH。APL持续中高滴度阳性且有血栓病史、家族史的SLE患者应用治疗剂量LMWH。对既往联合使用LDA和预防剂量LMWH仍然发生不良妊娠事件且无高危因素的SLE患者推荐联合使用LDA和治疗剂量LMWH。免疫抑制剂的使用首选羟氯喹和糖皮质激素,如果不能耐受或无效可使用环孢素、他克莫司等免疫抑制剂,必要时可进行IVIG(静脉输注免疫球蛋白)和血浆置换。如病情仍然不能得到有效控制,为了挽救患者的生命,可使用环磷酰胺冲击治疗,同时应考虑终止妊娠。
3 RSA合并UCTD
3.1 定义及发病机制 目前,UCTD定义为患者出现1种或1种及以上结缔组织病的症状或体征,以及1种或1种以上自身抗体(如抗核抗体、抗SSA抗体等)阳性,病程持续1年以上,但又不符合任何结缔组织病诊断标准的自身免疫病。可能是自身免疫异常到结缔组织病的一种过渡状态。研究已经证实,UCTD会增加流产、早产、子痫前期、胎死宫内、新生儿低出生体重、胎儿及新生儿心脏传导阻滞和新生儿狼疮的发病风险,妊娠也会加重UCTD的病情或增加UCTD向某种结缔组织病的转化风险。Spinillo等研究显示,UCTD与对照组发生妊娠不良事件的比值比为2.81。UCTD对妊娠和胎儿的影响明确,包括流产/死产(3.23%)、子痫(11.29%)、胎儿生长受限(8.06%)、早产(3.23%)、新生儿先天性心脏传导阻滞、新生儿狼疮等。与此同时,妊娠会增加部分UCTD的患者发展为结缔组织病等风险。大多数UCTD患者ANA阳性,近 40%的患者呈现多种抗体阳性。影响妊娠的病理机制为免疫相关性抗体可通过影响血小板活性、凝血或抗凝机制损伤血管内皮细胞而诱发血栓形成,从而影响了胎盘的血管形成和子宫的血流动力学,对胚胎着床、胎盘的形成以及胎儿胎盘的生长发育产生负面影响。
3.2 诊断 UCTD的诊断目前还缺乏统一的分类标准,目前其诊断主要依靠UCTD 的定义。Dijkstra等提出,UCTD为具有结缔组织病的症状和体征,ANA(+),但不符合任何一种结缔组织病的诊断标准;Danieli等提出,其应为具有可疑自身免疫病的症状和体征,但不具备任何结缔组织病的诊断条件;Alarcón等则提出,早期UCTD指存在雷诺现象、干燥性角结膜炎、关节炎或其他结缔组织病表现,且病史>1年者。当患者出现1种以上其他结缔组织病的症状或体征,以及1种以上自身抗体(如ANA、抗SSA抗体等)阳性,持续1 年以上,但又不符合任何其他结缔组织病的诊断标准,可诊断为UCTD。部分UCTD的患者可以发展为结缔组织病。目前比较公认的UCTD诊断标准:(1)患者出现1种或1种及以上结缔组织病的症状或体征(2)循环中存在1种或1种以上自身抗体(如ANA、抗ds-DNA抗体、SSA抗体等)阳性(3)病程持续1年以上(4)排除任何结缔组织病。
3.3 治疗 目前,RSA合并UCTD的治疗以无致畸性的免疫抑制剂联合抗凝药物为主。妊娠期应密切关注凝血指标的变化,一旦出现易栓倾向,应及时给予LMWH进行干预,既往单用LDA发生妊娠不良事件的UTCD患者推荐联合使用LDA和预防剂量LMWH。
4 RSA合并SS
4.1 定义及发病机制 SS是一种以唾液腺、泪腺等外分泌腺体受累的慢性炎症为主要特征,并可累及全身多系统的自身免疫性疾病。在遗传、感染、性激素等多种因素作用下机体免疫功能紊乱,可出现大量淋巴细胞、浆细胞及单核细胞在基底层浸润,同时伴有导管上皮细胞增生形成病灶的病理改变。另外一种常见的病理改变是中小血管的血管炎。SS分为原发性SS和继发性SS,后者常继发于其他AID,如SLE、RA和APS等。SS患者妊娠时,胎盘可作为靶器官而受到免疫损害,造成胎盘功能障碍,从而增加妊娠并发症和胎儿丢失的发生风险,SS患者和正常人群相比自然流产率和早产率均明显增加。
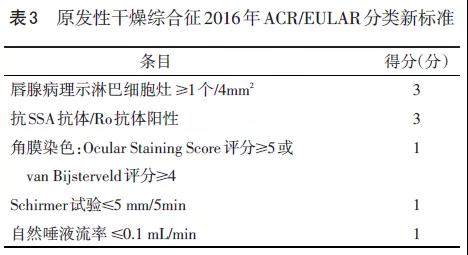
4.2 诊断 2016年美国风湿病协会(ACR)/欧洲风湿病防治联合会(EULAR)原发性干燥综合征的最新分类标准(见表3):根据症状体征提示SS的患者,当患者得分≥4,则将之归类为原发性SS。原发性SS诊断前入选标准:(1)眼干或口干的症状(≥1项),包括白天持续性、令人烦恼的眼干症状≥3个月,眼睛反复出现砂砾感,人工泪液使用次数>3次/d,口干≥3个月,吞咽干性食物需要频繁饮水辅助(2)或者EULAR干燥综合征疾病活动度指数问卷调查疑似SS的患者:至少有1项为阳性。此外需排除头部和颈部放射治疗史、丙型肝炎病毒感染、人类免疫缺陷病毒(HIV)、结节病、淀粉样变性、移植物抗宿主病、IgG4相关性疾病。
4.3 治疗 患者于备孕前约3个月需服用小剂量免疫抑制剂,首选羟氯喹和糖皮质激素。研究显示,羟基氯喹能降低胎儿发生心脏传导阻滞的风险。妊娠期若出现明显器官受累及血管炎,可考虑静脉使用糖皮质激素等治疗,必要时应终止妊娠。妊娠期需密切监测胎儿心率,必要时做胎儿超声心动图。产后仍需密切随访新生儿是否出现心脏房室传导阻滞。对已明确诊断的胎儿先天性心脏传导阻滞者,1度和2度心脏传导阻滞可考虑口服使用地塞米松治疗,剂量4mg/d。但目前在妊娠期尚无明确有效的治疗方案能够逆转或阻止其进一步加重。继发性SS合并RSA者,则按照原发病如SLE等疾病选择免疫抑制剂给药方案。对合并原发性SS的RSA患者:不建议常规使用LMWH,但要定期检测凝血功能,严密观察胎儿、胎盘受累的临床表现,给予针对性和选择性的抗凝治疗。对合并继发性SS的RSA患者:若SS继发于SLE等AID,则按照SLE等AID选择LMWH给药方案。
5 RSA合并RA
5.1 定义及发病机制 RA是一种以关节病变为主的慢性全身自身免疫性疾病。妊娠时,循环抗体及炎症因子可作用于胎盘或穿透胎盘屏障,从而影响胚胎着床及其生长发育。因此,RSA合并RA患者胎儿生长受限和胎膜早破的风险增加,RA的疾病活动度与早产、小于胎龄儿、新生儿低体重等密切相关。
5.2 诊断标准 2010年ACR/EULAR诊断标准见表4。当患者至少有1个关节出现无法用其他疾病解释的滑膜炎,且在4个方面(受累关节数量和位置、血清学分类、异常急性期反应物和症状持续时间)评分相加≥6分(最高10分)时,即可确诊RA。

5.3 治疗 服用甲氨蝶呤(MTX)等致畸药物且有妊娠计划的RA患者,需及早改用其他妊娠期安全的免疫抑制剂,待病情稳定再考虑妊娠。首先考虑羟氯喹,从备孕开始服用,并在妊娠期持续服用。妊娠期服用羟氯喹的RA患者出现疾病活动,可考虑加用小剂量糖皮质激素。若对羟氯喹不能耐受或无效,可以选用其他免疫抑制剂。
6 RSA合并SSc
6.1 定义及发病机制 SSc亦称硬皮病,是一种累及全身的自身免疫性疾病,基本病理变化为结缔组织纤维化、萎缩及血管闭塞性血管炎、免疫系统紊乱。临床表现有皮肤硬化、雷诺现象、指端溃疡、肺间质病变、肺动脉高压等。根据病变累及范围,可分为全身性SSc、局限性SSc和无皮肤累及型SSc。SSc患者妊娠时容易出现流产、子痫前期、胎儿生长受限、早产、低体重儿等不良妊娠结局。尤其当SSc患者合并肺动脉高压、肺间质病变时,更易出现流产等妊娠不良事件。
6.2 诊断标准 2013 ACR/EULAR联合发布硬皮病新分类标准见表5。

6.3 治疗 治疗SSc常用的免疫抑制剂大多有致畸性,如环磷酰胺(CYC)、MTX、霉酚酸酯(MMF)等,而对SSc有效的且妊娠期安全的免疫抑制剂,如硫唑嘌呤(AZA)、环胞菌素A(CsA)等,目前,尚无大样本的临床研究证实其对改善妊娠结局有效。如SSc患者合并肺动脉高压、严重间质性肺病、心力衰竭、慢性肾功能不全等严重并发症,则建议避孕或尽早终止妊娠。针对严重、多药无效的SSc患者,妊娠中、晚期可以使用CYC控制病情,并考虑及时终止妊娠。尽量减少糖皮质激素使用,避免早产和高血压危象发生。
总之,合并AID的患者,RSA等不良妊娠的发病风险增加,临床医师要充分重视该类患者的妊娠期管理,建议采取多学科共同管理模式进行妊娠前风险评估,同时加强孕期管理,以最大限度的减少RSA等不良妊娠的发生风险,保证母婴安全(参考文献略)