《2021.2 NCCN外阴鳞癌临床实践指南》解读
2020年10月19日,美国国立综合癌症网络(NCCN)更新发布了《2021.2 NCCN外阴鳞癌临床实践指南》,现对该指南进行简要解读。该指南只针对鳞癌,不包括外阴其他病理类型如外阴黑色素瘤、腺癌等。
1 新版指南主要更新
(1)新增了妇科疾病幸存者指导原则,以讨论妇科癌症的生理和社会心理影响及相关的医疗管理措施(2)新增了以标志物为导向的二线全身治疗原则。
2 分期
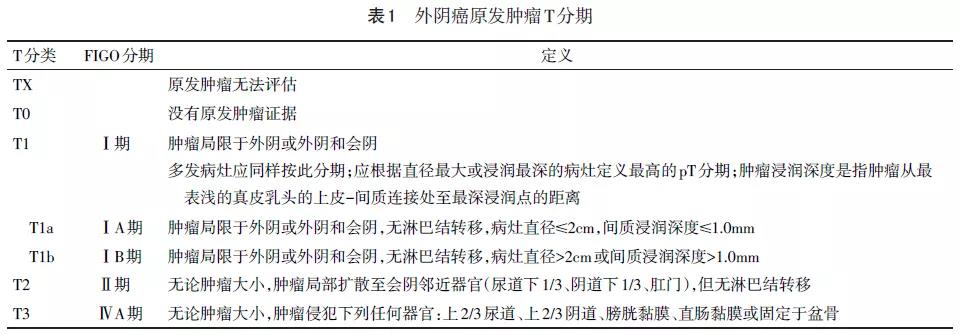
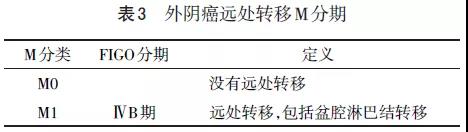
采用国际妇产科联盟(FIGO)2009外阴癌分期及美国癌症联合委员会(AJCC)第8版TNM分期。见表1~3。

3 初始治疗
术前需进行全面的病史采集及体格检查,推荐的辅助检查包括血常规、病灶活检、病理诊断、肝肾功能检查、麻醉下膀胱镜检查及直肠镜检查。影像学检查可用于判断肿瘤浸润范围和制定治疗方案,可行子宫颈HPV、细胞学检测及血清HIV检测。另外,建议患者戒烟及提供必要的咨询干预。
治疗前可大致分为以下3种情况:(1)早期肿瘤:即T1期和小病灶的T2期(指肿瘤直径≤4cm,无侵犯尿道、阴道或肛门)(2)局部晚期肿瘤:即大病灶的T2期(指肿瘤直径>4cm或肿瘤侵犯尿道下1/3、阴道下1/3、肛门)和T3期(指肿瘤侵犯上2/3尿道、上2/3阴道、膀胱黏膜、直肠黏膜或固定于盆骨)(3)晚期肿瘤:肿瘤转移超出盆腔,即任何期别的T,任何期别的N和超出盆腔的M1期病变。
早期肿瘤以手术为主,局部晚期肿瘤手术结合放疗,晚期、转移肿瘤采用姑息、对症及支持治疗。
3.1 早期肿瘤(T1期和小病灶的T2期) 先行病灶活检(1)病变浸润深度≤1mm,行单纯部分外阴切除术(simple partial vulvectomy)。术后病理证实病灶浸润深度≤1mm,随访。病灶浸润深度>1mm,需补充手术[见下文(2)](2)病灶浸润深度>1mm或T2期病变,根据病灶位置决定术式:①单侧病变(病灶距外阴中线≥2cm),行根治性部分外阴切除术(radical partial vulvectomy)+单侧腹股沟/股淋巴结评估(前哨淋巴结活检术或单侧腹股沟/股淋巴结切除术);②中线部位病变(前部或后部),行根治性部分外阴切除术+双侧腹股沟/股淋巴结评估(前哨淋巴结活检术或双侧腹股沟/股淋巴结切除术),术后均根据原发灶及淋巴结的病理结果决定辅助治疗。
3.2 早期肿瘤手术后的辅助治疗 需根据原发灶及淋巴结状态而定。
对于原发灶而言,初始治疗后的高危因素包括手术切缘阳性、淋巴脉管间隙浸润、切缘邻近肿瘤、肿瘤大小、浸润深度、浸润方式(跳跃性或弥漫性),其中外阴手术切缘阳性是术后复发的重要预测因素。若手术切缘阴性,术后可随访或根据有无其他高危因素行辅助外照射放疗;若手术切缘阳性,可考虑再次手术切除至切缘阴性,术后随访或根据有无其他高危因素行辅助外照射放疗。外阴切缘阳性无法再次手术切除或再次手术切缘仍为阳性者,需辅助外照射放疗。
对于淋巴结状态而言,分为以下3种情况:(1)淋巴结阴性(前哨淋巴结或腹股沟/股淋巴结),术后可随访观察(2)前哨淋巴结阳性,需根据阳性淋巴结大小决定后续处理,如为单个直径≤2mm的前哨淋巴结转移,行外照射放疗±同期化疗;如直径超过2mm,可考虑先行系统性腹股沟/股淋巴结切除术(优先推荐),术后行外照射放疗(对于≥2个淋巴结阳性或淋巴结囊外扩散者,选择放疗为1级证据)±同期化疗,也可直接行外照射放疗±同期化疗(3)腹股沟/股淋巴结切除术后发现淋巴结阳性,建议外照射放疗±同期化疗(对于≥2个淋巴结阳性或淋巴结囊外扩散者,选择放疗为1级证据)。
3.3 局部晚期肿瘤(指大病灶的T2期和T3期,T3期即使切除周围器官也无法切除病灶) 腹股沟淋巴结和外阴病灶分步处理。先行影像学检查:(1)影像学检查未发现可疑淋巴结,先行腹股沟/股淋巴结切除术。若术后病理发现淋巴结阳性,行外阴原发灶/腹股沟股区/盆腔的外照射放疗+同期化疗。若淋巴结阴性,行外阴原发灶(±选择性覆盖腹股沟股淋巴结区)的外照射放疗+同期化疗(2)如影像学检查发现可疑淋巴结(包括局限于盆腔的M1期淋巴结转移),可选择:①不行腹股沟/股淋巴结切除术,可考虑对增大的淋巴结进行细针穿刺活检,确认转移后行外阴原发灶/腹股沟股区/盆腔的外照射放疗+同期化疗;②行腹股沟/股淋巴结切除术。若术后病理淋巴结阳性,行外阴原发灶/腹股沟股区/盆腔的外照射放疗+同期化疗。若淋巴结阴性,行外阴原发灶(±选择性覆盖腹股沟股淋巴结区)的外照射放疗+同期化疗。
3.4 无论原发肿瘤期别,无法切除淋巴结 先行影像学检查以评估疾病扩散范围,对肿大淋巴结可考虑行细针穿刺活检,诊断明确后行外阴原发灶/腹股沟股区/盆腔的外照射放疗+同期化疗。
3.5 晚期肿瘤 转移超出盆腔(任何期别T、任何期别N和超出盆腔的M1期病变)可考虑局部控制或姑息性外照射放疗和(或)全身治疗,或者采用最佳支持治疗。
4 手术分期原则
(1)外阴癌采用的是美国癌症联合委员会(AJCC)及国际妇产科联盟(FIGO)分期系统(详见上文“2分期”)(2)手术分期包括完整切除外阴原发灶(大体手术切缘距病灶至少1cm),单侧/双侧腹股沟/股淋巴结切除术或前哨淋巴结活检术。腹股沟/股淋巴结切除术的范围是上达腹股沟韧带,内近股三角,深达筛筋膜(3)淋巴结状态是决定患者生存期的最重要因素(4)既往采用单切口连续整块切除外阴肿瘤及双侧腹股沟浅/股深淋巴结,该术式并发症发生率较高(5)现行标准术式为外阴及腹股沟分开的三切口术式(6)外阴原发肿瘤切除术式根据原发灶的大小及浸润范围而定,包括部分或全外阴切除术,切除深度可以是表浅的/仅切除皮肤、单纯切除或根治性切除(7)根治性外阴切除术的切除深度需达泌尿生殖隔,正中会阴筋膜或耻骨筋膜(8)目前,并无比较以上术式手术效果的前瞻性临床研究,已有的回顾性研究数据表明:根治性部分外阴切除术与根治性全外阴切除术的复发率无异(9)当外阴原发单一肿瘤直径<4cm,距离外阴中线≥2cm且腹股沟/股淋巴结临床阴性时,可行同侧腹股沟/股淋巴结切除术或前哨淋巴结活检术(10)若外阴原发肿瘤距离外阴中线<2cm或跨越中线部位,推荐行双侧腹股沟/股淋巴结切除术或前哨淋巴结活检术(11)ⅠA期患者因淋巴结转移率<1%,不推荐行腹股沟股淋巴结切除术或前哨淋巴结活检术(12)ⅠB~Ⅱ期患者淋巴结转移率>8%,推荐行腹股沟/股淋巴结切除术(13)同侧腹股沟淋巴结切除术后病理阴性,对侧腹股沟淋巴结转移率<3%(14)同侧腹股沟淋巴结切除术后病理阳性者,对侧腹股沟淋巴结可切除或行腹股沟区放疗。肿瘤同侧淋巴结切除术中发现任何增大或可疑转移的淋巴结,需行快速冰冻病理检查确定是否转移,以指导淋巴结切除术的范围及是否切除对侧腹股沟淋巴结(15)新辅助放疗+以铂类为基础的同步增敏化疗可使局部晚期患者获益。若同步放化疗后病灶未达完全缓解,可对适合手术者切除残余病灶(16)对于无法切除的大块的腹股沟/股淋巴结病灶或外阴癌原发灶T3期的治疗方法尚未明确,可考虑以下治疗方案:①对大块淋巴结病灶行减瘤术,术后对双侧腹股沟区及外阴原发灶行以铂类为基础的同步放化疗;②对双侧腹股沟区及外阴原发灶单纯行以铂类为基础的同步放化疗。
5 腹股沟股区前哨淋巴结显像的应用原则
腹股沟/股淋巴结切除术后并发症发生率较高,20%~40%的患者存在伤口并发症,30%~70%的患者出现淋巴水肿。越来越多的证据表明,对部分外阴鳞癌患者而言,腹股沟股区前哨淋巴结活检术可代替系统性淋巴结切除术。前哨淋巴结活检术可在不遗漏淋巴结转移灶的同时降低术后并发症的发生率。前瞻性研究已在外阴鳞癌患者中证实了前哨淋巴结活检术的可行性、安全性、准确性及腹股沟区淋巴结低复发率。
前哨淋巴结活检术适用于临床和(或)影像学检查均未发现腹股沟区淋巴结转移、直径<4cm的单发外阴病灶患者。前哨淋巴结活检应由有丰富前哨淋巴结显像操作经验的术者施行,可提高前哨淋巴结的检出率。使用放射性胶体及染料可提高前哨淋巴结检出敏感性。最常用的放射性胶体是99mTc,通常在外阴切除术及淋巴结切除术前2~4h注射。术前的淋巴显像有助于前哨淋巴结的定位。最常用的染料是1%异硫蓝,在肿瘤周围的2、5、7及10点方向皮内注入4mL染料。推荐在外阴病灶切除前行前哨淋巴结显像,以免影响外阴原发灶与腹股沟淋巴结间的淋巴交通网络。另外,异硫蓝染料仅在外阴原发灶相关的第一组淋巴结中短暂显示(如30~60min)。为了明确腹股沟淋巴结切除的位置及范围,推荐淋巴结切除术前应用伽马探测仪在腹股沟/股淋巴结区探测注入的放射性胶体。若一侧的前哨淋巴结无法检出,则行该侧的系统性腹股沟/股淋巴结切除术。若前哨淋巴结中发现直径>2mm的转移灶,推荐完成系统性腹股沟股淋巴结切除术。若单侧前哨淋巴结阳性,需手术评估对侧腹股沟股淋巴结和(或)辅助外照射放疗。对前哨淋巴结行选择性冰冻切片检查,有助于术中判断是否需行系统性单侧/双侧腹股沟股淋巴结切除术。
6 放疗原则
肿瘤靶向放疗是针对已知或可疑肿瘤侵犯部位的放疗。肿瘤靶向外照射放疗(EBRT)的照射区域是外阴和(或)腹股沟/股淋巴结、髂外及髂内淋巴结区。后装放疗有时可用于治疗原发病灶。需结合临床检查及影像学结果以确保足够的肿瘤覆盖区域及合适的淋巴结靶区。对于大块肿瘤患者,靶区设计需保证覆盖肿瘤周边组织。少部分患者只需治疗表浅外阴病灶,可使用浅层电子束照射。已报道的放疗技术有很多种。近期一项国际性研究已发表了如何更好地规范放疗适应证及放疗技术的建议。绝大多数患者会出现程度不一的急性放疗副反应(如腹泻、膀胱刺激征、疲乏、皮肤黏膜反应),且可能随着同期化疗进一步加重症状。这些毒性反应必须积极处理(如局部皮肤护理、用药缓解症状),尽量避免中断治疗。急性反应可在放疗结束后数周逐渐缓解。术后辅助治疗需尽快开始,最好在术后6~8周内进行。
7 同期放化疗后治疗效果评估
(1)原发灶及淋巴结区无残余病灶时,可考虑治疗结束3个月后行瘤床的组织活检以便病理学上确认完全缓解。活检结果阴性者定期随访;活检结果阳性者再行手术切除,切除术后能达到切缘阴性者随访,切缘仍阳性者可考虑辅加手术(对某些中央型复发患者可考虑盆腔廓清术)、外照射放疗和(或)全身系统治疗或最佳支持治疗(2)原发灶和(或)淋巴结区有残余病灶,可手术者再次手术切除。术后切缘阴性者随访,切缘阳性者可考虑再次手术(对某些中央型复发患者可考虑盆腔廓清术)、外照射放疗和(或)全身系统治疗或最佳支持治疗;无法再次手术者,可考虑加外照射放疗和(或)全身系统治疗或最佳支持治疗。
8 全身治疗原则
同期放化疗中化疗药物首选顺铂单药,其他可选方案包括氟尿嘧啶(5-FU)+顺铂及5-FU+丝裂霉素C。
晚期、复发及转移灶的化疗方案首选顺铂单药、卡铂单药、顺铂/紫杉醇、卡铂/紫杉醇、顺铂/紫杉醇/贝伐珠单抗,其他可选方案有紫杉醇单药、顺铂/长春瑞滨、埃罗替尼(erlotinib)(2B级证据)、顺铂/吉西他滨(2B级证据)及卡铂/紫杉醇/贝伐珠单抗(2B级证据)。
以标志物为导向的二线全身治疗方案无首选推荐方案,仅在某些情况下可用帕姆单抗:存在TMB-H(高肿瘤突变负荷)、PD-L1阳性或MSI-H/dMMR肿瘤。纳武单抗:与HPV相关的晚期或复发/转移性外阴癌。拉罗替尼或恩曲替尼:存在神经营养性原肌球蛋白受体激酶(NTRK)基因融合阳性肿瘤(2B级证据)。
9 病理学评估原则
鳞癌的组织学分级无明确标准,病理学上判断可存在主观性。外阴上皮内瘤变(VIN)癌变为外阴鳞癌的2条通路可分为HPV相关及非HPV相关两类。非HPV相关的VIN和外阴鳞癌常见于慢性外阴炎性疾病,如硬化性苔藓。HPV相关的鳞癌常发生于年轻女性,通常表现为多灶性,与经典的VIN相关,可并发下生殖道其他部位的鳞状上皮病变,免疫组化检测显示为在细胞核和细胞质中弥漫性的块样p16强阳性染色和野生型p53(异源性染色模式)。非HPV相关的鳞癌常见于年长女性,为单一病灶,与分化型外阴上皮内瘤变(dVIN)有关,免疫组化检测可表现为突变型p53染色(广泛的核强表达或完全表达缺失),p16染色常为阴性或局灶阳性。一项Meta分析结果显示,相比非HPV相关性鳞癌,HPV相关性鳞癌的预后更好。HPV相关性分析有助于识别肿瘤的癌变通路,并可能提供相关的预后信息。
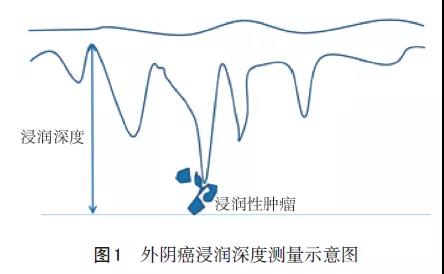
外阴鳞癌的病理学评估内容包括:(1)外阴。手术方式(部分/全/根治性外阴切除术)、肿瘤部位、肿瘤大小(包括最大径线和2条辅助径线)、肿瘤灶数目、组织学类型、组织学分级、浸润深度(mm,测量方法见图1)、手术切缘状态、淋巴脉管浸润(2)其他组织/器官受累(阴道、尿道、肛门、膀胱黏膜、直肠黏膜、盆骨及其他部位)(3)淋巴结(如手术切除)。前哨淋巴结需进行超分期以检测是否有少量转移灶;淋巴结数目,包括:直径≥5mm的淋巴结转移、≤5mm的淋巴结转移、孤立的肿瘤细胞团(直径≤0.2mm);复发、进展或转移的患者可行MMR/MSI、PD-L1和(或)NTRK基因融合检测。可考虑通过一种有效的和(或)经FDA批准认证的方法进行肿瘤组织的肿瘤突变负荷(TMB)检测。
10 影像学检查项目选择原则
10.1 初始评估 行胸部X线检查,若结果异常行胸部CT平扫。建议盆腔MRI检查辅助制定手术及放疗方案。T2期、大块病灶或怀疑转移者推荐行全身PET-CT或胸部/腹部/盆腔CT检查。出现症状或临床怀疑转移者可考虑行其他影像学检查。
10.2 随访监测 怀疑复发或转移者可行胸部/腹部/盆腔CT检查或颈部/胸部/腹部/盆腔/腹股沟PET-CT检查。初始根治性治疗后,可行PET-CT检查以评估治疗效果,再根据症状等临床表现选择其他影像学检查。
10.3 确诊复发 如果随访期间从未行全身PET-CT检查,推荐行颈部/胸部/腹部/盆腔/腹股沟PET-CT检查,盆腔MRI检查有助于制定治疗方案。
11 随访
治疗后前2年每3~6个月随访1次,第3~5年每6~12个月随访1次,以后每年随访1次。建议行子宫颈/阴道细胞学筛查(可包括HPV检测)以早期发现下生殖道上皮内病变。若症状或临床检查怀疑复发,需行影像学检查及实验室检查(血常规、血尿素氮、肌酐)。需进行健康宣教,内容包括可能的复发症状、外阴营养不良表现、定期自检、生活方式、肥胖、运动、戒烟、营养咨询、性健康、阴道扩张器及阴道润滑剂使用、治疗后可能导致的长期及晚期并发症等。
12 复发的治疗
临床怀疑复发,需行影像学检查了解转移灶情况,建议病理活检以确诊远处转移。复发包括局部复发和远处转移,治疗可分为以下两种情况。
12.1 局限于外阴的临床复发(淋巴结阴性) (1)无放疗史者,可选择:①根治性部分或全外阴切除病灶±单侧/双侧腹股沟股淋巴结切除术(既往未切除淋巴结者),若术后切缘、淋巴结影像学、病理和临床检查均阴性,可随访观察或外照射放疗;若切缘阳性,但淋巴结影像学、病理及临床检查均阴性,可再次手术切除,或外照射放疗±后装放疗±同期化疗(支持同期化疗的证据等级为2B级);若切缘阴性、淋巴结阳性,术后行外照射放疗±同期化疗;若切缘及淋巴结均阳性,术后行外照射放疗±后装放疗±同期化疗±再次手术切除;②外照射放疗±后装放疗±同期化疗,治疗后病变完全缓解者定期随访。仍残留明显的外阴病灶者再次手术切除,术后定期复查(2)有放疗史者,行根治性部分或全外阴切除术,术后定期随访。
12.2 淋巴结复发或远处转移 (1)孤立的淋巴结或盆腔复发:既往未接受外照射放疗者可切除阳性淋巴结,术后辅助外照射放疗±同期化疗。既往有放疗史者,合适的病例可考虑手术切除,术后化疗;或直接化疗或选择最佳支持治疗(2)多发盆腔淋巴结转移或远处转移或既往曾接受盆腔放疗:全身化疗和(或)外照射放疗,或最佳支持治疗。
13 妇科疾病幸存者指导原则
13.1 生理影响 妇科恶性肿瘤经典治疗包括手术、化疗、激素治疗、放疗和(或)免疫治疗,这些治疗可导致急性、短期和长期毒性反应。
手术治疗范围可以很广,从而导致粘连形成,后者可引起疼痛及小肠梗阻,还有泌尿系及胃肠道并发症(如失禁或腹泻)、盆底功能障碍(表现为一些对泌尿系、肠道及性生活的影响)及淋巴水肿。尽管常用化疗方案可导致神经毒性、心脏毒性、继发血液系统肿瘤及认知障碍的风险显著,但具体化疗药物的副反应各不相同。长期雌激素缺乏可导致如潮热、阴道干涩及骨质丢失的症状。放疗可导致长期并发症(如纤维化、外阴阴道萎缩),且可能使患者易发生皮下组织和(或)靠近照射野的底层器官的继发癌症。免疫治疗的应用正在兴起,且目前为止,这些治疗方案的长期影响尚未明确。
13.2 心理影响 癌症后心理影响可包括心理上(如抑郁、焦虑、对复发及身体形象改变的恐惧)、经济上(如重返工作岗位、保险问题)和人际上的影响(如人际关系、性及亲密度)。
13.3 临床方法 所有妇科恶性肿瘤幸存者需定期接受针对慢性疾病管理的普通医疗护理,包括监测心血管疾病风险因素、推荐的疫苗接种及鼓励选择健康的生活方式。为了评估妇科恶性肿瘤的迟发性和长期影响,临床医师应全面记录患者的病史,进行彻底的体格检查及必要的影像学和(或)实验室检查。所有妇女,无论是否处于性活跃期,都应该询问是否存在包括外阴阴道干涩的生殖泌尿系症状。推荐患者于相应领域专家就诊咨询(如理疗、盆底治疗、性治疗、心理治疗)。由于绝大多数妇科恶性肿瘤的治疗都会导致性功能障碍、早绝经及不孕,我们需特别关注因此造成的医疗和社会心理影响。推荐放疗后使用阴道扩张器和润滑剂。与参与幸存者护理的所有临床医生(包括初级护理临床医生)进行沟通和协调至关重要。建议为癌症幸存者提供治疗总结和随访建议。
14 讨论
新版指南的更新内容不多,关于外阴癌的讨论热点问题,如初治外阴癌具体手术方式、手术切缘、局部晚期肿瘤的处理原则等问题,可参考笔者前期撰写的外阴癌指南解读。对于复发、晚期或转移性的外阴癌,免疫治疗正在逐渐成为新的热点,新版指南强调了免疫治疗的用药指征应以TMB、PD-L1及MMR/MSI为标志物,原因在于外阴鳞癌总人群中,免疫治疗的有效率并不太高,滥用的后果可导致严重的自身免疫性毒性,因此,需重视免疫治疗应用的规范及相关不良反应的管理。下面再简要讨论2个问题:(1)外阴癌的手术方式,一直没有公认的手术名称和确切的切除范围。NCCN在2020.1外阴癌指南版本中,把外阴病灶切除术归纳为两类术式:局部扩大切除术(wide local resection)和局部广泛切除术(radical local resection);在2020.2版中将这两种术式名称改为单纯部分外阴切除术(simple partial vulvectomy)和根治性部分外阴切除术(radical partial vulvectomy)。两术式的区别在指南中并无明确定义。在临床实践中,单纯部分外阴切除术适用于ⅠA期患者,根治性部分外阴切除术适用于ⅠB~Ⅱ期患者。两者的区别在于皮肤切缘的宽度和皮下组织切除深度的不同。单纯部分外阴切除术皮肤切缘距肿瘤病灶边缘的宽度至少达1cm,切除深度比较表浅,超过皮下1cm以上即可。根治性部分外阴切除术皮肤切缘的宽度则需达2~3cm,切除深度需达泌尿生殖隔或耻骨筋膜(2)局部晚期肿瘤包括大病灶的T2期和T3期,指南的处理推荐相同。实际上,T2期和T3期的处理需区别对待。T2期指无论肿瘤大小,肿瘤局部扩散至会阴邻近器官(尿道下1/3、阴道下1/3、肛门),但无淋巴结转移。T2期即使是外阴病灶超过4cm,只要具备外阴皮瓣转移技术、准备尿路改道及结肠造瘘,还是有完整切除病灶的可能,可结合手术技术、放疗设备和患者具体情况个体化处理,选择手术或放疗或综合治疗。T3期是指无论肿瘤大小,肿瘤侵犯下列任何器官:上2/3尿道、上2/3阴道、膀胱黏膜、直肠黏膜或固定于盆骨。T3期即便切除周围器官,肿瘤病灶也无法切除干净,治疗的选项只有同期放化疗和全身系统治疗。