重组人血管内皮抑制素用于不可切除局晚期NSCLC收效良好,贯穿同步放化疗和免疫巩固治疗全程
局部晚期非小细胞肺癌(NSCLC)的异质性强,疾病特点与早期、晚期NSCLC差异显著,治疗也是临床常见难题。对于不可手术的局晚期NSCLC,同步放化疗是标准治疗选择,但该方案治疗的5年生存率仅为20%,患者长期预后并不理想,临床对新疗法需求迫切,以重组人血管内皮抑制素为代表的抗血管治疗和免疫治疗,有望提升中国患者的预后。
本期分享一例TNM分期为IIIB期的不可切除局部晚期NSCLC患者,初始采用重组人血管内皮抑制素联合同步放化疗进行治疗,然后以重组人血管内皮抑制素联合PD-L1单抗巩固治疗,患者初始治疗达到部分缓解(PR),同步放化疗后巩固治疗阶段病情稳定(SD),累计无进展生存期(PFS)已接近12个月。
基本病史
患者:男性,58岁。
2019年10月因“咳嗽咳痰进行性加重1月”就诊,查体左上肺呼吸音低,胸部增强CT提示左肺上叶占位性病变,纵隔淋巴结增大;电子支气管镜提示左上叶支气管口粘膜粗糙,增生;PET-CT提示:左肺上叶软组织影,代谢增高,邻近肺段阻塞性改变,胸膜轻度增厚,左肺门及主肺动脉窗区稍大淋巴结,代谢增高,全身未见远处转移病灶;病理活检及免疫组化提示为腺癌,驱动基因检测阴性。诊断为:左肺上叶腺癌(cT4N2M0,IIIB期)。
结合患者分期及驱动基因检测阴性,经全院MDT会诊后,2019年11月开始行重组人血管内皮抑制素静脉持续泵入治疗(15mg/d),并联合培美曲塞+顺铂化疗及影像引导放疗(IGRT,剂量为60-66Gy/30-33/6-7周)2个周期,疗效评价PR,转入巩固治疗阶段。治疗期间患者曾出现白细胞减少、血小板减少、疲乏等不良事件,最高为3级(白细胞减少),重组人粒细胞集落刺激因子(rhG-CSF)支持治疗后缓解,其它不良事件均为1-2级。
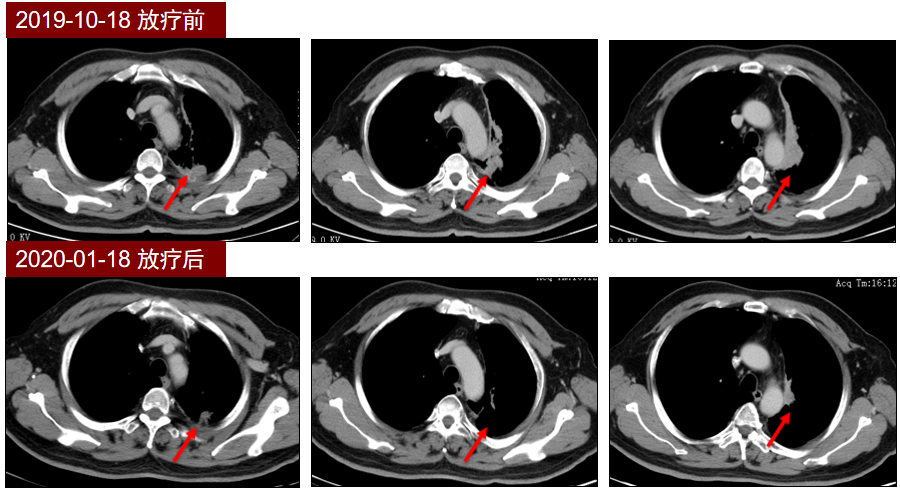
2020年3月,患者开始使用重组人血管内皮抑制素持续泵入(30mg/d,D1-7),联合PD-L1抑制剂度伐利尤单抗(Durvalumab)联合行巩固治疗,治疗3月后复查,疗效评价SD,持续原方案巩固治疗至今,最近一次复查疗效评价仍为SD。
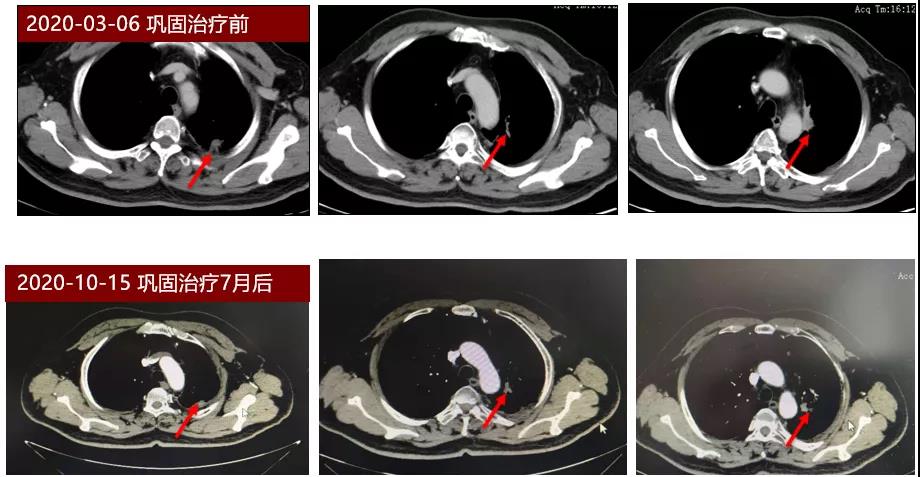
从该患者诊疗过程可见,重组人血管内皮抑制素用于不可切除局晚期NSCLC疗效良好,在初始阶段联合同步放化疗、巩固治疗阶段联合PD-L1抗体均取得较好疗效,带来明显的临床获益,且患者治疗副作用较少,依从性好,生活质量较高。
病例提供专家

甘肃省肿瘤医院放疗二科 主治医师
2011年取得四川大学华西临床医学院肿瘤放疗专业硕士
胸部肿瘤放射治疗(肺癌、食管癌、乳腺癌等)。发表论文SCI2篇,国内核心期刊3篇
宋海侠教授点评
不可切除局晚期NSCLC仍属于“有望治愈”的阶段,近年来治疗进展迅速,如PACIFIC研究最早确立了PD-L1抑制剂度伐利尤单抗的“免疫巩固治疗”模式,但进入我国相对较晚,且免疫治疗费用高昂,在临床实践中的推广受限。
本例IIIB期患者起始治疗应用重组人血管内皮抑制素联合同步放化疗,实现肿瘤部分缓解,巩固治疗阶段应用了重组人血管内皮抑制素联合 PD-L1抑制剂度伐利尤单抗,达到较好的疾病控制效果,目前PFS已接近12个月,疗效已超过传统同步放化疗阶段的中位PFS,有望接近PACIFIC研究中度伐利尤单抗治疗组17.2个月的中位PFS[1]。
在规范同步放化疗的基础上,灵活高效使用抗血管治疗和免疫治疗,是进一步提升不可切除局晚期NSCLC患者预后的关键,随着相关领域临床研究的不断推进,相信将有更多患者迎来治愈和长期生存。
参考文献:
[1] Antonia S J, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage III non–small-cell lung cancer[J]. New England Journal of Medicine, 2017, 377(20): 1919-1929.