KEYNOTE-177全文发表,MSI-H/dMMR晚期结直肠癌一线免疫治疗带给我们哪些启示?
研究背景
错配修复缺陷(dMMR)结直肠癌占所有结直肠癌的15%(其中12%为散发病例,3%为遗传性病例),约80%的散发性dMMR结直肠癌是由MLH1基因启动子的甲基化引起的,而超过70%的遗传性病例与MLH1和MSH2基因的胚系突变有关。错配修复缺陷的细胞无法识别和修复自发突变,导致很高的肿瘤突变负荷(TMB)以及微卫星序列的改变,从而引起高微卫星不稳定性(MSI-H)。越来越多的证据表明,MSI-H/dMMR肿瘤对常规化疗反应较差,但迄今为止尚无定论,化疗仍是MSI-H/dMMR结直肠癌患者的标准一线治疗。
在既往治疗失败的患者中,程序性死亡1(PD-1)阻断剂对MSI-H或dMMR的肿瘤具有临床获益。但与化疗相比,PD-1阻断剂在MSI-H/dMMR晚期或转移性结直肠癌一线治疗中的疗效尚不清楚。
KEYNOTE-177研究是一项随机、开放标签的Ⅲ期临床试验,旨在评估与一线标准化疗相比,帕博利珠单抗在MSI-H/dMMR转移性结直肠癌患者中的疗效与安全性。
研究方法
该研究在23个国家/地区的192个中心进行。
研究的入组标准为:18岁或以上,MSI-H/dMMR的Ⅳ期结直肠癌,根据RECIST 1.1标准具有可测量病灶,ECOG评分为0或1,术后辅助化疗需在随机分组之前至少6个月完成。
按1∶1比例将患者随机分配至帕博利珠单抗组(200 mg iv q3w)和化疗组,化疗方案包括:mFOLFOX6(氟尿嘧啶+奥沙利铂)方案、mFOLFOX6加贝伐珠单抗或mFOLFOX6加西妥昔单抗;FOLFIRI(氟尿嘧啶+伊立替康)方案、FOLFIRI加贝伐珠单抗或FOLFIRI加西妥昔单抗。
主要研究终点有2个,为无进展生存期(PFS)和总生存期(OS)。次要研究终点为根据RECIST 1.1标准评估的总缓解(完全缓解+部分缓解)。探索性终点包括由RECIST 1.1标准评估的缓解持续时间(从第一次完全或部分缓解到首次疾病进展的时间)。
研究结果
患者和治疗信息
2016年2月11日至2018年2月19日间,共852例患者进行筛查,307例被随机分配至帕博利珠单抗组(153例患者)或化疗组(154例),化疗组有11例患者未开始试验治疗。两组间基线特征平衡。
患者的中位年龄为63岁(24~93岁),209例(68%)为右半结肠癌,153例(50%)为新诊断的结直肠癌,77例(25%)伴有BRAF V600E突变。截止2020年2月19日,中位随访32.4个月(24.0~48.3个月)。帕博利珠单抗组中有153例、化疗组中有143例患者接受了至少一剂试验治疗。帕博利珠单抗组的中位治疗持续时间为11.1个月(0.0~30.6个月),化疗组为5.7个月(0.1~39.6个月)。
主要研究终点
帕博利珠单抗组的中位PFS为16.5个月(95%CI:5.4~32.4个月),化疗组为8.2个月(95%CI:6.1~10.2个月),HR=0.60(95%CI:0.45~0.80;P=0.0002)(图1)。
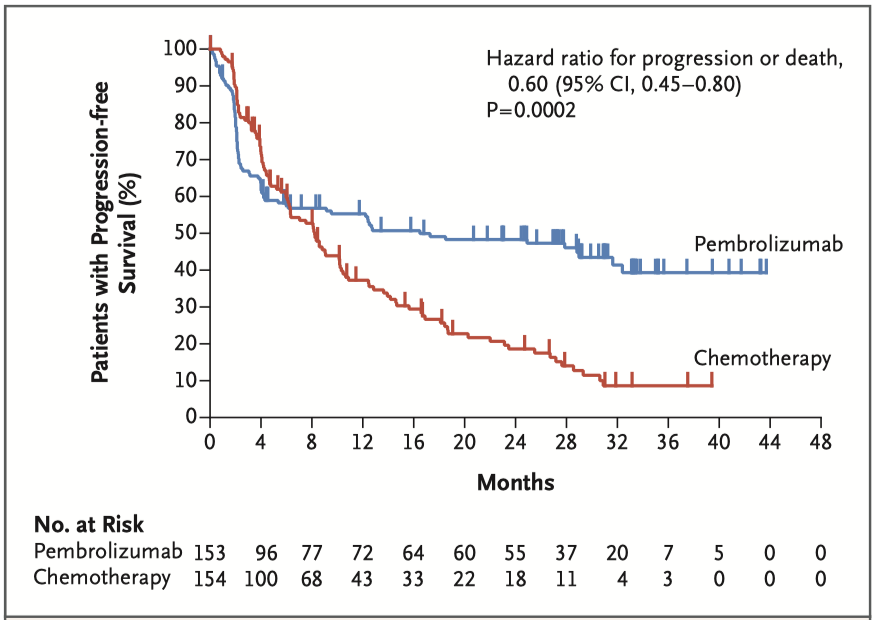
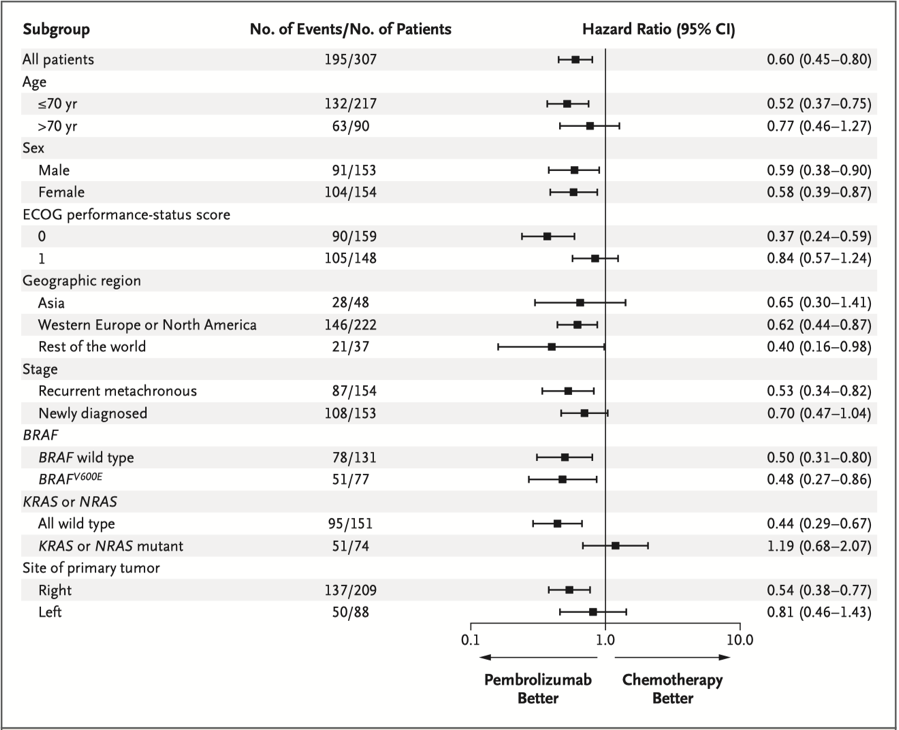
估计帕博利珠单抗组和化疗组12个月时存活和无进展患者的比例分别为55.3%和48.3%,50%和18.6%。由于不符合比例风险假设,因此进行了限制性平均生存时间分析。帕博利珠单抗组估计的2年限制性平均生存时间为13.7个月,化疗组为10.8个月。在主要预设的亚组中,帕博利珠单抗组的PFS均长于化疗组(图2)。
疗效评估及疗效持续时间
帕博利珠单抗组患者的总缓解(完全缓解+部分缓解)率为43.8%(95%CI:35.8%~52.0%),化疗组为33.1%(95%CI:25.8%~41.1%),两组分别有11%和4%的患者达到完全缓解(表1)。
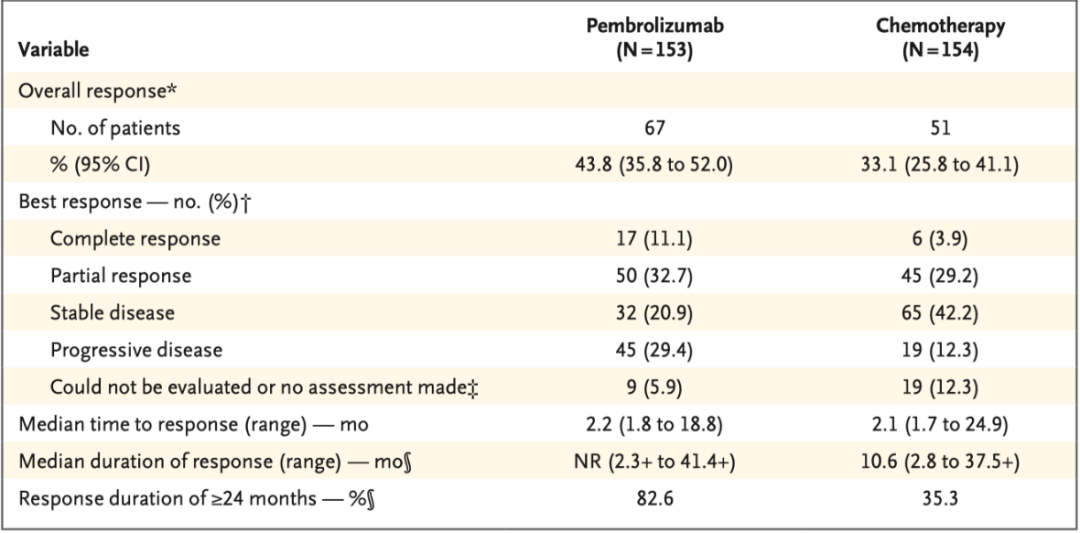
在24个月时达到过完全或部分缓解的患者中,帕博利珠单抗组有83%的患者继续缓解中,化疗组这一比例为35%。帕博利珠单抗组的中位缓解持续时间尚未达到,化疗组为10.6个月(2.8~37.5+月)。帕博利珠单抗组和化疗组分别有14例(9%)和13例(8%)患者在初治阶段进行了根治性手术。
生存结局
一共出现了125个生存事件,帕博利珠单抗组和化疗组分别有56例和69例患者死亡,评估主要研究终点需继续随访直至190个生存事件发生或第二次中期分析结束后1年。OS的评估需考虑到跨组的因素,化疗组有56例(36%)患者在疾病进展后交叉至帕博利珠单抗组,另有35例化疗组患者在研究以外接受了帕博利珠单抗治疗,意向性治疗人群总体的交叉率为59%。
安全性
帕博利珠单抗组和化疗组分别有149例(97%)和142例(99%)患者出现不良反应。帕博利珠单抗组出现3级或以上不良事件的比例为56%,化疗组为78%。最常见的不良反应为中性粒细胞计数减少(0%对17%),中性粒细胞减少(0%对15%)和腹泻(6%对11%)。两组分别有21例(14%)和17例(12%)由于不良事件终止治疗。帕博利珠单抗组中有6例(4%)、化疗组中有7例(5%)发生了5级不良事件。帕博利珠单抗组和化疗组分别有47例(31%)和18例(13%)患者发生了免疫介导的不良事件和输注反应,未观察到5级免疫相关不良事件。
研究结论与讨论
帕博利珠单抗疗效的确切性
KEYNOTE-177随机Ⅲ期临床试验表明,MSI-H/dMMR转移性结直肠癌患者一线使用帕博利珠单抗的PFS优于化疗。该试验还提供了关于在MSI-H/dMMR转移性结直肠癌患者中采用单独化疗或与贝伐珠单抗或西妥昔单抗联合作为一线治疗的PFS的前瞻性数据——化疗组的中位PFS为8.2个月,总缓解率为33.1%,与既往数据相一致,表明了MSI-H/dMMR转移性结直肠癌患者的化疗疗效有限。此外,影像学评估提示帕博利珠单抗组的总缓解率和完全缓解率更高,但帕博利珠单抗组疾病进展的比例也更高(29.4%对12.3%)。PFS的Kaplan-Meier曲线显示帕博利珠单抗组和化疗组的曲线明显分离,意味着使用帕博利珠单抗有长期获益的可能。
联合方案提高疗效的可行性
有研究报道在PD-1阻滞剂治疗MSI-H/dMMR肿瘤的第一个月有许多与疾病进展有关的标志物,包括肿瘤突变负荷低、Janus激酶突变、β-2微球蛋白丢失(可能会削弱MLH-I的抗原呈递)、误诊MSI-H/dMMR和假进展,但尚无定论。KEYNOTE-177研究中,伴有RAS基因热点突变的患者使用帕博利珠单抗没有明显的PFS获益,尽管耐药机制尚不清楚,但可以合理地假设在PD-1阻滞剂中加入化疗或抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)可以克服这种情况。但是,由于大多数患者使用帕博利珠单抗单药即可达到临床缓解,因此必须评估这些联合方案的毒副作用。
在所有患者中检测MMR状态的必要性
KEYNOTE-177研究中,大约三分之一的患者肿瘤位于左半结肠,这提示了在所有结直肠癌患者中都检测MSI-H/dMMR的重要性,而不仅仅局限于右侧肿瘤。其次,尽管大部分MSI-H/dMMR肿瘤是遗传性的,但由于研究者未获得胚系检测的知情同意,因此无法确定遗传性与散发性肿瘤对PD-1阻滞剂的反应是否有区别。但是,BRAFV600E突变可视为散发性dMMR的标志,结果显示BRAFV600E突变型和野生型的MSI-H/dMMR肿瘤患者从PD-1阻滞剂中有同样的获益,但需要进一步的研究来评估。
总体而言,KEYNOTE-177研究的数据意味着以MSI-H-dMMR结直肠癌的生物标志物驱动的研究又迈出了一步。对于MSI-H-dMMR的转移性结直肠癌患者应考虑使用帕博利珠单抗作为一线治疗方案。
参考文献
André T, Shiu KK, Kim TW, et al. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer. N Engl J Med. 2020,383(23):2207-2218.
