重组人血管内皮抑制素超说明书用药情况如何?新共识带来指导意见
非小细胞肺癌(NSCLC)是肺癌中最常见的组织学类型,在肺癌病例中占比超过80%[1]。由于NSCLC的侵袭性较高,且缺乏有效的早期筛查方案,导致我国68%的肺癌患者确诊时已是晚期[2]。以铂类为基础的双药化疗方案是治疗晚期NSCLC的传统标准方案,但对应的5年生存率依然不足5%[3]。在过去几十年间,越来越多的证据显示新生血管生成在多种实体肿瘤的生长、增殖和转移中发挥着关键作用[4]。
重组人血管内皮抑制素(商品名:恩度)是我国第一个自主研发上市的静脉用抗血管生成靶向药物,原国家食品药品监督管理总局批准的适应证为联合长春瑞滨加顺铂(NP) 化疗方案用于治疗初治或复治的Ⅲ/Ⅳ期NSCLC 患者。但由于抗血管生成药物在机制层面具有普遍的抗肿瘤作用,且重组人血管内皮抑制素在基础研究和临床研究中均显示了对其他多个瘤种的良好疗效和安全性,逐步在适应证外的多个瘤种中获得了临床应用。
为了全面汇总循证医学证据,更合理地将重组人血管内皮抑制素应用于临床,“医学界”有幸邀请到浙江大学医学院附属邵逸夫医院潘宏铭教授就《重组人血管内皮抑制素超说明书用药专家共识》[5](下文简称“共识”)进行探讨和分享。

图1:共识截图
点击观看潘宏铭教授精彩视频
专家简介

潘宏铭教授
浙江大学医学院附属邵逸夫医院副院长,浙江大学求是特聘医师、教授、博士导师,肿瘤内科主任。1997年在美国Loma Linda 大学肿瘤中心进修肿瘤内科学,2008年在美国Mayo Clinic肿瘤中心做高级访问学者。兼任国家新药审评专家,国家合理用药专家委员会委员,卫生部胃癌诊治规范制定专家, 中国抗癌协会肿瘤靶向治疗专业委员会候任主任委员,中国临床肿瘤学会常务理事,中国肿瘤营养治疗专家委员会主任委员,CSCO支持和康复专家委员会候任主任委员,浙江省肿瘤靶向治疗技术指导中心主任。主要从事恶性肿瘤的诊断、内科治疗和射频消融治疗。已发表中英论文120余篇(其中英文论文70多篇),主持和参加国际多中心抗癌药物临床试验170多项,主编《肿瘤化疗的毒副反应和防治》、《肿瘤内科诊治策略》和《肿瘤内科合理治疗和用药技巧》等专著。主持制订《中国肿瘤患者营养治疗指南》、《消化道肿瘤合理用药指南》等。正在主持国家重大新药创制专项和国家自然科学基金3项和浙江省重大科技专项、重点基金和省部共建项目10多项。
重组人血管内皮抑制素上市多年,
临床经验积累丰富
抗血管生成药物在全球被广泛批准用于治疗各种肿瘤。当前NSCLC的抗血管生成治疗药物主要包括三大类:靶向VEGF-血管内皮生长因子受体(VEGFR)的大分子单克隆抗体、靶点包括VEGFR的多靶点小分子TKI、重组人血管内皮抑制素。
潘教授指出,重组人血管内皮抑制素为血管生成抑制药,主要是通过抑制形成血管的内皮细胞迁移而抑制肿瘤新生血管的生成,阻断肿瘤细胞的营养供给,从而抑制肿瘤增殖或转移。
“重组人血管内皮抑制素是我国第一个自主研发上市的静脉用抗血管生成靶向药物,上市时间为2005年9月,目前已有超过15年的临床使用经验,临床疗效确切,安全性可控。目前,重组人血管内皮抑制素联合化疗、免疫治疗已经成为临床的用药趋势。”潘教授对于重组人血管内皮抑制素在国内的应用情况给予了疗效和安全性的肯定。
说明书有一定滞后性,
临床实践需综合考虑用药
作为该共识的起草专家组成员之一,关于编写和制定共识的原因,潘教授指出,“从专家层面和指南层面,我们首先都应该遵循药品说明书中的标准用法。但是,由于研究进展迅速,说明书的修改审批是一个漫长的过程,有一定的滞后性。因此,在临床中超说明书用药的现象是存在的。”
潘教授介绍到,国家卫健委曾出台《新型抗肿瘤药物使用原则》,其中也指出:药品说明书往往滞后于临床实践,一些具有高级别循证医学证据的用法未能及时在药品说明书中明确规定的情况,《指导原则》表示特殊情况下抗肿瘤药物使用采纳根据,依次是:其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、指南,国家级学协会发布的经国家卫生健康委员会认可的诊疗规范、指南。
潘教授表示,说明书中重组人血管内皮抑制素联合长春瑞滨加顺铂化疗方案用于治疗初治或复治的Ⅲ/Ⅳ 期NSCLC 患者的用法用量为:每次给予7.5 mg·m-2 (1.2×105 U·m-2),每日1次,连续给药14 d,休息7 d,再继续下一周期治疗。通常可进行2~4个周期的治疗。临用时加入500 mL生理盐水中,匀速静脉点滴,滴注时间3~4 h,本品每天给药1次。
近些年,随着研究证据的积累,结合抗血管生成药物包括重组人血管内皮抑制素在内的最新研究进展,通过制定共识来规范化指导重组人血管内皮抑制素在临床中超说明书用药使用是有必要的。
权衡利弊,合理指导重组人血管内皮抑制素
超说明书用药使用
潘教授指出,“因在临床中重组人血管内皮抑制素联合化疗会存在多种情况,可能是吉西他滨联合顺铂、培美曲塞联合顺铂。说明书中的用法仅限于重组人血管内皮抑制素联合长春瑞滨加顺铂用药,而在共识中,有一条非常重要的意见就是推荐‘重组人血管内皮抑制素联合含铂双药化疗用于晚期NSCLC一线治疗’,共识进一步扩大了重组人血管内皮抑制素联合化疗的用药范围。”
这主要是基于上市后开展的单臂、开放性、大样本、多中心的Ⅳ期临床研究评估了重组人血管内皮抑制素联合4种常用的含铂化疗方案治疗晚期 NSCLC 的临床疗效与安全性。该研究共入组2725例Ⅲ/Ⅳ期NSCLC患者,最终结果显示中位疾病进展期(TTP)为7.4个月,中位总生存期(OS)为17.6个月,1年和2年生存率分别为63.7%和39.8%[6]。此外,多项meta分析显示重组人血管内皮抑制素联合化疗治疗晚期NSCLC具有较高的客观缓解率(ORR) 和疾病控制率(DCR),并能延长疾病进展时间,改善生活质量[7-9];多项专家共识推荐重组人血管内皮抑制素联合含铂双药化疗一线用于治疗晚期NSCLC[10-12]。
在NSCLC领域,共识推荐重组人血管内皮抑制素联合化疗方案用于Ⅲ/Ⅳ期驱动基因阴性或不详的非鳞状NSCLC。除此之外,在黑色素瘤、骨肉瘤、鼻咽癌、乳腺癌、食管癌等领域,重组人血管内皮抑制素也有相应的超说明用药推荐(表1)。
表1:重组人血管内皮抑制素超说明书用药总表
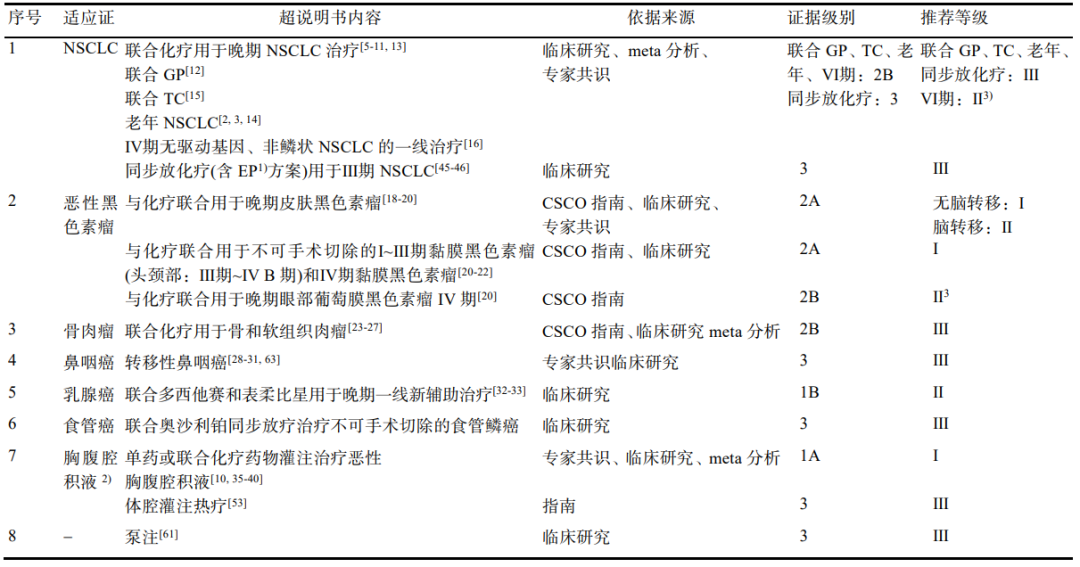
潘教授表示,“值得注意的是,共识以‘1A,I级’推荐重组人血管内皮抑制素单药或联合化疗用于恶性胸腹腔积液治疗,这属于共识中最高级别的推荐意见。这也表明重组人血管内皮抑制素治疗恶性胸腹腔积液有较强的循证支持和确切的疗效。”
这主要是基于秦叔逵等开展的一项前瞻性、随机对照、全国多中心Ⅲ期临床研究探讨了腔内应用重组人血管内皮抑制素和/或顺铂治疗恶性胸腹腔积液的有效性和安全性。研究分为重组人血管内皮抑制素单药组、顺铂单药组与两药联合组,结果显示联合组拥有更高的ORR,高达63.00%,而重组人血管内皮抑制素单药组为48.51%,顺铂单药组为 46.39%(P=0.0373)[13]。
最后,潘宏铭教授告诉“医学界”:共识的制定并不是鼓励重组人血管内皮抑制素在临床中超说明书使用。而是在临床治疗过程中,当有超说明书用药情况时,希望共识能够为医务人员提供合理规范的指导。此外,超说明用药仍需要根据患者的病情、治疗情况、用药选择来权衡利弊,当认为临床确有需要,又无合理的可替代药物时,且获得患者的知情同意后,由医师申请,医务科与药剂科审核并经药事管理与药物治疗学委员会、医院伦理委员会审批并备案后方可使用。
参考资料:
[1] Cufer T, Knez L. Update on systemic therapy of advanced non-smallcell lung cancer[J]. Expert Rev Anticancer Ther, 2014, 14(10): 1189-1203.
[2] Han BH. Epidemiology of lung cancer by molecular subtype in China. Presented by Baohui Han, 16th WCLC, 2015.
[3] Gettinger S, Horn L, Jackman D, et al. Five-year follow-up of nivolumab in previously treated advanced non-small-cell lung cancer[J]. N Engl J Med, 2015, 36(17): 1675-1684.
[4] Angiogenesis and lung cancer: prognostic and therapeutic implications[J]. J Clin Oncol, 2005, 23(14): 3243-3256.
[5] 重组人血管内皮抑制素超说明书用药编写专家组. 重组人血管内皮抑制素超说明书用药专家共识[J]. 中国现代应用药学.2020.37(14):1665-1673.
[6] QIN S K, MIAO J, HAN B H, et al. Safety and efficacy of recombinant human endostatin(Endostar? ) in combination with platinum-based doublet chemotherapy for the treatment of advanced non-small cell lung cancer: A national wide, open, multi-center, and phase Ⅳ clinical study [J]. Chin Clin Oncol(临床肿瘤学杂志), 2019, 24(4): 289-298.
[7] RONG B X, YANG S Y, LI W, et al. Systematic review and meta-analysis of Endostar(rh-endostatin) combined with chemotherapy versus chemotherapy alone for treating advanced non-small cell lung cancer [J]. World J Surg Oncol, 2012, 10(1): 1-12.
[8] WANG J, GU L J, FU C X, et al. Endostar combined with chemotherapy compared with chemotherapy alone in the treatment of nonsmall lung carcinoma: A meta-analysis based on Chinese patients [J]. Indian J Cancer, 2014(51 Suppl 3): e106-e109.
[9] GE W, CAO D D, WANG H M, et al. Endostar combined with chemotherapy versus chemotherapy alone for advanced NSCLCs: A meta-analysis [J]. Asian Pac J Cancer Prev, 2011, 12(11): 2901-2907.
[10] ZHI X Y, SHI Y K, YU J M. Standards for the diagnosis and treatment of primary lung cancer(2015 version) in China [J]. Chin J Oncol(中华肿瘤杂志), 2015, 37(1): 67-78.
[11] 中华医学会呼吸病学分会肺癌学组, 中国肺癌防治联盟. 晚期非小细胞肺癌抗血管生成药物治疗中国呼吸领域专家 共识(2016 年版)[J]. 中华结核和呼吸杂志, 2016, 39(11): 839-849.
[12] HAN B H, LI K, ZHOU C C, et al. Chinese expert consensus on antiangiogenic drugs for advanced non-small cell lung cancer(2019 edition) [J]. Chin J Lung Cancer(中国肺癌杂志), 2019, 22(7): 401-412.
[13] QIN S K, YANG L Q, LIANG J, et al. Intra-pleural injection of recombinant human endostatin and/or cisplatin in treatment of malignant hydrothorax and ascites: A multicenter randomized controlled trial [J]. Chin Clin Oncol(临床肿瘤学 杂志), 2017, 22(3): 193-202.
[13] QIN S K, YANG L Q, LIANG J, et al. Intra-pleural injection of recombinant human endostatin and/or cisplatin in treatment of malignant hydrothorax and ascites: A multicenter randomized controlled trial [J]. Chin Clin Oncol(临床肿瘤学 杂志), 2017, 22(3): 193-202.