肺癌靶向药物临床应用更新要点
本文是2020版新型抗肿瘤药物临床应用指导原则较2019年的更新要点(呼吸系统部分)
1.肿瘤药物临床应用需考虑的要素除了药物可及性、患者治疗意愿,又增加了疾病预后。
2. 肺癌抗肿瘤治疗增加了需要检测靶点的药物:阿美替尼。
3. 肺癌抗肿瘤治疗增加了不需要检测靶点的药物:度伐利尤单抗、卡瑞利珠单抗、阿替利珠单抗(注意:肺癌中,纳武利尤单抗 、帕博利珠单抗 、卡瑞利珠单抗需排除 EGFR 突变和 ALK 融合的患者;帕博利珠单抗单药使用前需检测 PD-L1 表达)。
4. 在抗肿瘤药物临床应用过程中,发现新的高级别循证医学证据但药品说明书中未体现的,医疗机构和医务人员可及时向药品生产厂商反馈,建议其主动向国家药品监督管理部门申报,及时更新相应药品说明书,以保证药品说明书的科学性、权威性,有效指导临床用药。
5. 抗肿瘤药物的效价比改为:成本-效果比。删除了抗肿瘤药物的分级(普通使用级和限制使用级)。
6. 在特殊情况下抗肿瘤药物循证医学证据采纳根据增加了国家级学协会发布的经国家卫生健康委员会认可的临床路径。
7. 在厄洛替尼合理用药方面增加:在美国,厄洛替尼获批与吉西他滨联合用于局部晚期、无法切除或转移性胰腺癌的一线治疗,目前国内尚未获批此适 应证,可在与患者充分沟通的情况下使用。用法为 l00mg,每 人一次。
8. 在埃克替尼合理用药方面增加:埃克替尼对CYP2C9 和 CYP3A4 有明显的抑制作用,与该代谢酶诱导剂和底物药物合用时应注意潜在的药物相互作用。
9. 在奥西替尼合理用药方面增加:避免与BCRP 底物以及 P-gp 底物联合使用。
10. 在克唑替尼合理用药方面增加:应避免合并使用 CYP3A 强抑制剂或 CYP3A 强诱导剂, 如果无法避免合并使用 CYP3A 强抑制剂,应减少克唑替尼的 剂量。应谨慎与中度 CYP3A 抑制剂合并用药。
11. 塞瑞替尼的适应症增加了一线治疗:由本品适用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的 ALK 阳性的局部晚期或转移性 NSCLC 患者改为:ALK 阳性的局部晚期或转移性 NSCLC 患者的治疗。
12. 肺癌增加了靶向药物:阿美替尼 Almonertinib
制剂与规格:片剂:55mg
适应证:既往经 EGFR-TKI 治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR-T790M 突变阳性的局部晚期或转移性 NSCLC成人患者的治疗。
合理用药要点:
(1).阿美替尼推荐剂量为 110mg,每天一次口服,空腹或餐后服用均可,整片吞服,不要咀嚼或压碎。对于无法整片吞咽药物和需经鼻胃管喂饲的患者,可将药片直接溶于不含碳酸盐的饮用水中完全分散后服用。
(2).用药前必须明确有经国家药品监督管理局批准的检测方法检测到 EGFR-T790M 突变。肿瘤组织和血液均可用于 EGFR 突变检测,组织检测优先。
(3).阿美替尼常见不良反应为皮疹(18%)、血肌酸磷酸激酶升高(17%)和瘙痒(12.7%)等,腹泻的发生率相对较低(6.7%)。推荐剂量下迄今无间质性肺炎的发生,但仍需在服药期间注意。
(4).避免与 CYP3A4 强诱导剂和强抑制剂联合使用,应慎用为 BCRP 和 P-gp 敏感底物的窄治疗窗药物。避免与升高血肌酸磷酸激酶的药物(如他汀类药物)联合使用。
13. 贝伐珠单抗合理用药方面增加:在联合铂类化疗6周期后,除了可以单药维持治疗外,也可以与可用于维持治疗的化疗药物如培美曲塞联合维持治疗,直至疾病进展或出现不可耐受的毒性。在需要暂停贝伐珠单抗的各种情况中增加了:手术后至少 28 天及伤口完全恢复之前。
14. 在纳武利尤单抗合理用药方面,对重度肝功能异常的规定改变:
2019版为:总胆红素>3 倍 ULN 和任何 AST。
2020版为:总胆红素、ALT 或 AST>3 倍正常值上限。
15. 帕博利珠单抗适应症增加了:帕博利珠单抗联合卡铂和紫杉醇适用于转移性鳞状 NSCLC 患者的一线治疗。合理用药方面增加了:美国 FDA 还批准帕博利珠单抗单药用于治疗成 人和儿童不可切除或转移性 MSI-H 或错配修复缺陷的实体瘤 以及肿瘤突变负荷高(TMB-H)的无法切除或转移性实体瘤(包括小细胞肺癌)。美国 FDA 批准的用法除每次 200mg、每 3 周一次之外,还包括每次 400mg,每 6 周一次。目前国内尚未获批这些适应证,可在与患者充分沟通的情况下、按照 FDA 批准的用法正确使用。
16. 肺癌增加了不需要检测靶点药物:度伐利尤单抗 Durvalumab
制剂与规格:注射液:120mg(2.4ml)/瓶、500mg(10ml) /瓶
适应证:度伐利尤单抗适用于在接受铂类药物为基础的化疗同步放疗后未出现疾病进展的不可切除、Ⅲ期 NSCLC 患者的治疗。
合理用药要点:
(1).度伐利尤单抗的使用方法是 10mg/kg,静脉注射给药, 每 2 周一次,每次输注需超过 60 分钟,直至出现疾病进展 或不能耐受的毒性。最长使用不超过 12 个月。
(2).对于疑似免疫相关性不良反应,应进行充分的评估以 确认病因或排除其他病因。根据免疫相关性不良反应的类型 和严重程度,暂停给药或永久停药,不建议增加或减少剂量。
(3).尚未确立度伐利尤单抗在 18 岁以下儿童及青少年中 的安全性和有效性。老年患者(≥65 岁)、轻度肝功能损伤患者、轻度和中度肾功能损伤患者,均无需进行剂量调整。在中重度肝功能损伤患者、重度肾功能损伤患者中使用的安全性及有效性尚未建立,如经医师评估使用本品预期获益大于风险,需在医师指导下谨慎使用。
( 4).美国 FDA 还批准了度伐利尤单抗联合依托泊苷/卡铂或顺铂用于广泛期小细胞肺癌的一线治疗,目前国内尚未获 批此适应证,可在与患者充分沟通的情况下使用。用法为1500mg 固定剂量,与依托泊苷/卡铂或顺铂联用时,应首先给予度伐利尤单抗,每 3 周一次;与化疗联用结束后每 4 周 一次,单药维持至疾病进展。
17. 肺癌增加了不需要检测靶点药物:卡瑞利珠单抗 Camrelizumab
制剂与规格:粉针剂:200mg/瓶
适应证:卡瑞利珠单抗联合培美曲塞和卡铂适用于EGFR 基因突变阴性和 ALK 阴性的、不可手术切除的局部晚期或转移性非鳞 NSCLC 的一线治疗。
合理用药要点:
(1).用药前必须明确诊断为EGFR 突变阴性和 ALK 阴性的非鳞 NSCLC。
(2).应该按照相关疾病指南,治疗前做基线评估,治疗期间定期监测治疗反应及毒性。
(3).本品采用静脉输注的方式给药,静脉输注的推荐剂量为200mg,每次持续 30~60 分钟,每 3 周给药一次,直至疾病进展或出现不可接受的毒性。当卡瑞利珠单抗联合化疗给药时,应首先给予卡瑞利珠单抗静脉滴注,间隔至少 30 分钟后再给予化疗。
(4).有可能观察到非典型反应。如果患者临床症状稳定或持续减轻,即使有疾病进展的初步证据,基于总体临床获益的判断,可考虑继续应用本品治疗,直至证实疾病进展。
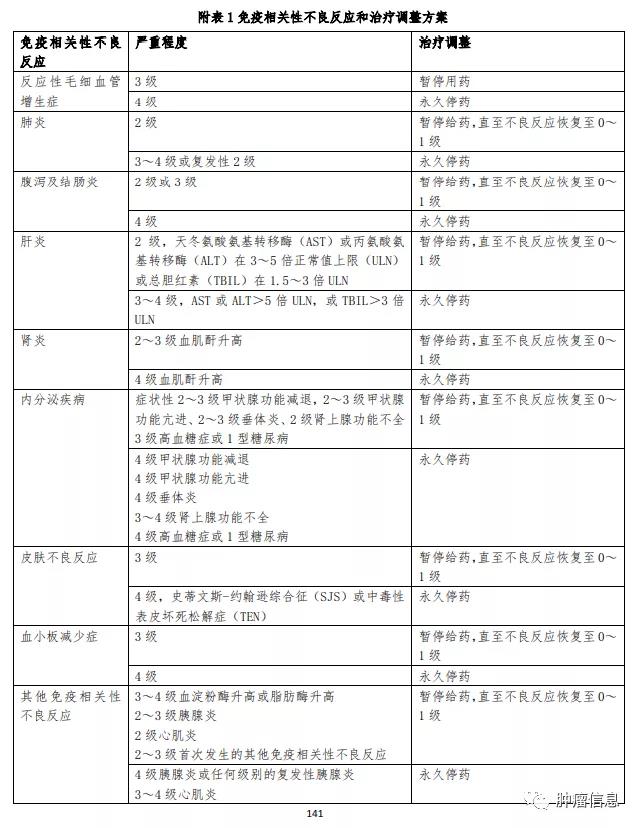
(5).如出现免疫相关性不良反应,根据个体患者的安全性和耐受性,可能需要暂停给药或永久停药。不建议增加或减 少剂量。有关暂停给药和永久停药的指南,详见附表 1 所述。
(6).目前本品尚无针对中重度肝功能损伤患者的研究数据,中重度肝功能损伤患者不推荐使用。轻度肝功能损伤患 者应在医师指导下慎用本品,如需使用,无需进行剂量调整。
(7).目前本品尚无针对中重度肾功能损伤患者的研究数据,中重度肾功能损伤患者不推荐使用。轻度肾功能损伤患 者应在医师指导下慎用本品,如需使用,无需进行剂量调整。
(8).本品尚无在 18 岁以下儿童及青少年中的安全性和有效性数据。
(9).本品在≥65 岁的老年患者中应用数据有限,建议在医师的指导下慎用,如需使用,无需进行剂量调整。
(10).不建议在妊娠期间使用本品治疗。
(11).因可能干扰本品药效学活性,应避免在开始本品治 疗前使用全身性糖皮质激素及其他免疫抑制剂。但是如果为了治疗免疫相关性不良反应,可在开始本品治疗后使用全身 糖皮质激素及其他免疫抑制剂。
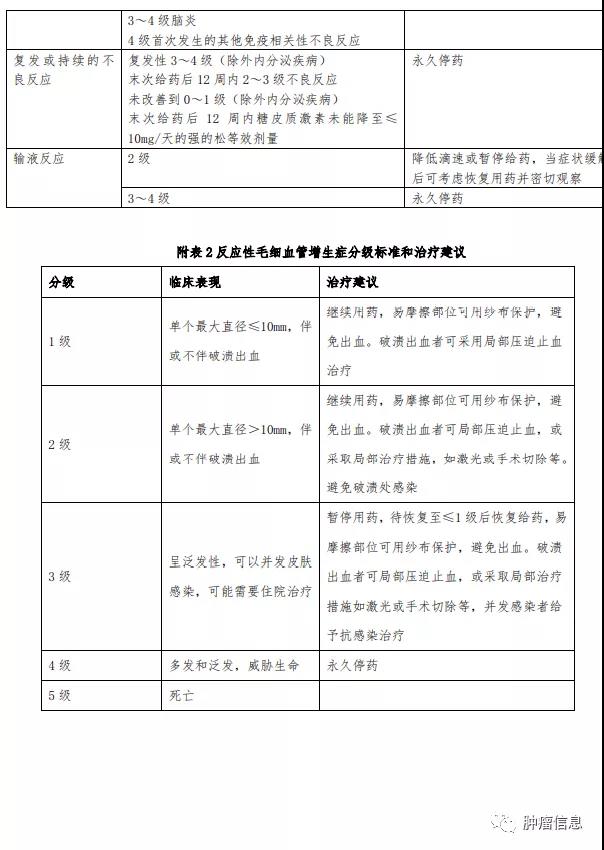
(12).反应性毛细血管增生症的处理:在接受本品治疗的患者中,共 731 例(74.1%)发生反应性毛细血管增生症。反应性毛细血管增生症,大多发生在体表皮肤,少数可见于口腔黏膜、鼻腔黏膜以及眼睑结膜。发生于皮肤的反应性毛细血管增生,初始多表现为体表鲜红色点状物,直径≤2mm, 随着用药次数增加,病变范围可逐渐增大,多为结节状,也有斑片状,颜色鲜红或暗红,需观察临床症状和体征,可按 照附表 2 分级标准和治疗建议进行处理。当患者出现该不良反应时,应避免抓挠或摩擦,易摩擦部位可用纱布保护以避免出血,同时应联系主管医师,获得 恰当的处理建议。破溃出血者可采用局部压迫止血,或采取 如激光或手术切除等局部治疗;并发感染者应给予抗感染治疗。反应性毛细血管增生症可能在皮肤以外的其他组织发生(包括内脏器官),必要时进行相应的医学检查,如大便潜血、内窥镜及影像学检查(具体相关内容详见《反应性毛细 血管增生症信息收集及风险管理计划》)。
18. 肺癌增加了不需要检测靶点药物:阿替利珠单抗 Atezolizumab
制剂与规格:注射液:1200mg(20ml)/瓶
适应证:阿替利珠单抗与卡铂和依托泊苷联合用于广泛期小细胞肺癌患者的一线治疗。
合理用药要点:
(1).阿替利珠单抗的用法是固定剂量 1200mg,通过静脉注射给药,诱导期联合卡铂和依托泊苷方案每 3 周一次,治疗 4个周期后进入无化疗的维持期;首次给药至少持续60分钟, 后续可至少 30 分钟。
(2).患者可接受阿替利珠单抗治疗直至无临床获益或出现不可接受的毒性。如果患者临床症状稳定,即使有疾病进展的初步证据,但基于总体临床获益的判断,可考虑继续应用本品治疗。应对疾病进展后继续使用阿替利珠单抗治疗的患者开展密切监测,4~8 周内重复肿瘤疗效评估。
(3).对于疑似免疫相关性不良反应,应进行充分的评估以确认病因或排除其他病因。根据免疫相关性不良反应的类型和严重程度,可能需要暂停给药或永久停药,不建议增加或减少剂量,详见附表 1。
(4).在使用本品之前应尽量避免使用全身性糖皮质激素或其他免疫抑制剂,因为这些药物可能会影响本品的药效学活性及疗效。但在本品开始给药后,可使用全身性糖皮质激素或其他免疫抑制剂治疗免疫相关性不良反应。在患者接受免疫抑制剂量的糖皮质激素或其他免疫抑制剂治疗期间,不建议重新使用阿替利珠单抗治疗。
(5).尚未确立阿替利珠单抗在 18 岁以下儿童和青少年患 者中的安全性和有效性。老年患者(≥65 岁)、轻度肝功能 损伤患者、轻度和中度肾功能损伤患者,无需调整剂量。在中重度肝功能损伤患者、重度肾功能损伤患者中使用的安全性及有效性尚未建立,如经医师评估使用本品预期获益大于风险,需在医师指导下谨慎使用。
(6).美国 FDA 批准阿替利珠单抗的适应证还包括:尿路上皮癌、NSCLC、三阴性乳腺癌。目前国内尚未获批这些适应证,可在与患者充分沟通的情况下、按照每个瘤肿批准的用法正确使用。