一项单中心研究揭示mTOR抑制剂依维莫司对儿童低级别胶质瘤的初步疗效
儿童低级别胶质瘤(pLGGs)是儿童最常见的中枢神经系统肿瘤。确诊时的中位年龄约为6~8,约7%的患者发病年龄小于1岁。pLGG是一组WHO-I级和WHO-II级胶质细胞来源的肿瘤。其主要治疗手段是手术,约60%的肿瘤可通过手术全切,另有95%以上的肿瘤可行活检术明确病理诊断。但是未能全切的肿瘤仍可能继续进展,约25%~35%的患者需进行辅助治疗,特别是化疗。标准化疗方案为卡铂+长春新碱(CV)方案。放疗仅适用于年龄较大的儿童或经多种治疗手段仍复发的患儿。尽管pLGG的预后较好,但由于疾病本身及治疗产生的后遗症(如放疗带来的认知功能下降、肿瘤恶变等),给患儿、患儿家庭乃至社会造成相当的影响。因此减少治疗副作用和维持生活质量被认为是治疗的主要目标。
LGG的主要分子遗传学改变是MAPK通路的激活。BRAF是该通路中重要的信号分子。大多数肿瘤存在BRAF基因点突变或扩增,并可作为治疗靶点(如维莫非尼、曲美替尼等)。但对于BRAF突变阴性的患者不适用于此类药物。有研究表明,在遗传综合征如结节性硬化症(TS)和神经纤维瘤病Ⅰ型(NF1)相关的pLGGs中存在mTOR的激活,这为临床使用mTOR抑制剂提供了思路。然而,mTOR通路的激活并不局限于与上述遗传综合征相关的pLGGs,包括毛细胞星形细胞瘤、节细胞胶质瘤、DNET、血管中心型胶质瘤等也存在mTOR的激活。
(1)研究方法
2020年新近发表的一项临床研究将依维莫司(Everolimus)作为mTOR/p-mTOR阳性pLGGs的术后一线治疗药物,并评估了该药对儿童低级别胶质瘤患者的有效性及安全性。该研究回顾了意大利罗马Bambino Gesù儿童医院从2014至2019年收治的10例pLGG患者,排除室管膜下巨细胞星形细胞瘤(SEGA)和BRAFV600E突变阳性的肿瘤。所有患者均已接受手术治疗,在条件允许的情况下进行最大范围安全切除,无法手术者接受病理活检。肿瘤标本进行免疫组化染色以分析mTOR表达程度,并进行DNA甲基化分析。
患者口服依维莫司,剂量为5 mg/m2。随后调整剂量,使血药浓度维持在3 - 8 ng/mL之间。不预设治疗周期数。终止治疗的指征为疾病进展和/或严重的4级不良反应。暂停治疗的指征包括2级血小板减少、3级中性粒细胞减少或任何非血液学的3级不良反应。
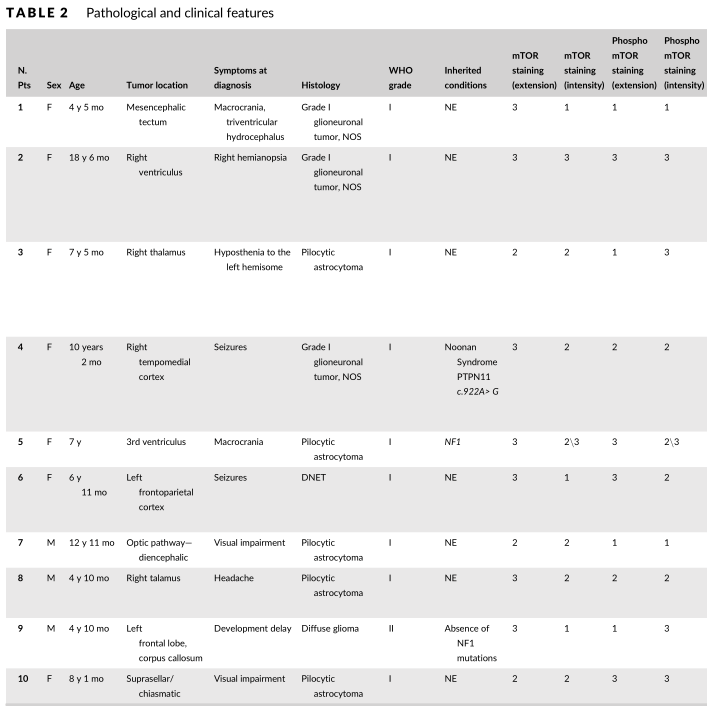
图1:患者的基线特征(包括性别、年龄、肿瘤部位、主要症状、组织学诊断、WHO分级、遗传改变、mTOR染色强度等)
(2)研究结果
共有10名患者(女性7例,男性3例)接受依维莫司治疗。患者的中位确诊年龄为7.3岁(4-18岁)。5例患者治疗前接受病理活检,5例患者治疗前通过手术切除肿瘤。从确诊到开始治疗的时间间隔为21个月(5-40月)。2例患者在MRI显示肿瘤体积增加≥25%后开始治疗,6例患者在没有影像学进展但临床症状加重时开始治疗。治疗至少持续1年,中位治疗时间为19个月(13-60月)。
研究中有1例患者达到PR(肿瘤体积减少≥50%,治疗后18个月);7例患者为SD(平均时间为治疗后9月);2例PD(治疗后18-36月)。未观察到CR病例。随访时间最长的一例患者是一例NF1患者,在60个月时出现SD,之后中断治疗,在12个月的后续随访中疗效评价始终为SD。
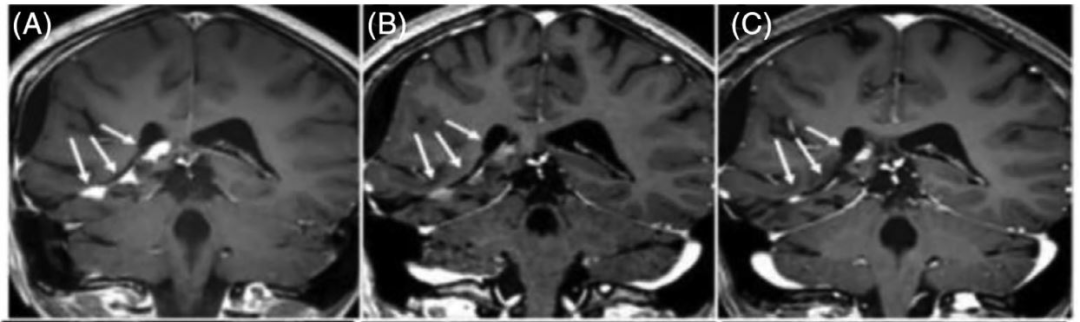
图2: 1例PR患者的病灶改变情况,分别为基线时、治疗18个月和4年时的MRI表现
依维莫司的主要不良反应包括口腔炎、皮肤干燥、脂代谢紊乱、痤疮样皮疹、关节疼痛、呼吸道感染、腹泻、头痛、白细胞计数减低等。1-2级口腔炎和皮肤干燥是最常见的不良反应。2例患者出现3/4级口腔炎。5例患者出现2级脂代谢紊乱(高胆固醇血症或高甘油三酯血症),另分别有1名患者出现3/4级骨关节疼痛和细菌性肺炎。上述不良反应均在依维莫司停药后症状消失,再次应用依维莫司后未出现。未出现因严重不良反应而终止治疗的病例。
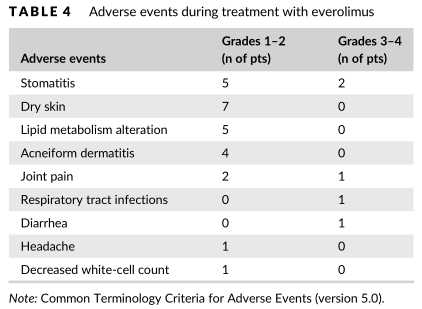
图3:依维莫司的不良反应
(3)研究结论
本研究结果提示,依维莫司应用于LGG患儿的术后辅助治疗可以较好的避免传统化疗方案的不良反应并提高远期生活质量。本研究初步支持mTOR抑制剂依维莫司作为mTOR阳性的LGG患者的一线术后辅助治疗方案。
参考文献:Cacchione et al. Upfront treatment with mTOR inhibitor everolimus in pediatric
low-grade gliomas: A single-center experience. Int. J. Cancer. 2020