2020至今国内获批抗肿瘤新药速递
背景
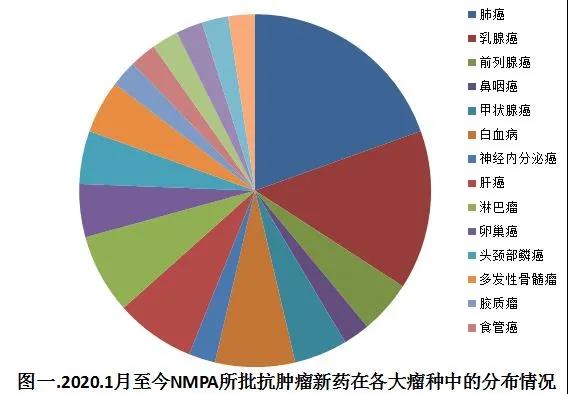
自2020.1月至今,在抗肿瘤药物治疗领域,国家食品药品监督管理局一共签发了45张批文,共批准了17个新药,基本上每个月都有新药获批,这些新药涉及乳腺癌,肺癌,肝癌,食管癌等临床常见瘤种,作用机制包括分子靶向治疗,免疫检查点治疗等肿瘤治疗领域的热门技术或者模式。从这里也可以明显看到,国内新药审批的步伐在明显加快。与此同时,随着近些年国内抗肿瘤药物研发水平的提升,国产抗肿瘤新药也开始不断涌现,这些新药不仅满足了国内患者的治疗需求,甚至从一定程度上填补了国际空白,安罗替尼就是最具代表性的例子之一。在新药加速上市的同时,越来越多的药品也有望在不久的将来分批纳入医保,这些新的举措不仅极大的缓解了患者的经济压力,也从一定程度上给患者带来了新的希望。基于此,在下文中,我们将详细列举2020.1月至今国家食品监督药品管理局(National
Medical Products Administration,以下简称:NMPA)的批准的抗肿瘤新药,希望能够对大家提供一定的帮助。
#
2021年NMPA获批药物导览
2021年2 月 19 日,根据POLARIS-02的临床研究结果,NMPA 批准君实生物的PD-1抑制剂特瑞普利单抗(商品名:拓益)用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌。
2021年2 月 2 日,NMPA 批准拜耳的 ODM-201(即 Darolutamide,通用名:达洛鲁胺 )用于治疗非转移性去势抵抗性前列腺癌(nmCRPC)。
2021年2 月 2 日,根据ADMIRAL试验(NCT02421939)的临床研究结果,NMPA 批准安斯泰来(Astellas)的富马酸吉瑞替尼片(gilteritinib,商品名:Xospata)用于治疗携带FLT3突变的复发性或难治性成人急性髓系白血病(AML),吉瑞替尼也是目前唯一一个获批的针对FLT3的分子靶向药。
2021年2 月 2 日,根据ORIENT-11(NCT03607539)的临床研究结果,NMPA 批准信达生物 的PD-1单抗信迪利单抗联合培美曲塞和铂类用于晚期非鳞状非小细胞肺癌的一线治疗。
2021年1月14日,根据(RATIONALE 307, NCT03594747)的临床研究结果,NMPA批准百济神州PD-1抗体替雷利珠单抗(商品名:百泽安)联合另种化疗方案用于晚期鳞状非小细胞肺癌(NSCLC)的一线治疗,这是替雷利珠单抗在中国获批的第三项适应症,也是首项肺癌适应症。
2021年1月4日,根据IIb期临床试验(NCT02586350)的临床研究结果,NMPA批准正大天晴的安罗替尼用于单药治疗无法手术的局部晚期或转移性甲状腺髓样癌,这是安罗替尼在中国获批的第四项适应症,也是首项甲状腺癌适应症。
#
2020年NMPA获批药物导览
2020年12月31日,NMPA批准石药欧意达沙替尼片(按4类上市),用于治疗对甲磺酸伊马替尼耐药或不耐受的费城染色体阳性(Ph+)慢性髓细胞白血病(CML)慢性期、加速期和急变期(急粒变和急淋变)成年患者。
2020年12月30日,NMPA通过优先审评审批程序批准和记黄埔医药(上海)有限公司具有抗血管生成和免疫调节双重活性的新型口服酪氨酸激酶抑制剂索凡替尼 胶囊(商品名:苏泰达®/SULANDA)单药适用于无法手术切除的局部晚期或转移性、进展期非功能性、分化良好(G1、G2)的非胰腺来源的神经内分泌瘤。
2020年12月30日,NMPA批准礼来公司的CDK 4/6抑制剂(阿贝西利片,商品名:唯择)用于治疗雌激素受体阳性/Her-2阴性(HR+/HER2)的晚期或转移性乳腺癌:其临床适应症为与芳香化酶抑制剂联合使用用于绝经后雌激素受体阳性/Her-2阴性(HR+/HER2)的晚期或转移性乳腺癌的初始治疗或者与氟维司群联合用于既往曾接受内分泌治疗后出现疾病进展的雌激素受体阳性/Her-2阴性(HR+/HER2)的晚期或转移性乳腺癌 的二线治疗。
2020年12月30日,NMPA批准恒瑞医药阿帕替尼单药用于既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌。
2020年12月25日,NMPA通过优先审评审批程序批准北京诺诚健华医药科技有限公司BTK抑制剂宜诺凯®(奥布替尼片)单药用于既往至少接受过一种治疗的复发难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)以及既往至少接受过一种治疗的复发难治性套细胞淋巴瘤(MCL)。
2020年12月14日,NMPA通过优先审评审批程序批准恒瑞医药1类创新药氟唑帕利 胶囊(商品名:艾瑞颐)用于既往经过二线及以上化疗的伴有胚系BRCA突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。
2020年12月9日,根据全球多中心、随机对照、开放标签的III期临床研究(KEYNOTE-048)的临床研究结果,NMPA批准帕博利珠单抗注射液(商品名:可瑞达®)单药用于PD-L1阳性的(综合阳性评分(CPS)≥20)的转移性或不可切除的复发性头颈部鳞状细胞癌(HNSCC的一线治疗。
2020年12月8日,根据3期临床试验TOWER的临床研究结果,NMPA批准百济神州倍利妥®(BLINCYTO®,注射用贝林妥欧单抗)用于治疗成人复发或难治性(R/R)前体B细胞急性淋巴细胞白血病(ALL),这是国内首个获批用于该适应症的免疫治疗方案。
2020年12月7日,NMPA批准艾伯维与罗氏共同开发的BCL-2抑制剂维奈克拉片(venetoclax,ABT-199)与阿扎胞苷,或地西他滨,或低剂量阿糖胞苷联用治疗年龄75岁及以上或因合并症不适于接受强诱导化疗的新诊断的成人急性髓系白血病(AML)患者。维奈克拉片也是国内首个获批的Bcl-2 抑制剂。
2020年11月9日,NMPA批准卫材乐卫玛「甲磺酸仑伐替尼胶囊」获用于治疗放射性碘难治性分化型甲状腺癌(RAIR-DTC)。
2020年11月10日,NMPA批准正大天晴提交的3类仿制药泊马度胺胶囊(安跃®)首仿上市,其适应症为联合地塞米松用于既往接受过至少两种治疗(在最后一次治疗结束的60天或60天内发生疾病进展)的复发/难治性MM患者,这些治疗方案包含了蛋白酶体抑制剂与免疫调节剂如来那度胺。
2020年11月19日,NMPA批准百济神州的来那度胺(商品名:瑞复美)与利妥昔单抗联合用于治疗复发或难治性惰性淋巴瘤(滤泡性或边缘区淋巴瘤)。
2020年11月17日,NMPA批准贝达药业盐酸恩莎替尼胶囊(商品名:贝美纳;化学名 :X-396)用于治疗接受过克唑替尼治疗后病情进展的或者无法耐受克唑替尼的ALK 阳性的局部晚期或转移性非小细胞肺癌(NSCLC)。
2020年10月9日,NMPA批准信达生物联合礼来合作开发的重组人-鼠嵌合抗CD20单克隆抗体注射液达伯华(利妥昔单抗注射液,英文商标: Halpryza)用于治疗弥漫性大B细胞淋巴瘤(DLBCL),滤泡性淋巴瘤(FL)及慢性淋巴细胞性白血病(CLL)。
2020年10月17日,NMPA批准罗氏托珠单抗注射液(商品名:雅美罗®,通用名:托珠单抗)用于成年和2岁及以上儿童患者由CAR-T细胞引起的重度或危及生命的细胞因子释放综合征(CRS)。
2020年10月28日,NMPA批准 PD-L1抑制剂阿替利珠单抗与抗血管生成药物贝伐珠单抗(A+T) 联合用于治疗既往未接受过系统治疗的不可切除肝细胞癌。
2020年9月21日,NMPA批准安维汀®(英文商品名:Avastin;通用名:贝伐珠单抗注射液)用于成人复发性胶质母细胞瘤(GBM)。
2020年9月11日,NMPA批准再鼎药业则乐®(甲苯磺酸尼拉帕利胶囊)用于对含铂化疗完全或部分缓解的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者的一线维持治疗。
2020年9月11日,NMPA批准齐鲁制药 4 类仿制药瑞菲乐®「马来酸阿法替尼片」用于既往未接受过EGFR-TKI治疗的表皮生长因子受体(EGFR)突变阳性的局部晚期或转移性非鳞非小细胞肺癌的一线治疗或者含铂化疗期间或化疗后疾病进展的局部晚期或转移性肺鳞癌患者的二线治疗。
2020年08月14日,NMPA批准复宏汉霖曲妥珠单抗类似汉曲优®(HLX02,欧盟商品名:Zercepac®)获得原研在中国已获批准的所有适应症:1)HER2阳性早期乳腺癌;2)HER2阳性转移性乳腺癌;3)HER2阳性转移性胃癌。
2020年08月12日,NMPA批准正大天晴药业集团的晴可依(氟维司群,中国国内首仿)用于绝经后激素受体阳性,Her-2阴性转移性乳腺癌的内分泌治疗,临床上可单药使用或者与哌柏西利联合用于绝经后激素受体阳性,Her-2阴性转移性乳腺癌的二线治疗,值得一提的是晴可依是正大天晴公司第一个在欧美中三地同时申报的药品。
2020年6月19日,NMPA批准卡瑞利珠单抗(商品名:艾瑞卡)用于既往接受过一线化疗后疾病进展或对毒副反应无法耐受的局部晚期或转移性食管鳞癌。
2020年6月19日,NMPA批准卡瑞利珠单抗联合培美曲塞和卡铂用于晚期或转移性非鳞非小细胞肺癌 的一线治疗。
2020年6月19日,NMPA批准帕博利珠单抗用于既往一线系统治疗失败的局部晚期或转移性食管鳞状细胞癌(ESCC)。
2020 年 6 月 5 日,NMPA批准豪森「马来酸阿法替尼片」上市,同时视同通过一致性评价。
2020年6月3日NMPA批准百济神州I类创新药赞布替尼(商品名:百悦泽)用于既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)以及既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。
2020年6月22日,NMPA批准三生制药自主研发、Fc段修饰和生产工艺优化的抗HER2单抗伊尼妥单抗(商品名:赛普汀)与化疗联合用于治疗HER2阳性的转移性乳腺癌。
2020年5月13日,NMPA批准安适利®(注射用维布妥昔单抗)用于成人CD30阳性的复发或难治性系统性间变性大细胞淋巴瘤(sALCL)以及复发或难治性经典型霍奇金淋巴瘤(cHL)。
2020年5月27日,NMPA批准诺华口服小分子ALK抑制剂赞可达®(塞瑞替尼胶囊) 用于ALK阳性的晚期非鳞非小细胞肺癌的一线治疗。
2020年4月10日,NMPA批准百济神州替雷利珠单抗用于局部晚期或转移性尿路上皮癌的二线治疗。
2020年4月15日,NMPA批准齐鲁制药4类仿制药阿比特龙片与泼尼松联合用于治疗转移性去势抵抗性前列腺癌(mCRPC)患者,这也是第4个同品种的国产仿制药。
2020年4月28日,NMPA批准北海康成引进的马来酸奈拉替尼(Neratini曾用名来那替尼片,商品名贺俪安,英文商品名Nerlynx)用于既往接受曲妥珠单抗治疗的HER2阳性早期乳腺癌的辅助治疗。
2020年3月18日,NMPA批准阿美替尼(商品名:阿美乐)用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后疾病进展且检测出EGFR T790M阳性的局部晚期或转移性非小细胞肺癌。
2020年3月11日,NMPA批准纳武利尤单抗用于治疗既往接受过两种或两种以上全身性治疗方案的晚期胃或胃食管交界处腺癌患者。
2020年3月9日,NMPA批准达拉非尼和曲美替尼联合用于BRAF V600阳性的经完全切除的III期黑色素瘤的术后辅助治疗。
2020年3月4日,NMPA批准卡瑞利珠单抗(Camrelizumab)用于接受过索拉非尼和/或含奥沙利铂系统化疗后病情进展的晚期肝细胞癌的二线治疗。
2020年3月2日,根据【CHANGE-2研究】的临床研究结果,NMPA批准西妥昔单抗(Cetuximab,中文商品名:爱必妥®)与铂类和氟尿嘧啶联合,用于复发和/或转移性头颈部鳞状细胞癌(R/M SCCHN)的一线治疗。
2020年2月13日,根据【IMpower133】的临床研究结果,NMPA批准阿替利珠单抗(英文商品名Tecentri,英文通用名atezolizumab,中文商品名:泰圣奇)联合化疗用于广泛期小细胞肺癌的一线治疗。
2020年1月21日,NMPA批准罗氏恩美曲妥珠单抗(Kadcyla,中文商品名赫赛莱)单药用于接受紫杉醇类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌的辅助治疗。
小结
综上所述,在近2年以来,国内抗肿瘤新药研发开始进入高速发展期,国内抗肿瘤新药不论是数量还是质量上相比于上个世纪已经有了显著的提升,国内患者也有望从这些新药中得到实实在在的生存获益。所以,对于广大患者而言,活着就有希望,并不仅仅只是一句空话而已。但是,在自主创新以及奋力同国际接轨的同时,我们也还必须清醒的认识到自身与欧美发达国家的差距。最后,从临床应用角度而言,由于抗肿瘤药物治疗更新较快,同时NMPA批件中给临床治疗提供的参考信息极为有限,建议肿瘤患者前往专业的医疗机构或者医疗团队就诊,争取充分合理利用最新的医疗技术或者手段以获得最大的生存获益。
黎小兵
主治医师,肿瘤学博士,现为湖北省临床肿瘤学会青年专家委员会常委,湖北省临床肿瘤学会免疫治疗(ESCO-IO)专家委员会委员,湖北省免疫学会生物治疗专业委员会委员, 肿瘤科普公众号“癌之说”创始人。已发表多篇SCI论文,获得抗肿瘤新药专利一项,参与多项国家级及省级课题。主要研究方向为肿瘤的免疫及靶向治疗。