AML靶向治疗临床试验的二十年
近二十年,靶向治疗在急性髓细胞性白血病(Acute myeloid leukemia, AML)的治疗中正变得越来越重要。本文客观回顾过去20年中针对AML的靶向治疗II期和III期临床试验:共包括II期试验397项,III期试验67项,最终7种靶向治疗药物被美国食品药品监督管理局(FDA)批准用于AML治疗。
背景
AML是成年人最常见的急性白血病,目前治疗仍以化疗为主,但接受化疗并获得缓解的患者中有70%左右最终复发并演变为难治性白血病,导致治疗失败而死亡,因此亟需新药物的研发。
近20年,用于治疗AML的靶向疗法的数量正在稳步增长。2000年至2020年9月共有397个II期(评估了167种靶向药)和64个III期(评估了28种靶向药)临床试验在AML中展开,其中7种靶向药物已被美国食品药品监督管理局(FDA)批准用于AML治疗。
本文概述了这些临床试验的研究药物和分子靶标,对比了不同分子靶标的试验结果,并选择了其中获得FDA批准的几种药物进行具体讨论。
II期临床试验概述
397项AML II期临床试验中共评估了针对96种分子靶标的167种不同药物,其中包括这些72项II期试验研究了靶向药物的组合(图1)。在所有分子靶标中的有5个最为热门,这些靶标是:
• FLT3(FMS Related Receptor Tyrosine Kinase 3,FMS相关受体酪氨酸激酶3,n = 66)
• CD33(n = 43)
• BCL2(B-cell lymphoma 2,B细胞淋巴瘤蛋白2,n = 35)
• BCR-ABL(Philadelphia 染色体,费城染色体,n = 24)
• PD-1 / PD-L1(Programmed cell death protein 1 / Programmed cell death protein ligand 1,程序性细胞死亡蛋白-1及其受体,n = 21)
综合观察所有II期临床试验的成功率,共有29种药物在试验完成后的1年内进入了III期临床或获得了FDA批准,63种药物没能进入III期,75种药物的评估仍在进行中。
III期临床试验概述
96项AML III期临床试验中共评估了针对20种分子靶标的28种药物(图1),其中研究最多的靶标是:
• FLT3(n = 19)
• CD33(n = 18)
• BCL2(n = 7)
• 法尼基转移酶(n = 3)
在所有III期临床中,5种药物获得了成功,11种失败,另外12种的评估仍在进行中。III期试验中以针对CD33的靶向药物试验数量最多(18项),而且其中有17项评估Gemtuzumab Ozogamicin。
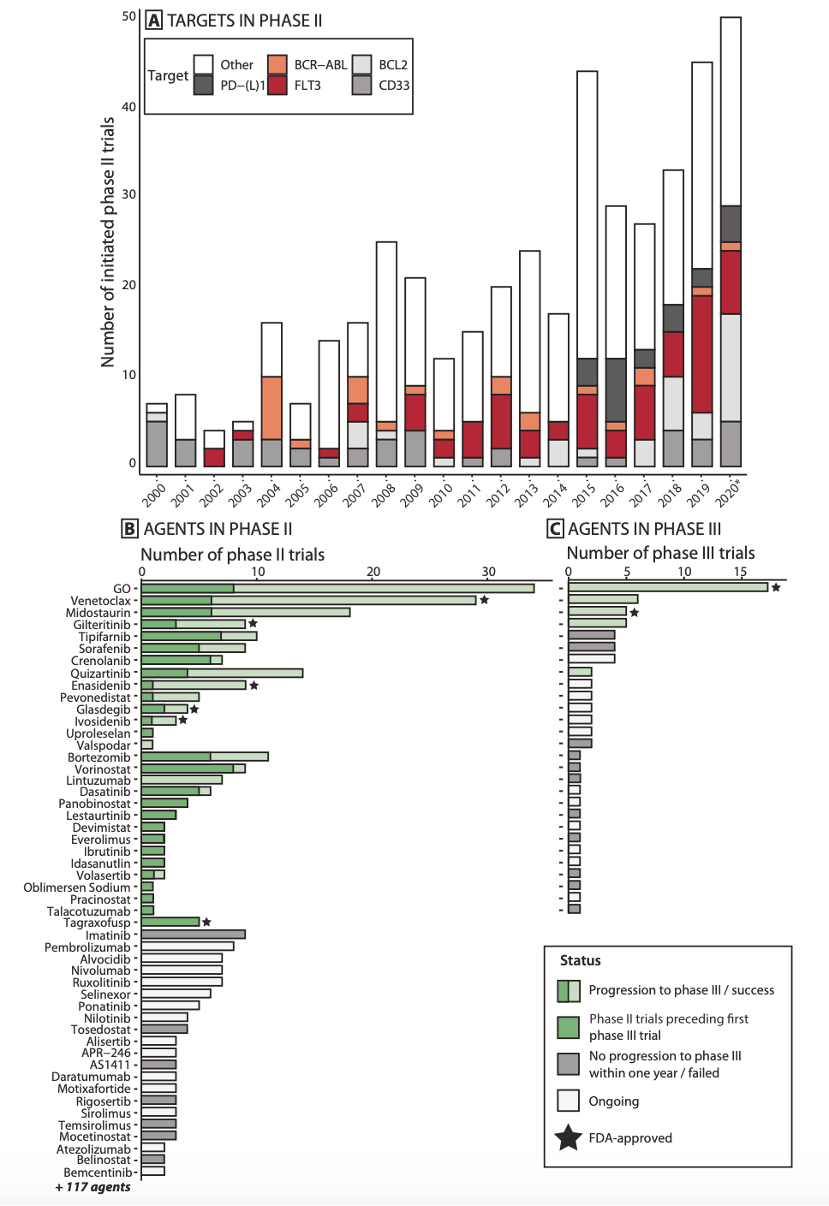
图1:II和III期临床试验中的靶标和靶向药物。A:总结了从2000年到2020年每年开始的II期试验;B:总结了II期临床试验中研究数量最多的前50种靶向药物;C:总结了III期临床试验研究的所有靶向药物
FDA批准AML靶向药物
本文汇总了FDA批准的7种AML靶向药物的临床试验设计与结果(表1),包括每种药物的靶标、各期试验入组人数、有效率结果、毒性和患者总体获益。
表1:所有FDA批准的AML靶向药物
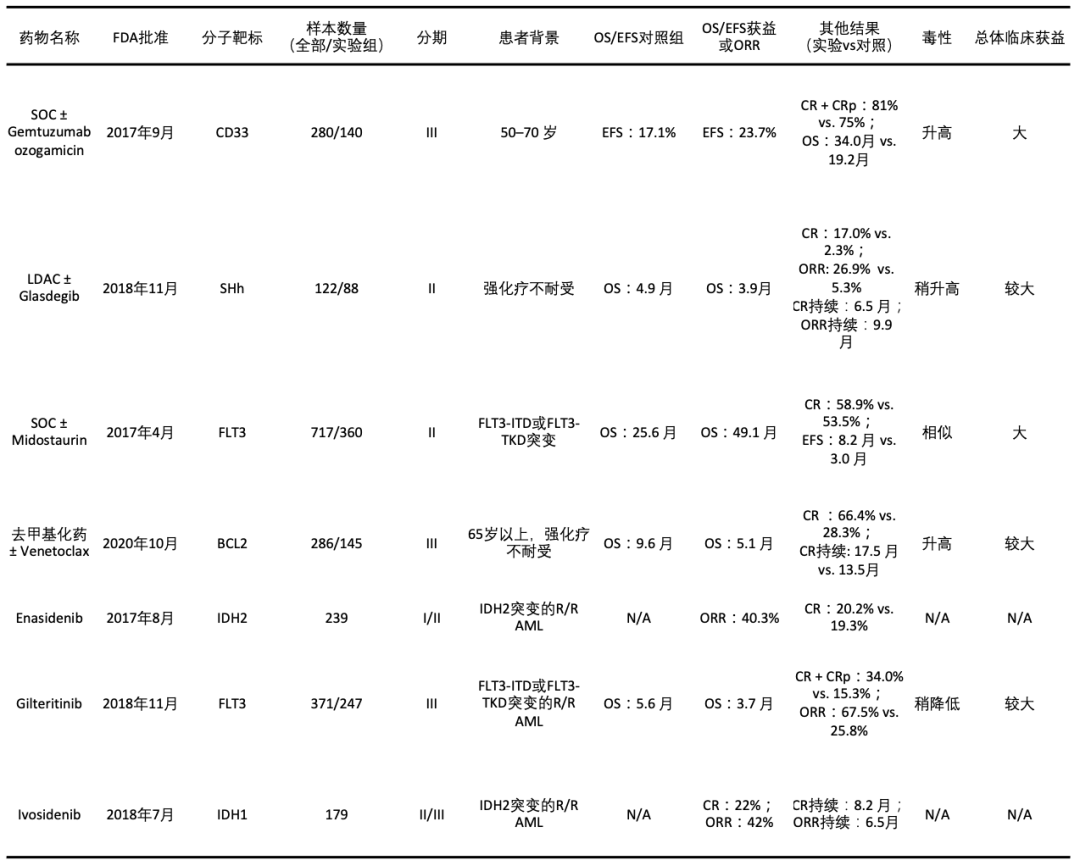
SOC:标准治疗;OS:总体生存;EFS:无事件生存;CR:完全缓解;CRp:完全缓解血小板恢复不完全;SHh:Sonic hedgehog通路;R/R:复发/难治
1. FLT3抑制剂
15%~25% AML患者中存在FLT3突变。目前有两种已知FLT3突变,分别为FLT3内部单复制突变(ITD亚型)和酪氨酸激酶域点突变(TKD亚型)。约75%的FLT3突变是ITD亚型,这些患者化疗后复发率高且OS短,预后差。
• Midostaurin:初治FLT3突变AML
Midostaurin是一种多靶点激酶抑制剂。一项Ib期研究评估了Midostaurin用于初治年轻AML患者,发现FLT3突变患者的反应率与野生型相似。这项结果引领了初治FLT3突变AML患者进入CALGB RATIFY III期试验。CALGB RATIFY III结果显示,Midostaurin的完全缓解率(CR)略有改善(58.9% vs 53.5%),总体生存(OS)明显延长,无事件生存(EFS)延长。该结果促成了FDA批准Midostaurin用于初治FLT3突变AML。
• Gilteritinib:FLT3突变R/R AML
Gilteritinib是一种酪氨酸激酶抑制剂。ADMIRAL III期试验评估了Gilteritinib在FLT3突变R/R AML患者中效果,试验观察到CR + CR伴部分血液学恢复(CRh)率为21%,中位反应时间为3.6个月。ADMIRAL试验的最终OS结果显示,Gilteritinib组OS(9.3个月)显著长于挽救化疗组的OS(5.6个月),37.1%的患者在12个月后仍存活。该结果促成了FDA批准Gilteritinib用于FLT3突变R/R AML。
2. 异柠檬酸脱氢酶(IDH)1和2抑制剂
IDH1和IDH2基因突变在AML的患者中的发现率为7––19%。IDH基因的突变最终会导致表观遗传改变和造血细胞无法分化,这些突变基因的预后目前尚不清楚。
• Enasidenib:IDH2突变R/R AML
Enasidenib是IDH2特异性抑制剂。I / II期临床试验显示Enasidenib在R / R AML患者中,总体反应(ORR)达38.8%(CR 19.6%)。到达CR的时间约4个月。另一项R / R AML患者II期试验中,Enasidenib的CR + CRh为23%,中位CR持续时间为8.2个月。因此,Enasidenib被FDA批准用于IDH2突变R/R AML。
• Ivosidenib:IDH1突变 AML
Ivosidenib是一种突变IDH1的靶向抑制剂Ivosidenib治疗的174名IDH1突变的R / R AML患者中,CR + CRh率为33%,CR率为25%。CR + CRh的中位持续时间为8.2个月。基于这些结果,Ivosidenib被批准用于IDH1突变R/R AML治疗和初治状态较差老年IDH1突变AML。
3. Venetoclax联合用药:初治老年AML
Venetoclax是BCL2特异性抑制剂。在II期研究中,Venetoclax作为单药在R / R AML中几乎没有活性。但在老年不耐受化疗AML患者中进行的Venetoclax联合去甲基化药物的研究显示,ORR高达67%,中位缓解持续时间为11.3个月,中位OS为17.5个月。基于该结果,FDA批准了该组合用于75岁以上AML患者。另外,Venetoclax联合低剂量阿糖胞苷(LDAC)的I / II期试验中,CR + CRi率为54%,中位OS为10.1个月。CR + CRi率在NPM1突变患者中达89%,FLT3突变患者为44%,TP53突变患者为30%。
4. Glasdegib与LDAC合用:初治老年AML
Glasdegib是Sonic hedgehog信号通路抑制剂。一项II期试验显示Glasdegib联合LDAC在老年化疗不耐受AML患者中CR + CRi率为25%,而LDAC单药组仅为5%。该联合用药被批准用于 75岁以上AML患者。
5. Gemtuzumab ozogamicin:CD33阳性AML
大于80%的AML患者细胞表达CD33表面抗原。Gemtuzumab ozogamicin是人源化的抗CD33单克隆抗体与细胞毒素偶联的小分子药物。在三项II期试验中,Gemtuzumab ozogamicin在CD33阳性AML复发患者中的ORR达30%(CR率16%),Gemtuzumab ozogamicin也因此被批准用于CD33阳性复发AML。随后,一项III期AML-19试验评估了Gemtuzumab ozogamicin在初治AML患者中的效果,总CR + CRi率为27%(CR率为15%),中位OS为4.9个月,根据AML-19的结果,Gemtuzumab ozogamicin被批准用于初治老年CD33 阳性AML,但是Gemtuzumab ozogamicin与其他标准治疗方法的疗效比较还需要更多研究。
结论
AML靶向治疗领域的发展十分迅速,各种新药的产生很大程度提高了不同亚型AML患者的受益。目前,对这些新批准药物更全面的临床评估还在进行中,未来也会有更多数据指导我们如何使用这些新药。同时,新药的使用也带来了新的问题,如何通过biomarker预测药物反应、如何抑制AML细胞抗药性产生等都将是未来AML领域的研究热点。
参考文献
1.Cucchi, D. G. J. et al. Two decades of targeted therapies in acute myeloid leukemia. Leukemia 35, 651-660, doi:10.1038/s41375-021-01164-x(2021).
2.Lai, C., Doucette, K. & Norsworthy, K. Recent drug approvals for acute myeloid leukemia. J Hematol Oncol 12, 100, doi:10.1186/s13045-019-0774-x(2019).
责任编辑: