黄河教授:新型CAR-T细胞治疗,更加助力提高B-NHL治疗疗效
CAR-T细胞治疗淋巴瘤缓解率有待提高,双靶点、新型共刺激分子等新型CAR-T细胞治疗对提高疗效具有潜在价值。
2021年4月16日-18日,中华医学会第一次全国淋巴细胞疾病学术大会在成都举行。与会期间,浙江大学医学院附属第一医院黄河教授为大家带来了“CAR-T细胞治疗B-NHL新进展”的专题报告。医学界血液频道综合整理了此次报道,以飨读者。
B细胞非霍奇金淋巴瘤(B-NHL)是非霍奇金淋巴瘤的一种主要类型,异质性高且侵袭性强,其中最常见的病理类型包括弥漫大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)。
CAR-T治疗缓解率有待提高,
明确机制有助于制定新型治疗策略
目前,嵌合抗原受体修饰T细胞(CAR-T)治疗主要应用于B细胞血液系统恶性肿瘤。各大研究中心数据统计显示,CAR-T细胞治疗淋巴瘤的完全缓解(CR)率约50%。2021年2月发表于《新英格兰医学杂志》上的一项研究报道了目前为止CAR-T细胞治疗淋巴瘤的最长时间随访结果。该研究的5年随访结果显示,在接受CAR-T细胞治疗的24例难治复发DLBCL患者中,46%的患者获得了完全缓解,31%的患者在5年后获得了无进展生存;另外在14例难治复发FL患者中,71%的患者实现了完全缓解,43%的患者在5年内实现了无进展生存(图1)。
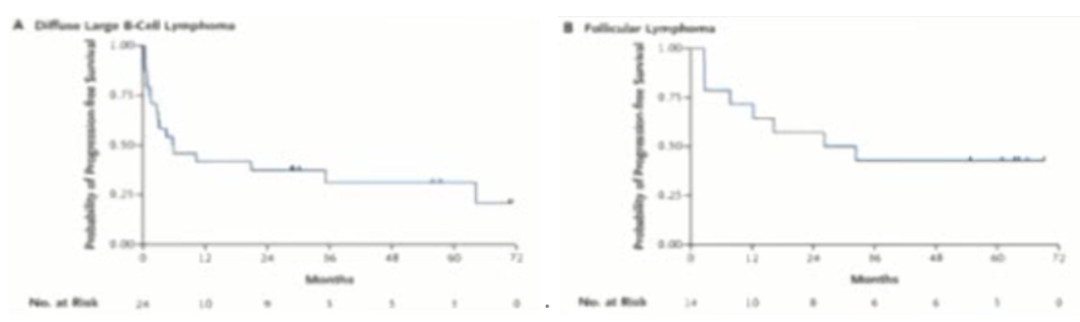
图1.CAR-T细胞治疗难治复发DLBCL患者(左)和FL患者(右)的疗效
相较于急性淋巴细胞白血病而言,CAR-T细胞治疗淋巴瘤的缓解率较低。造成CAR-T细胞治疗淋巴瘤反应率低的主要原因在以下三个方面:靶抗原缺失、肿瘤微环境免疫抑制及CAR-T细胞功能缺陷。
CD19和CD22是目前CAR-T细胞治疗的两大靶点。研究发现,CD19治疗靶点缺失的原因有多个方面,如在治疗过程中发生淋系向髓系的转化、CD19基因突变、CD19相关转录因子如PAX5表达下降或CD19 mRNA转运异常。CD22治疗靶点缺失的原因仍值得深入研究,有研究者提出其为转录后水平发生改变是其可能的原因之一。
另一方面,一项研究对CAR-T治疗后肿瘤组织进行RNA测序,结果表明,肿瘤相关巨噬细胞(TAM)的表达谱在CAR-T治疗后CR组和部分缓解(PR)组中存在明显差异。这提示肿瘤微环境可能对预后存在影响。
此外,CAR-T细胞功能缺陷也会导致CAR-T细胞治疗反应率低。研究发现,CAR-T细胞制备前的T淋巴细胞表面PD-1和LAG-3跟治疗预后相关,PD-1和LAG-3高表达提示预后差。CAR-T产品中CD8+CD45RO-CD27+细胞亚群和预后好相关;而CAR-T产品中CD8+LAG-3+PD-1+和CD8+TIM-3+PD-1+细胞亚群与预后不良相关。PD-1敲除CAR-T细胞在小鼠模型中显示更长的无病生存时间。
黄河教授团队的一项重要研究在浆细胞白血病患者BCMA CAR-T细胞治疗过程中留取CAR-T产品、细胞因子释放综合征(CRS)高峰期和CRS恢复期CAR-T和非CAR-T细胞进行单细胞测序,以在单细胞水平检测CAR-T细胞表型与疗效的关系。结果显示,在CAR-T治疗的不同阶段有不同的细胞亚群分布,而且重要分子在不同亚群中的分布是不同的。杀伤和增殖功能CAR-T细胞随着时间变化而发生动态改变,CRS高峰期的CAR-T细胞具有高增殖能力和高杀伤活性。而且不同时期CAR-T细胞表达特异性基因(如耗竭基因LAG-3的表达会导致CAR-T细胞的耗竭)。同时,CAR-T细胞亚群与内源性非CAR-T细胞的T细胞通过受体与配体方式相互作用,起到活化/抑制作用。这些结果都提示,体内CAR-T细胞表型与疗效密切相关。
双靶点、新型共刺激分子CAR-T
对提高淋巴瘤疗效具有潜在价值
为了提高CAR-T细胞治疗淋巴瘤的疗效,国内外研究团队做了一系列研究。来自北京大学肿瘤医院朱军教授的一项研究使用了新型共刺激分子CD19 CAR-T细胞,构建的CA19-BBzCAR(86)T细胞具有杀伤效果好、细胞因子水平低的特点。相关临床研究结果显示,在低剂量组6例患者中,3例有治疗反应;中剂量组8例患者中有4例达到PR;高剂量组11例患者中有6例达到CR。而且血清细胞因子水平均保持较低水平,25例患者均未出现明显的CRS及神经毒副作用。
华中科技大学同济医学院附属同济医院周剑峰教授团队用CD19 CAR-T和CD22 CAR-T进行序贯治疗,并取得了很好的效果。研究结果显示,CD19/CD22 CAR-T细胞均扩增明显,总体反应率达72.2%,CR率是50%,而且安全性好,避免了靶点阴性复发。
解放军总医院韩为东教授团队使用了CD19/CD20双靶点CAR-T细胞治疗,并评估了该治疗方案在28例患者中的安全性和有效性。研究结果显示,该治疗方案的总体反应率达到了79%,CR率为71%,12个月的无进展生存期(PFS)达64%。由此可见双靶点CAR-T细胞治疗的疗效相比单靶点CAR-T治疗有了明显提高。
黄河教授团队使用了CD19/CD22双靶点CAR-T细胞治疗进行了相关研究。用CD19/CD22双靶点CAR-T同时杀伤CD19或CD22单表达的K562细胞系的体外研究数据显示,相较于CD19或CD22单靶点CAR-T细胞治疗,CD19/CD22双靶点CAR-T细胞治疗的体外杀伤效率可以获得明显提高。在小鼠模型中也可以看到CD19/CD22双靶点CAR-T细胞治疗的疗效更好,小鼠的生存时间获得明显延长(图2)。
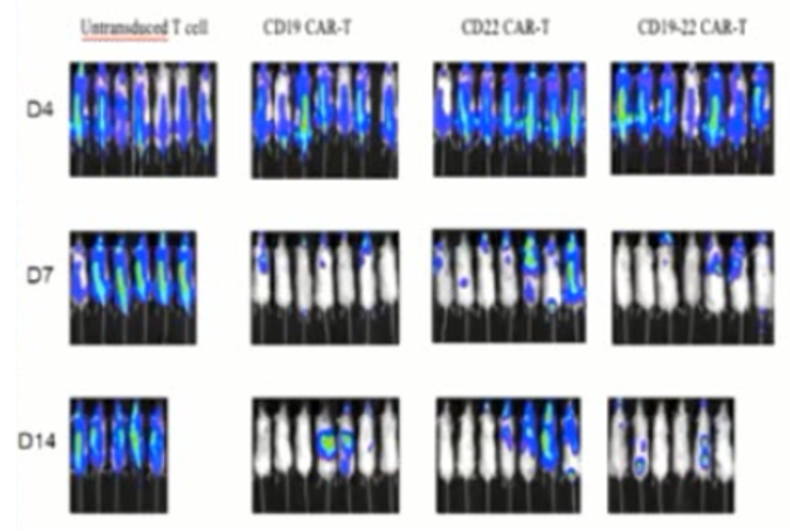
图2.CD19/CD22双靶点CAR-T细胞延缓动物模型生存期
将CD19/CD22双靶点CAR-T细胞用于治疗急性淋巴细胞白血病的临床研究结果显示,该治疗方案获得90%的CR率,且重度CRS降低30%。此外,用该方案治疗24例B-NHL患者(其中16例进入了安全性和有效性评估)的结果显示,总体反应率和CR率分别为87.5%和62.5%,较单靶CAR-T细胞治疗获得了明显提高,且细胞因子升高不明显。患者2年的总体生存率达77.3%,2年无病生存率为40.2%。
由于PD-1敲除对于CAR-T细胞的疗效有非常重要的影响。黄河教授团队在全球首次利用CRISPR/Cas9基因编辑技术对T细胞PD-1基因进行特异性切割敲除,并同时导入靶向CD19的CAR元件,制备PD-1定点整合的靶向CD19 CAR-T细胞(PD-1-CD19-CAR-T)。该方法具有多项优势:不需要慢病毒载体;生产成本低;降低随机插入风险;可以敲除PD-1,增加疗效;可多样化改造,发展潜力大。
研究显示,PD1-CD19-CART具有对CD19+B细胞肿瘤良好的体外与体内杀伤效果。相关临床研究结果显示,该治疗方案在已入组的8例患者中的总体反应率达到了100%,CR率达到了87.5%,而且没有3级或3级以上CRS发生。单细胞测序亦显示CAR-T产品和体内扩增CAR-T细胞均低表达PD-1、LAG-3等抑制分子,说明这些CAR-T细胞具有更高的杀伤活性。
自体造血干细胞移植可改善肿瘤微环境
联合CAR-T细胞治疗淋巴瘤未来可期
自体造血干细胞移植是治疗淋巴瘤的一项非常重要的手段,预处理则是自体造血干细胞移植的重要环节。预处理化疗药物可诱导免疫原性细胞凋亡、肿瘤细胞凋亡,使CD4+/CD8+T细胞比例重建,也能够改善抑制性肿瘤微环境。因此,自体造血干细胞移植以后,淋巴瘤微环境可能会获得改善(图3)。
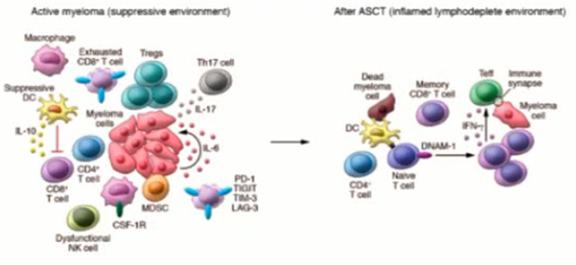
图3.自体造血干细胞移植改善淋巴瘤微环境
周剑峰教授团队在2020美国血液学学会(ASH)年会上发布的一项单中心、单臂临床研究用自体造血干细胞移植联合CAR-T细胞治疗淋巴瘤,32例患者(76.2%)均为二线或二线以上治疗后获得疾病稳定(SD)和PR。结果显示,治疗总体反应率达到了90.5%,CR率达81%,PR率为9.5%。
来自美国MSKCC的一项研究的策略是用自体造血干细胞移植和CAR-T治疗序贯,该研究入组了15例患者。结果显示,2年PFS为30%,但重度神经毒性的患者比例比较高,达67%。
国内杨建民教授的团队也报告了自体造血干细胞移植联合CAR-T细胞治疗的方案,共入组了14名患者。结果显示,6月PFS为64.29%,1年OS为65.48%。
以上研究尚处于初步阶段,还需要开展更多临床研究证明方案的有效性。
小结:
目前CAR-T细胞治疗淋巴瘤的缓解率还有待提高,造成CAR-T细胞治疗淋巴瘤反应率低的主要原因为靶抗原缺失、肿瘤微环境免疫抑制和CAR-T细胞功能缺陷。
目前多项研究探索了新型CAR-T细胞治疗策略,如双靶点、新型共刺激分子等,这些对提高疗效具有潜在价值。另一方面,CRISPR/Cas9基因编辑技术在CAR-T细胞研发的应用对于新型CAR-T细胞开发也具有重要意义。
CAR-T细胞治疗淋巴瘤还有很大发展空间,基础研究者和临床医生需要共同努力,尽快将基础研究的进步转化到临床,努力提高疗效,减少毒副反应,为更多患者带来获益。