JCO发布KEYNOTE-024研究5年随访结果;国产首个MSI-H实体瘤PD-1疗法拟优先审评
CA:晚期实体瘤患者血浆循环肿瘤DNA未来可期,不日或走向临床
JCO:帕博利珠单抗治疗NSCLC,肿瘤PD-L1阳性≥50%患者生存延长
CCR:可切除的结直肠癌肝转移患者围手术期接受免疫治疗安全可行
新药:国产首个MSI-H实体瘤PD-1疗法斯鲁利单抗拟优先审评
01 CA:晚期实体瘤患者血浆循环肿瘤DNA未来可期,不日或走向临床
日前,CA:A Cancer Journal for Clinicians(CA)上刊载了一篇综述,回顾了血浆循环肿瘤DNA(ctDNA)检测在目前临床中的应用以及进行中的相关研究,认为这一检测手段不止能指导治疗决策,未来更有望用于患者风险分层、疾病缓解评估和耐药性监测等癌症治疗全流程。

图1.1 综述发表于CA
这篇来自美国哈佛医学院丹娜法伯癌症研究院的综述指出,传统的肿瘤基因组学分析往往基于手术切除的肿瘤标本或活检标本,主要用于确定患者是否存在靶向治疗相应的基因突变。虽然2018年的美国临床肿瘤学会/美国病理学家学院针对血浆ctDNA检测的联合审查报告认为,当时还没有证据表明血浆ctDNA检测合适在临床试验之外使用,但这一领域进展迅速,有必要及时跟进最新的研究。近来,血浆ctDNA检测已经逐渐走进了临床,商业化检测也已经出现。因此,综述重点介绍了ctDNA近年来在晚期实体肿瘤中的新进展。
综述指出,美国国家综合癌症网络(NCCN)指南中已经针对非小细胞肺癌(NSCLC)、乳腺癌、前列腺癌、结直肠癌、胃癌、食管癌、胰腺癌、肝胆管癌、黑色素瘤的血浆ctDNA检测给出了相关推荐,其中以NSCLC相关的推荐最为丰富。
比如,在NSCLC中建议在诊断时对所有的患者进行分子检测。在肿瘤组织不足的情况下,应该进行再次活检或使用血浆ctDNA检测。在患者不适合再次活检时,首选血浆ctDNA检测。不过,考虑到血浆ctDNA的假阴性率较高。如果首次检测未能发现致癌驱动基因,后续还是应该开展基于肿瘤组织的相关检测。
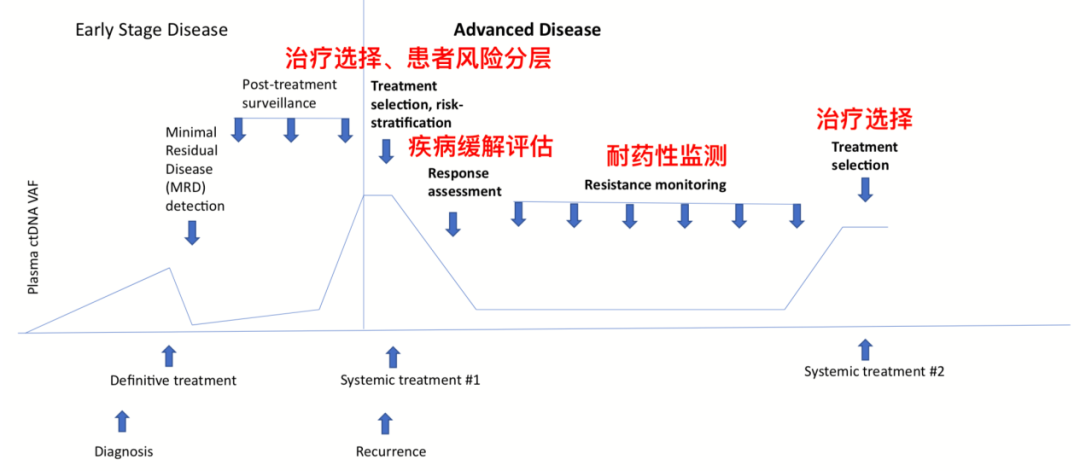
图1.2 血浆ctDNA检测贯穿癌症治疗全程
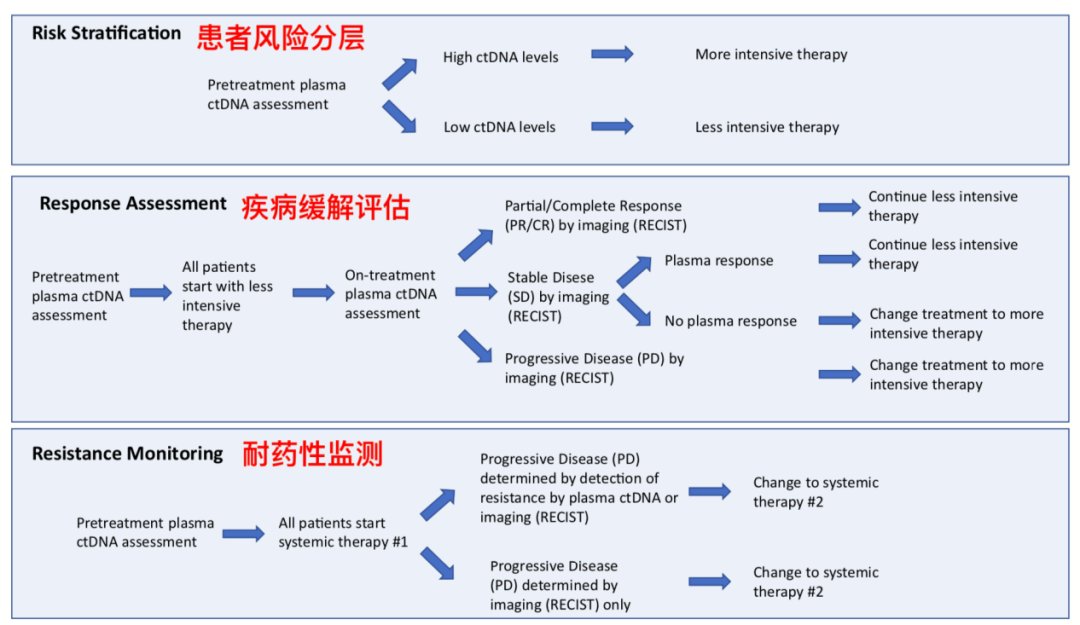
图1.3 血浆ctDNA检测的潜在应用
除此之外,血浆ctDNA检测也被认为能用于患者风险分层、疾病缓解评估和耐药性监测。血浆ctDNA被认为可以预测转移性三阴性乳腺癌、BRAF V600突变阳性的转移性黑色素瘤和晚期胰腺导管腺癌等患者的生存预后。血浆ctDNA检测还能在患者肿瘤出现影像学上可见的改变之前,就捕捉到基因突变水平的变化,发现疾病缓解的蛛丝马迹。对癌症耐药性的监测也可以通过多次血浆ctDNA检测来实现,但具体的检测间隔和阈值仍有待进一步研究。
02 JCO:帕博利珠单抗治疗NSCLC,PD-L1肿瘤比例评分≥50%患者生存延长
日前,Journal of Clinical Oncology(JCO)报道了KEYNOTE-024研究的第一个5年随访结果,发现PD-L1肿瘤比例评分(TPS)≥50%的NSCLC患者一线接受帕博利珠单抗治疗比选择化疗活得更长!

图2.1 研究发表于JCO
这项开放标签的III期临床试验研究纳入了355名PD-L1 TPS≥50%且不携带EGFR或ALK突变的NSCLC患者。PD-L1 TPS指的是PD-L1阳性的肿瘤细胞占所有肿瘤细胞的百分比,通常PD-L1 TPS≥50%被认为肿瘤PD-L1高表达。
研究中的154名患者接受了帕博利珠单抗治疗,151例患者接受了化疗。在中位随访了55.9个月之后,99名最初接受化疗的患者后续改用抗PD-1单抗或抗PD-L1单抗治疗,有效交叉率为66.0%。
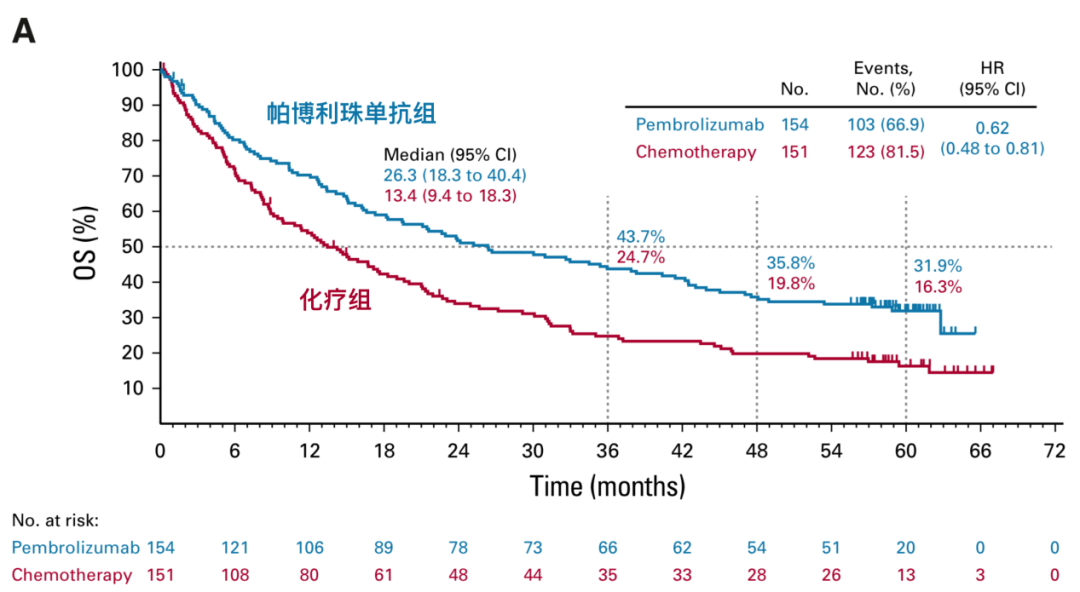
图2.2 帕博利珠单抗组患者总生存改善
结果显示,帕博利珠单抗组患者的中位总生存期(OS)为26.3个月(95%CI 18.3-40.4个月),5年OS率为31.9%,化疗组患者的的中位OS为13.4个月(95%CI 9.4-18.3个月),5年OS率为16.3%,帕博利珠单抗组患者的OS比化疗组有了明显改善(HR 0.62,95%CI 0.48-0.81)。
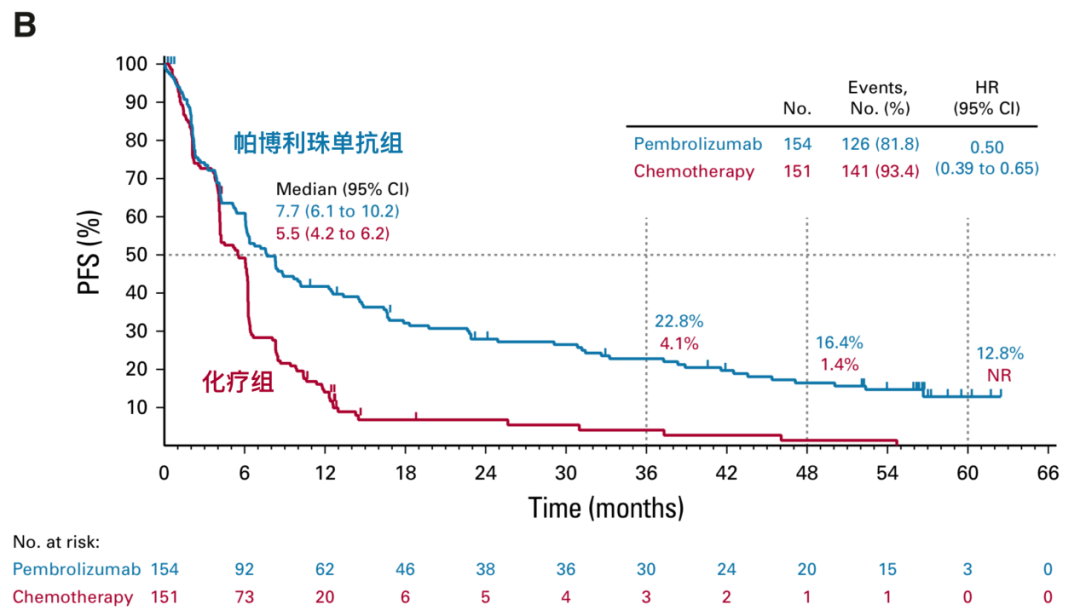
图2.3 帕博利珠单抗组患者无进展生存改善
帕博利珠单抗组患者的中位无进展生存期(PFS)为7.7个月(95%CI 6.1-10.2个月),5年PFS率为12.8%,化疗组患者的的中位PFS为5.5个月(95%CI 4.2-6.2个月),帕博利珠单抗组患者的PFS比化疗组同样有了明显改善(HR 0.50,95%CI 0.39-0.65)。
在帕博利珠单抗组中有39名患者接受了35个周期的治疗,历时大约2年,其中82.1%的患者在5年后依然存活。虽然其中87.2%的患者发生了治疗相关的不良反应,但长时间的治疗并没有增加不良反应,主要的3-4级不良反应包括腹泻、自身免疫性肝炎、γ-谷氨酰转移酶水平升高等。
研究人员指出,免疫治疗能够有效提升NSCLC患者的生存率。对于肿瘤PD-L1高表达的患者而言,帕博利珠单抗治疗几乎将转移性NSCLC变成了一种可以治疗的慢性疾病,应该作为此类患者的标准治疗方案。
03 CCR:可切除的结直肠癌肝转移患者围手术期接受免疫治疗安全可行
日前,Clinical Cancer Research(CCR)上发表了一项前瞻性临床试验,发现可切除的结直肠癌肝转移患者接受围手术期双免疫检查点抑制剂治疗安全可行,可能激活患者肿瘤免疫,或有潜在临床价值。

图3.1 研究发表于CCR
这项研究纳入了24名可切除的结直肠癌肝转移患者,其中23名患者接受了治疗,包括术前的抗CTLA4药物Tremelimumab单抗+抗PD-L1药物度伐利尤单抗联合治疗以及术后的度伐利尤单抗单药治疗。接受治疗的患者中,21名错配基因完整(pMMR),2名错配基因缺失(dMMR),随后有17名患者(74%,95%CI 53%-88%)接受了手术切除。
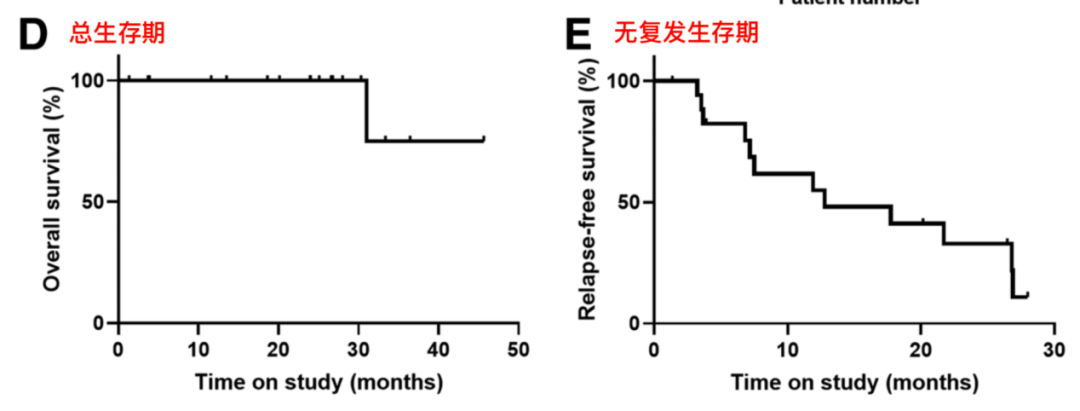
图3.2 患者的总生存与无复发生存
患者的中位无复发生存期(RFS)为9.7个月(95%CI 8.1-17.8个月),中位OS为24.5个月(95%CI 16.5-28.4个月)。4名患者获得了病理完全缓解,分别为2名dMMR患者和两名携带POLE P286R突变的pMMR患者。
在安全性方面,5/23名患者(22%,95%CI 10%-44%)出现了3-4级治疗相关免疫毒性反应,2/17名患者(12%,95%CI 2%-38%)在术后出现了3-4级毒性反应。不过,患者在接受免疫治疗后,术后并发症并没有明显增加。
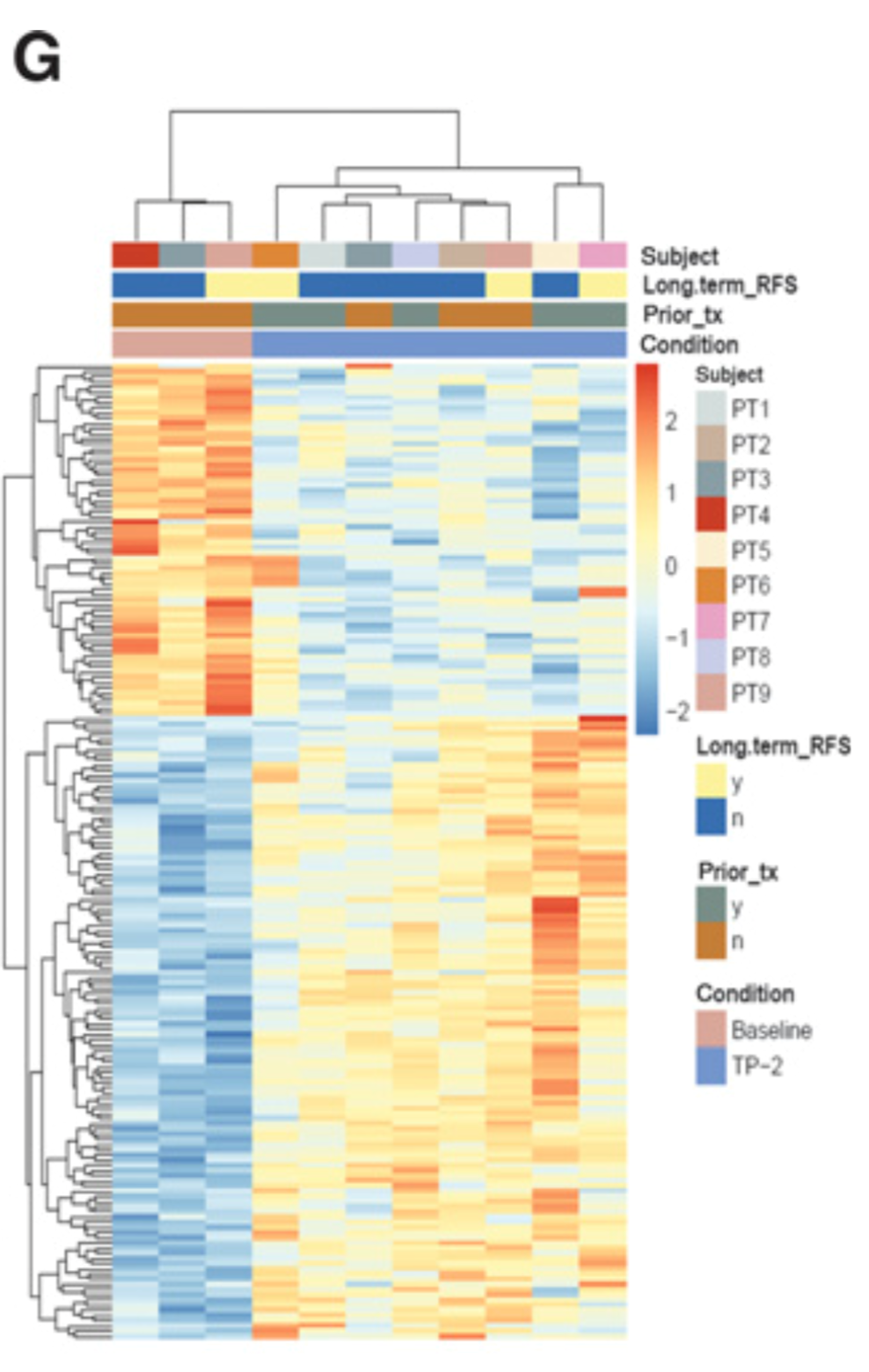
图3.3 RNA测序分析发现治疗前后pMMR患者T细胞活化
研究人员比较了治疗前后肿瘤组织中的T细胞浸润水平,并没有发现明显的变化,但在pMMR患者的肿瘤组织中的确发现了治疗后CD8阳性和CD4阳性T细胞活化的证据。同时,治疗后肿瘤组织中B细胞相关基因转录水平上升和细胞密度增加与患者较长的RFS有关。
这项研究表明,可切除的结直肠癌肝转移患者在手术前后增加Tremelimumab单抗和度伐利尤单抗治疗安全可行。虽然临床疗效只在dMMR患者中比较明显,但在pMMR患者中也发现了治疗后患者肿瘤组织中的免疫细胞被激活,可能具有潜在的临床意义,值得开展进一步的探索。
04 新药:国产首个MSI-H实体瘤PD-1疗法斯鲁利单抗拟优先审评
4月21日,药品审评中心(CDE)官网显示,斯鲁利单抗(HLX10)注射液上市申请拟纳入优先审评审,用于经过标准治疗失败的、不可切除或转移性高度微卫星不稳定型(MSI-H)实体瘤。
今年3月28日,PD-1单抗HLX10用于经标准治疗失败的转移性MSI-H或错配修复缺陷型(dMMR)实体瘤的II期临床研究达到主要终点。该研究是一项单臂、开放、多中心、II期临床试验,旨在评估HLX10在标准治疗失败的、不可切除或转移性MSI-H实体瘤患者中的疗效、安全性及耐受性的,临床研究结果表明HLX10对该类患者具有良好的疗效和安全性。
参考资料:
[1]Cheng ML,Pectasides E,Hanna GJ,Parsons HA,Choudhury AD,Oxnard GR.Circulating tumor DNA in advanced solid tumors:Clinical relevance and future directions.CA Cancer J Clin.2021 Mar;71(2):176-190.doi:10.3322/caac.21650. [2]Reck M,Rodríguez-Abreu D,Robinson AG,et al.Five-Year Outcomes With Pembrolizumab Versus Chemotherapy for Metastatic Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score≥50.J Clin Oncol.2021 Apr 19:JCO2100174.doi:10.1200/JCO.21.00174. [3]Kanikarla Marie P,Haymaker C,Parra ER,et al.Pilot Clinical Trial of Perioperative Durvalumab and Tremelimumab in the Treatment of Resectable Colorectal Cancer Liver Metastases.Clin Cancer Res.2021 Apr 2:clincanres.0163.2021.doi:10.1158/1078-0432.CCR-21-0163.Epub ahead of print. [4]https://mp.weixin.qq.com/s/NC06DBADBZdjLBl3P2Kg8Q