晚期上皮性卵巢癌新辅助化疗指征的快速指南(2021年版)
晚期上皮性卵巢癌(epithelial ovarian cancer,EOC)的初始治疗模式可概括为初次肿瘤细胞减灭术(primary cytoreductive surgery,PCS)及新辅助化疗(neoadjuvant chemotherapy,NACT)联合间歇性肿瘤细胞减灭术(interval cytoreductive surgery,ICS)两大类。自NACT用于妇科肿瘤治疗以来,其在晚期EOC患者初始治疗中的价值争议不断,原因之一在于妇瘤同道对指征或适应证的认知不同。已有的4项随机对照临床试验(randomized controlled trials,RCTs)证实,晚期EOC患者PCS与NACT联合ICS的生存结局相当,但不可否认的是,NACT能够改善手术结局,提高满意肿瘤细胞减灭术的概率,减少手术出血量和围手术期并发症[1-4]。上述研究为NACT在晚期EOC治疗中的应用提供了有力的证据支持,并逐步得到国内外权威学术组织的认可。遗憾的是,在具体临床实践过程中,晚期EOC患者的初始治疗决策仍存有诸多争议,特别是NACT的应用存在较大的“随意性”,甚至有“滥用”之虞。对晚期EOC患者如何规范地实施NACT,是妇科肿瘤学界必须直面的问题,其中NACT适应证的选择是面临的核心问题。
1 由谁对晚期EOC患者行NACT作出评估与决策
在CHORUS及TRUST等多中心临床试验中,均要求参与试验的医院具有完备的卵巢癌治疗多学科团队,包括妇科肿瘤专科医师、肿瘤学医师、病理科医师和影像学医师等[3,5]。研究表明,与普通外科医师相比,经由妇科肿瘤专科医师治疗的卵巢癌患者能够得到更恰当的分期,接受更适宜的肿瘤细胞减灭术和更规范的术后辅助化疗,患者的生存率更高,预后更佳[6-8]。2016年美国妇科肿瘤学会(Society of Gynecologic Oncology,SGO)和美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)联合发布的NACT用于治疗新诊断晚期EOC患者的临床实践指南建议提出:任何初始治疗前的EOC,特别是可疑国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)分期(2014)ⅢC或Ⅳ期患者,必须经由妇科肿瘤专家评估,以决定选择PCS还是NACT联合ICS[9-11] 。2019年欧洲肿瘤学会(European Society for Medical Oncology ,ESMO)和欧洲妇科肿瘤学会(European Society of Gynaecologial Oncology,ESGO)联合发布的专家共识,同样建议晚期EOC患者的初始诊疗应在具备多学科团队的卵巢癌诊疗中心进行[12]。因此,在晚期EOC初始治疗决策中,不仅强调了妇科肿瘤医师在病情评估及诊疗方案制定中的地位,更突出明确了准确的分期、理想的肿瘤细胞减灭术和规范的辅助化疗均需妇科肿瘤专科医师参与并主导,而不应仅仅是外科医师、普通妇科医师甚至传统意义上的妇产科医师[10,13]。
基于以上研究及国内外指南和专家共识,所有疑诊晚期EOC患者均需由妇科肿瘤专家进行评估以决策初始治疗的选择,同时要严格把握NACT的应用指征。
2 哪些EOC患者适合NACT
已公布的4项Ⅲ期RCTs比较了晚期EOC患者PCS与NACT联合ICS的临床意义,所有研究对象均包括FIGO分期ⅢC或Ⅳ期患者[1-4],其中有2项研究包含了部分FIGO分期ⅢA和ⅢB期患者[3-4]。正在进行的TRUST试验已完成患者入组,所纳入试验的患者均为FIGO分期ⅢB~ⅣB期EOC、输卵管癌或原发腹膜癌[5]。SUNNY试验由上海妇科肿瘤学会牵头,日本妇科肿瘤学组(JGOG)参与,研究对象纳入FIGO分期ⅢC和Ⅳ期EOC、输卵管癌或原发性腹膜癌患者[14]。截止目前,多数研究证实NACT联合ICS在总生存期(overall survival,OS)及无进展生存期(progression-free survival,PFS)方面不劣于PCS,优势是术中出血量少、手术时间相对较短、围手术期并发症发生率及住院时间均低于PCS并且满意的肿瘤细胞减灭术率升高[1-4]。对EORTC 55971临床试验二次探索性分析表明,转移瘤直径>45mm的FIGO分期ⅢC期和Ⅳ期患者更能够从NACT联合ICS中获益,总生存期延长[15]。近期一项基于美国国家癌症研究所SEER数据库的大样本回顾性研究表明,NACT对晚期EOC的生存影响可能因患者和肿瘤因素的不同而有差异,尤其是老年及FIGO分期Ⅳ期患者,NACT联合ICS与PCS的总生存期相似[16]。目前,国内外临床实践指南及专家共识多建议在晚期EOC治疗中,NACT推荐应用于FIGO分期Ⅲ~Ⅳ期体能状态差无法耐受手术者、PCS难以达到满意的肿瘤细胞减灭术并且组织病理学类型为高级别浆液性癌或子宫内膜样癌患者,而不适用于FIGO分期Ⅰ~Ⅱ期EOC患者[9,11-12,17]。此外,卵巢低级别浆液性癌、黏液性癌、交界性肿瘤和性索间质肿瘤等组织学类型是否适宜于应用NACT存在很大争议[10]。
基于以上研究及国内外指南和共识推荐,NACT更适合于FIGO分期Ⅲ~Ⅳ期、PCS难以达到满意的肿瘤细胞减灭术以及体能状态差无法耐受手术的晚期EOC患者,特别是转移瘤直径>45mm的ⅢC期和Ⅳ期的EOC患者。
3 如何筛选适宜于NACT的晚期EOC患者
NACT前最好通过穿刺活检或腹腔镜手术探查获取组织学证据。原发肿瘤的组织病理学类型是决定是否适宜NACT的第一重要因素[10-11]。在EORTC和CHORUS试验中,即使严格按照纳入标准筛选,仍有3%的患者术后病理证实为非上皮性卵巢恶性肿瘤[1,3]。为此,研究者进一步限定,当获取组织学证据困难、患者因身体原因不能耐受组织穿刺活检或腹腔镜手术探查时,可应用腹水细胞沉淀包埋联合免疫组化判定细胞病理类型,腹水细胞学阳性结合糖类抗原125(CA125)与癌胚抗原(CEA)比值>25 也可替代组织学活检[9-10,13]。腹水细胞学阳性而CA125与CEA比值≤25 时,推荐钡灌肠、结肠镜/胃镜和乳腺X线检查,进一步排除卵巢及盆腹腔转移性癌[9,13]。
晚期EOC患者初始治疗的选择以PCS是否能够达到满意的肿瘤细胞减灭术为主要评估标准[10,12]。评估手段包括详尽的病史采集、妇科检查、盆腹腔影像学检查、血清肿瘤标志物测定、腹腔镜手术探查等。影像学检查是鉴别卵巢源性与非卵巢源性肿瘤的重要依据之一。最常用的影像学评估手段为盆腹腔强化CT联合胸部影像学检查。盆腹腔磁共振成像(MRI)及正电子发射计算机断层扫描(PET-CT)等各有千秋。与普通盆腹腔强化CT相比,PET-CT 对累及膈下和小肠浆膜面的肿瘤检测准确性更高[18],全身MRI弥散加权序列能够较为准确地判断腹膜受累[19]。目前普遍认可强化CT检查在晚期EOC决策评估中的地位,PET-CT和MRI的指导价值尚需进一步临床验证。
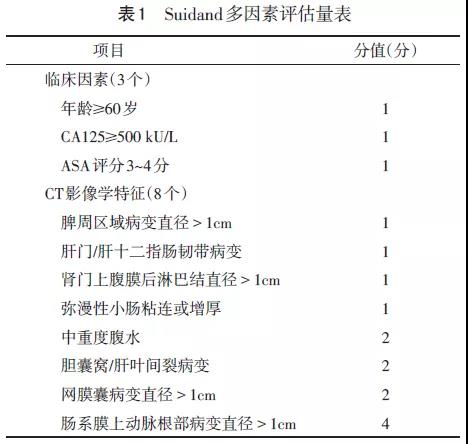
Suidan等[20]对Ⅲ~Ⅳ期卵巢癌、输卵管癌和原发性腹膜癌进行PCS的回顾性、非随机、多中心试验结果表明,下述因素与PCS能否达到满意的肿瘤细胞减灭术密切相关:年龄≥60岁、CA125≥500 kU/L、美国麻醉医师协会(American Society of Anesthesiologists,ASA)评分3~4分、肾门上腹膜后淋巴结直径>1cm、弥漫性小肠粘连或增厚、小肠系膜病变直径>1cm、肠系膜上动脉根部病变直径>1cm、脾周区域病变直径>1cm和网膜囊病变直径>1cm,基于临床因素和CT影像学特征构建了Suidan多因素评估量表(见表1)。该模型预判实施PCS的准确率为72.0%,当评分≥3分时,推荐NACT联合ICS[21]。另一项大样本研究证实,若晚期EOC患者CT检查提示弥漫性腹膜增厚或超过2/3的CT扫描区域提示存在腹水,预示可能难以经由PCS达到满意的肿瘤细胞减灭术[22]。
伴随着腹腔镜技术的进步与发展,腹腔镜手术探查在晚期EOC患者初始治疗前评估中的作用日益受到关注[23-25]。腹腔镜探查进行分级评估(Fagootti评分)既可获取组织学证据用以明确组织病理学诊断,又可直观评估疾病累及范围。SCORPION试验采用腹腔镜获取组织学证据,并通过评分评估肿瘤负荷[2]。Fagootti评分参照前期研究结果,以7个相关参数进行赋值累加计算预测值[24,26-27](见表2)。对表2中各项评分进行累加计算腹腔镜预测值(laparoscopic predictive index value,PIV)。当PIV<8分时考虑PCS;PIV≥8分建议先行3~4个周期NACT,依据实体瘤治疗反应评价标准(RECIST)再次进行评估。NACT后疾病进展者,考虑更换二线化疗;对NACT治疗反应良好者则进行 ICS;无反应或仅呈部分反应者,建议再次行腹腔镜评估,Fagootti评分结果 PIV<4分方可选择ICS,若再次评估结果PIV≥4分,推荐继续标准化疗或更换二线化疗。本快速指南评分系统从影像学或腹腔镜评价的不同角度出发,对患者预后有不同的预测作用。

本快速指南制订团队成员一致认为,前述各项临床试验来源于不同的研究者、研究中心、研究人群,必然存在偏倚,所提炼出来的Suidan多因素评估量表和Fagootti标准赋分表虽然多被引用,但均缺乏多中心的重复验证。故特别推荐进行前瞻性临床试验进一步验证和优化,以期对晚期EOC进行更客观真实的术前评估,达到更为客观、科学的个体化治疗选择。
初始治疗方案的选择除外上述“以分期为目的”的选项,还需考虑患者体能状态。目前已发表及正在进行的临床试验均将患者体能状态作为评估标准之一。晚期EOC患者常因疾病广泛转移,累及多个器官,基础体能状态呈消耗状态。多数情况下,医师对患者体能状态的主观评估偏倚颇大,从而影响治疗决策的选择。2016年SGO临床指南明确指出,临床经验不是判定患者可否耐受手术的标准,应严格按照美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状况评分标准(performance status,PS)和ASA体能状况评分标准进行评估[9]。晚期EOC患者围手术期并发症风险与高龄、体质虚弱、合并慢性疾病、营养状况不良、低白蛋白血症和静脉血栓栓塞等有密切相关[9]。NACT联合IDS更适合于体能状态较差、围手术期高风险患者。
基于以上研究和国内外指南及专家共识,晚期EOC行NACT前应尽可能取得组织学证据,依据病史,结合妇科检查、盆腹腔影像学检查、血清肿瘤标志物检测、腹腔镜手术探查等综合评估,同时高度关注患者体能状态。NACT可能更适用于:(1)通过临床表现、妇科查体、影像学检查或腹腔镜证实PCS难以达到满意的肿瘤细胞减灭术(2)患者体能状态较差难以耐受手术,如肿瘤消耗状态、合并大量胸腹水和合并多种慢性疾病。
4 晚期EOC患者NACT疗程数
关于晚期EOC患者NACT最佳疗程数,不同的研究意见不同。多数RCT研究认为以3~4疗程为宜[1-4]。在已公布的研究中,NACT最多为8疗程[28],法国一项多中心大样本回顾性研究表明,与接受≤4个周期NACT联合ICS相比,接受≥5疗程NACT后再行ICS的晚期EOC患者预后更差[29]。欧洲另一项多中心研究比较了3疗程NACT与≥4疗程NACT对于晚期EOC患者预后的影响,结果表明,接受≥4疗程NACT的患者,OS呈下降趋势[28]。本快速指南推荐一般进行3~4疗程,NACT 3~4疗程后疾病缓解可行ICS,而疾病稳定者可实施ICS或继续化疗至6疗程再行ICS。关于化疗,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐:NACT及ICS后辅助化疗的总疗程数应不少于6个周期,ICS之后辅助化疗应至少为3疗程;如经≥6疗程化疗后疾病稳定且能够耐受化疗,总疗程可以超过6疗程[10-11]。
基于以上研究及有关指南和专家共识,当晚期EOC患者评估适于NACT,建议3~4疗程,必要时可延长至6疗程。
5 推荐与建议
应遵循严格的依据和标准,恰当把握适宜于NACT的EOC患者标准,如不加甄别地应用NACT甚至滥用NACT,不仅增加卫生经济学成本,而且还有可能改变肿瘤的生物学行为,为后续治疗及患者预后带来不可估量的损失。因此,合理、规范地应用NACT是保障晚期EOC患者预后的根基。基于循证医学证据,参照推荐分级的评估、质量与评价标准( Grading of Recommendation Assessment,Development and Evaluation,GRADE),评价本快速指南的证据质量及推荐强度(表3)。

晚期EOC行NACT指征的快速指南推荐如下:(1)NACT前评估应包括详细的病史采集、妇科检查、盆腹腔影像学检查(首选增强CT)、血清肿瘤标志物检测(证据等级:中;推荐强度:强)(2)所有可疑FIGO分期ⅢC或Ⅳ期EOC患者启动治疗前须由妇科肿瘤专科医师评估,决定选择PCS抑或NACT联合ICS(证据等级:中;推荐强度:强)(3)NACT适合于FIGO分期Ⅲ~Ⅳ期、PCS难以达到满意的肿瘤细胞减灭术患者,不适用于FIGO分期Ⅰ~Ⅱ期患者(证据等级:强;推荐强度:强)(4)NACT更适用于经妇科肿瘤专科医师评估,证实PCS难以达到满意的肿瘤细胞减灭术、患者体能状态较差难以耐受手术的FIGO分期Ⅲ~Ⅳ期EOC,特别是转移瘤直径>45mm的ⅢC期和Ⅳ期患者(证据等级:中;推荐强度:强)(5)NACT首选穿刺活检或腹腔镜手术探查获取组织学证据;获取组织学证据困难或患者因身体原因不能耐受穿刺活检或腹腔镜手术探查时,腹水细胞沉淀包埋联合免疫组化判定病理类型,阳性腹水细胞学证据结合 CA125与CEA比值>25 可替代组织学活检;腹水细胞学阳性而CA125与CEA比值≤25 时,推荐进一步排除其他器官转移性肿瘤或非上皮性输卵管-卵巢癌和原发性腹膜癌(证据等级:中;推荐强度:强)(6)依据临床实际,采用Suidan标准或Fagootti标准进行治疗前评估赋分,当Suidan评分≥3分或Fagootti评分PIV≥8分时,推荐选择NACT(证据等级:中;推荐强度:弱)(7)晚期EOC患者如需接受NACT,建议3~4疗程,必要时可延长至6疗程(证据等级:中;推荐强度:强)。
本快速指南旨在为晚期EOC先期化疗的适应证提出合理的指导性意见,但并非唯一的临床实践指南,不排除其他指南、共识、意见或建议的合理性。专家团队及参与者郑重声明,本指南制订与任何商业团体无利益冲突,指南更新周期暂定为2年。
参考文献
[1] Vergote I,Tropé CG,Amant F,et al.Neoadjuvant chemotherapy or primary surgery in stage ⅢC or Ⅳ ovarian cancer[J].N Engl J Med,2010,363(10):943-953. [2] Fagotti A,Ferrandina G,Vizzielli G,et al.Phase Ⅲ randomised clinical trial comparing primary surgery versus neoadjuvant chemotherapy in advanced epithelial ovarian cancer with high tumour load(SCORPION trial):final analysis of peri-operative outcome[J].Eur J Cancer,2016,59:22-33. [3] Kehoe S,Hook J,Nankivell M,et al.Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer(CHORUS):an open-label,randomised,controlled,non-inferiority trial[J].Lancet,2015,386(9990):249-257. [4] Onda T,Satoh T,Saito T,et al.Comparison of treatment invasiveness between upfront debulking surgery versus interval debulking surgery following neoadjuvant chemotherapy for stage Ⅲ/Ⅳ ovarian,tubal,and peritoneal cancers in a phase Ⅲ randomised trial:Japan Clinical Oncology Group Study JCOG0602[J].Eur J Cancer,2016,64:22-31. [5] Reuss A,du Bois A,Harter P,et al.TRUST:Trial of Radical Upfront Surgical Therapy in advanced ovarian cancer(ENGOT ov33/AGO-OVAR OP7)[J].Int J Gynecol Cancer,2019,29(8):1327-1331. [6] Rim SH,Hirsch S,Thomas CC,et al.Gynecologic oncologists involvement on ovarian cancer standard of care receipt and survival[J].World J Obstet Gynecol,2016,5(2):187-196. [7] Chan JK,Kapp DS,Shin JY,et al.Influence of the gynecologic oncologist on the survival of ovarian cancer patients[J].Obstet Gynecol,2007,109(6):1342-1350. [8] Vernooij F,Heintz P,Witteveen E,et al.The outcomes of ovarian cancer treatment are better when provided by gynecologic oncologists and in specialized hospitals:a systematic review[J].Gynecol Oncol,2007,105(3):801-812. [9] Wright AA,Bohlke K,Armstrong DK,et al.Neoadjuvant chemotherapy for newly diagnosed,advanced ovarian cancer:Society of Gynecologic Oncology and American Society of Clinical Oncology clinical practice guideline[J].J Clin Oncol,2016,34(28):3460-3473. [10] 卢淮武,霍楚莹,许妙纯,等.《2020 NCCN卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南(第1版)》解读[J].中国实用妇科与产科杂志,2020,36(4):340-348. [11] NCCN clinical practice guidelines in oncology-ovarian cancer including fallopian tube cancer and primary peritoneal cancer(Version1.2020)[DB/OL].http://www.nccn.org. [12] Colombo N,Sessa C,du Bois A,et al. ESMO-ESGO consensus conference recommendations on ovarian cancer:pathology and molecular biology,early and advanced stages,borderline tumours and recurrent disease[J].Ann Oncol,2019,30(5):672-705. [13] 袁航,张玉敏,黄文倩,等.美国妇科肿瘤学会和临床肿瘤学会“2016初诊晚期卵巢癌新辅助化疗临床实践指南”解读[J].中国实用妇科与产科杂志,2016,32(9):860-863. [14] Jiang R,Zhu J,Kim JW,et al.Study of upfront surgery versus neoadjuvant chemotherapy followed by interval debulking surgery for patients with stage ⅢC and Ⅳ ovarian cancer,SGOG SUNNY(SOC-2)trial concept[J].J Gynecol Oncol,2020,31(5):86-92. [15] van Meurs HS,Tajik P,Hof MH,et al.Which patients benefit most from primary surgery or neoadjuvant chemotherapy in stage ⅢC or Ⅳ ovarian cancer? An exploratory analysis of the European Organisation for Research and Treatment of Cancer 55971 randomised trial[J].Eur J Cancer,2013,49(15):3191-3201. [16] Matsuo K,Matsuzaki S,Nusbaum DJ,et al.Possible candidate population for neoadjuvant chemotherapy in women with advanced ovarian cancer[J].Gynecol Oncol,2021,160(1):32-39. [17] Suh DH,Chang SJ,Song T,et al.Practice guidelines for management of ovarian cancer in Korea:a Korean Society of Gynecologic Oncology Consensus Statement[J].J Gynecol Oncol,2018,29(4):56-73. [18] Hynninen J,Kemppainen J,Lavonius M,et al.A prospective comparison of integrated FDG-PET/contrast-enhanced CT and contrast-enhanced CT for pretreatment imaging of advanced epithelial ovarian cancer[J].Gynecol Oncol,2013,131(2):389-394. [19] Michielsen K,Vergote I,Opde Beeck K,et al. Whole-body MRI with diffusion-weighted sequence for staging of patients with suspected ovarian cancer:a clinical feasibility study in comparison to CT and FDG-PET/CT[J].Eur Radiol,2014,24(4):889-901. [20] Suidan RS,Ramirez PT,Sarasohn DM,et al.A multicenter prospective trial evaluating the ability of preoperative computed tomography scan and serum CA-125 to predict suboptimal cytoreduction at primary debulking surgery for advanced ovarian,fallopian tube,and peritoneal cancer[J].Gynecol Oncol,2014,134(3):455-461. [21] Suidan RS,Ramirez PT,Sarasohn DM,et al.A multicenter assessment of the ability of preoperative computed tomography scan and CA-125 to predict gross residual disease at primary debulking for advanced epithelial ovarian cancer[J].Gynecol Oncol,2017,145(1):27-31. [22] Gerestein CG,Eijkemans MJ,Bakker J,et al.Nomogram for suboptimal cytoreduction at primary surgery for advanced stage ovarian cancer[J].Anticancer Res,2011,31(11):4043-4049. [23] Brun JL,Rouzier R,Selle F,et al. Neoadjuvant chemotherapy or primary surgery for stage Ⅲ/Ⅳ ovarian cancer:contribution of diagnostic laparoscopy[J].BMC Cancer,2009,9(171):1-8. [24] Fagotti A,Ferrandina G,Fanfani F,et al.A laparoscopy-based score to predict surgical outcome in patients with advanced ovarian carcinoma:a pilot study[J].Ann Surg Oncol,2006,13(8):1156-1161. [25] Vergote I,Marquette S,Amant F,et al.Port-site metastases after open laparoscopy:a study in 173 patients with advanced ovarian carcinoma[J].Int J Gynecol Cancer,2005,15(5):776-779. [26] Vizzielli G,Costantini B,Tortorella L,et al.Influence of intraperitoneal dissemination assessed by laparoscopy on prognosis of advanced ovarian cancer:an exploratory analysis of a single-institution experience[J].Ann Surg Oncol,2014,21(12):3970-3977. [27] Brun JL,Rouzier R,Uzan S,et al.External validation of a laparoscopic-based score to evaluate resectability of advanced ovarian cancers:clues for a simplified score[J].Gynecol Oncol,2008,110(3):354-359. [28] Bogani G,Matteucci L,Tamberi S,et al.The impact of number of cycles of neoadjuvant chemotherapy on survival of patients undergoing interval debulking surgery for stage ⅢC-Ⅳ unresectable ovarian cancer:results from a multi-institutional study[J].Int J Gynecol Cancer,2017,27(9):1856-1862. [29] Lecointre L,Velten M,Lodi M,et al.Impact of neoadjuvant chemotherapy cycles on survival of patients with advanced ovarian cancer:a French national multicenter study(FRANCOGYN)[J].Eur J Obstet Gynecol Reprod Biol,2020,245:64-72.
作者:张师前,李小平 中国医师协会微无创医学专业委员会妇科肿瘤学组,中国研究型医院学会妇产科专业委员会