特殊Fc段改造PD-1单抗肺鳞癌显奇效
替雷利珠单抗是目前唯一一个对Fc段进行了特殊基因工程改造的PD-1单抗,也是目前全球第二个、国内第一个全面获得一线鳞状及非鳞状非小细胞肺癌(NSCLC)III期注册临床研究成功的PD-1抗体,同时在小细胞肺癌(SCLC)领域的研究也取得了初步成效,显示出良好的应用前景。本期将分享2例替雷利珠单抗治疗晚期鳞状NSCLC及SCLC患者的诊疗经过和治疗思路。
1病例一:鳞状NSCLC

井绪泉
山东省肿瘤医院
特需二病区主治医师、肿瘤学博士
中国医药教育协会肿瘤放射治疗专业委员会委员
山东省抗癌协会肿瘤免疫与肿瘤免疫治疗分会委员
病例一基本情况
一般资料:患者男性,62岁。
主诉:颈部肿大1月,加重1周。
现病史:患者于2020年5月触及双侧锁骨上区肿物,约鸽子蛋大小,无疼痛、发热,未行特殊处理。后自觉肿物明显增大,颈部胀满感,同时出现进食梗阻症状,于外院就诊提示恶性肿瘤可能,于2020年6月3日行纵隔占位穿刺活检,病理提示鳞状细胞癌。患者为求进一步诊治,2020年6月4日就诊于我院。
既往史:有慢性支气管炎、支气管扩张病史;否认慢性病史;否认吸烟饮酒史。
查体:双侧锁骨上区肿物,最大直径约1.5 cm,质硬,活动度差,无压痛。余查体未见明显异常。
ECOG PS评分:0-1分。
KPS评分:90分。
胸部CT(2020-03-03):左肺靶病灶直径59 mm,纵隔3、7区及双侧肺门淋巴结病灶直径20 mm(图1)。
PET-CT(2020-06-07):1.双下颈部、双侧锁骨上、纵隔、左肺门、右侧内乳区、膈脚后、腹膜后、腹腔多发淋巴结转移伴高代谢,考虑左肺癌来源;左肺结节伴高代谢,考虑转移。2.右肺片状密度增高灶,局部伴略高代谢,首先考虑炎症;双肺肺气肿。
纵隔穿刺活检(2020-06-03):(纵隔)低分化癌,较符合鳞状细胞癌。免疫组化:CK5/6小灶+,P63部分+,CK7 (-),TTF (-),CD5 (-),Ki-67阳性率70%。
颅脑MRI(2020-06-09):增强扫描未见异常。
诊断:1. 左肺中心性鳞癌(cT4N3M1c,IVb期),伴多发淋巴结转移;2.慢性支气管炎、支气管扩张。
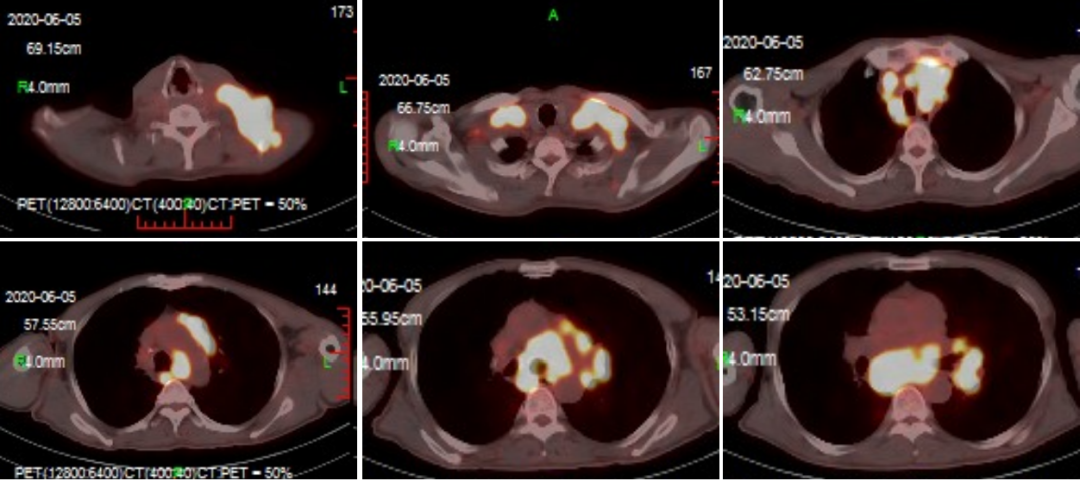
图1:2020年6月7日,治疗前PET-CT
病例一治疗经过
经患者充分知情同意并签署知情同意书后,于2020年6月11日、7月2日、7月27日、8月19日分别予以免疫联合化疗方案“替雷利珠单抗200 mg d0 + 白蛋白紫杉醇300 mg d1 + 卡铂400 mg d1,q3w,ivgtt”治疗。
疗效评价:PR。
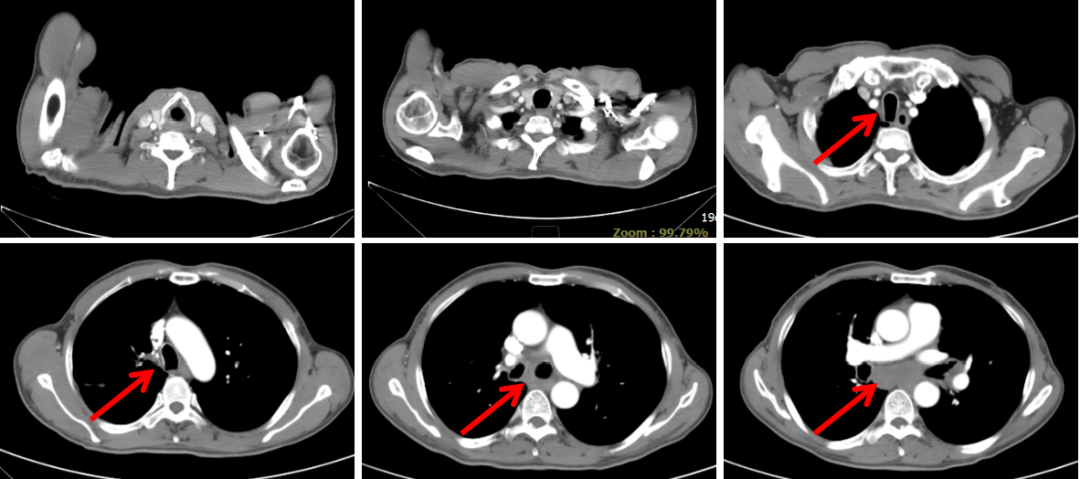
图2:2020年7月24日,联合治疗2周期后胸部CT
病例一总结
本例患者为左肺中心性鳞癌(cT4N3M1c,IVb期),伴多发淋巴结转移、左肺转移。经替雷利珠单抗联合化疗治疗,2个周期后左肺病灶和多发淋巴结转移病灶直径均明显缩小,疗效评价达到PR。患者目前已联合用药4周期,疗效持续PR,PFS近3个月,病情平稳,治疗过程中未出现明显消化道反应及骨髓抑制,安全性良好。
2病例二:SCLC
病例二基本情况
一般资料:患者男性,46岁。
主诉:刺激性干咳10余天,头晕7天。
现病史:患者于2020年1月25日因“刺激性干咳10余天,头晕7天”就诊于外院,行胸部CT检查提示“左肺门占位性病变”,头颅CT检查提示“小脑区囊性灶”,患者为求进一步治疗就诊于我院。
既往史:有高血压病史、心动过缓病史,具体不详;否认其他慢性病史;否认吸烟史,偶尔饮酒。
查体:双侧锁骨上未触及肿大淋巴结。双肺呼吸音清,未闻及干湿罗音,心脏听诊未及明显异常。余查体未见明显异常。
ECOG PS评分:1-2分。
胸部CT(我院):1.左中心型肺癌并左肺门淋巴结转移;2.考虑左肺纤维灶。
头颈MRI(我院):1.结合病史,脑多发转移瘤;2.筛窦炎。
支气管镜/纤维支气管镜检:左肺粘膜肿胀。
细胞学气管镜刷检涂片:查到癌细胞(考虑小细胞型)。
左肺穿刺活检:(左肺)结合免疫组化,符合小细胞癌。免疫组化:CKpan (+)、syn (+),CgA (+)、CK56 (+)、CK7 (+)、TTF-1 (+)、CK5/6 (-)、P40 (-)、Ki-67 90%。
诊断:1. 左肺上叶小细胞癌(广泛期,cT3N1M1,IV期),左肺门淋巴结转移、多发脑转移;2.右肺上叶结节;3. 高血压病(3级,极高危);4. 窦性心动过缓。
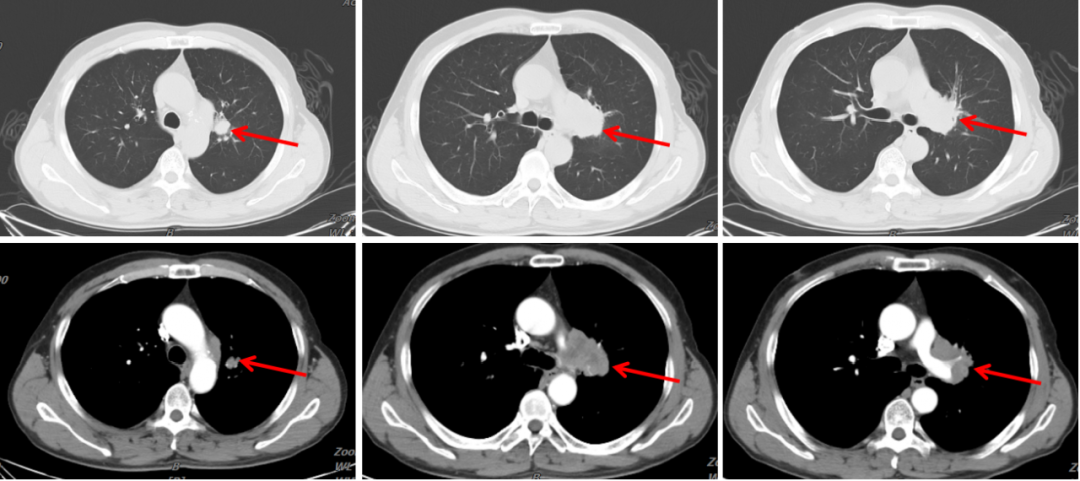
图3:2020年1月30日,治疗前胸部CT
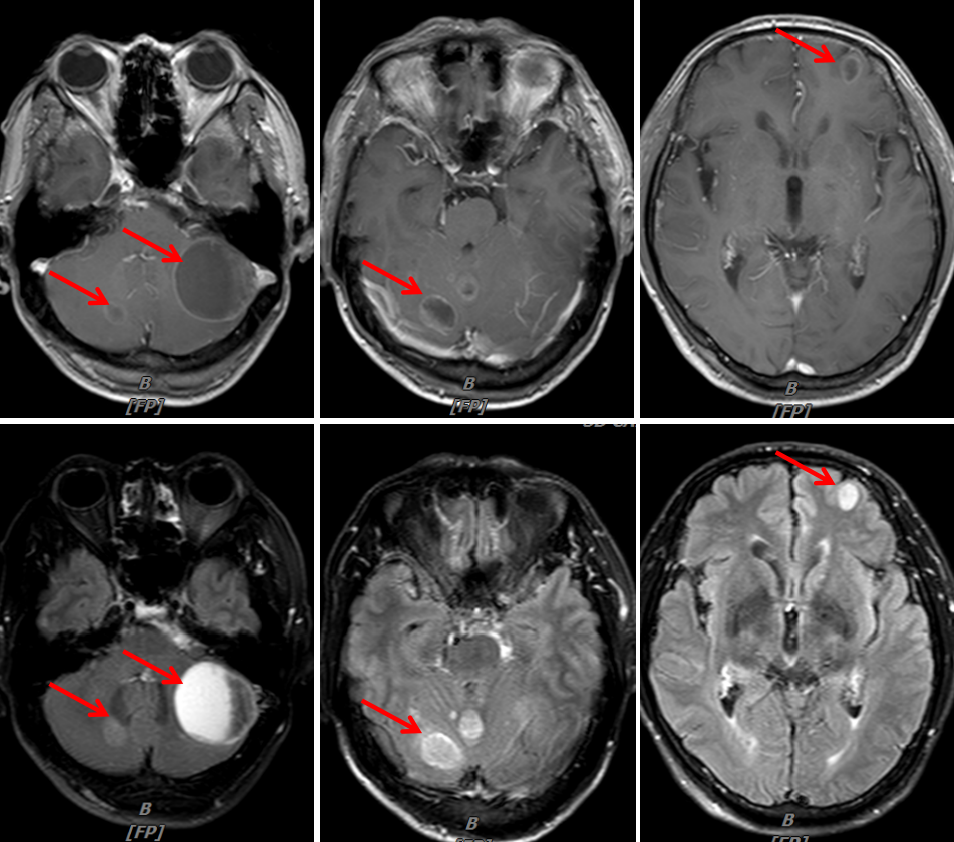
图4:2020年1月30日,治疗前头颅MRI
病例二治疗经过
经患者充分知情同意并签署知情同意书后,考虑予以免疫联合化疗治疗。于2020年2月7日先行1周期EP方案化疗:“依托泊苷(VP-16)0.1g d1-4 + 卡铂500 mg d1,q3w,ivgtt”;于2020年2月6日至3月6日间行全脑放疗(46Gy/23f);于2020年2月28日起行免疫联合化疗:“替雷利珠单抗200 mg d1 + 依托泊苷 0.1g d1-4 + 卡铂500 mg d1,q3w,ivgtt”,至今已应用替雷利珠单抗治疗9周期。
(1)治疗2周期
疗效评价:PR。
图5:2020年2月6日至3月6日,行全脑放疗
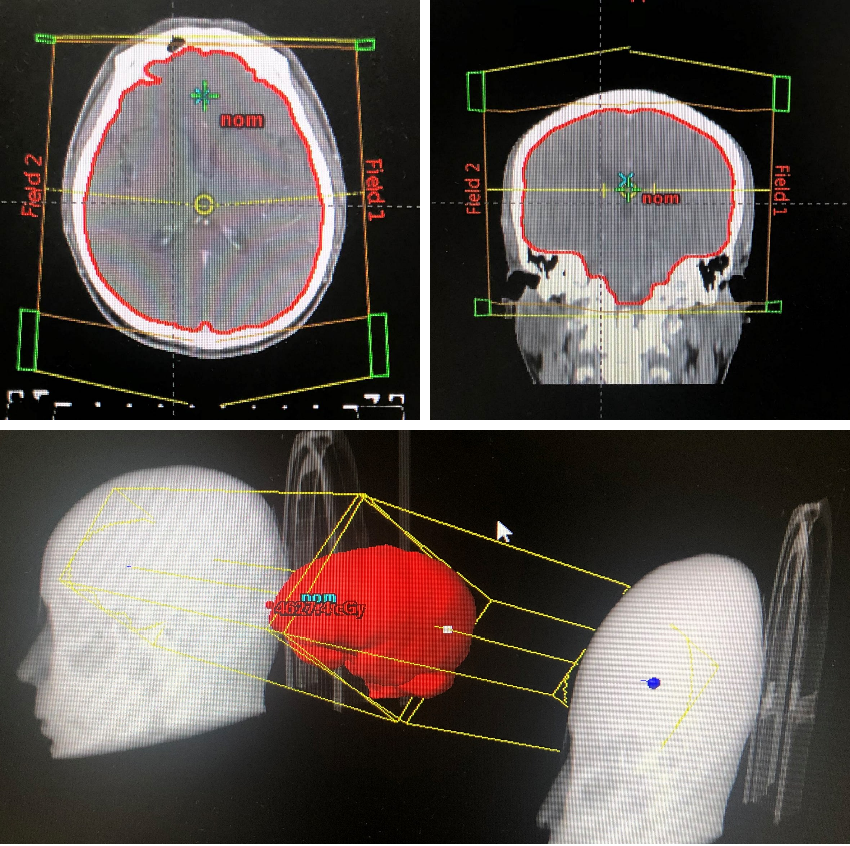
图6:2020年3月20日,联合治疗2周期后胸部CT
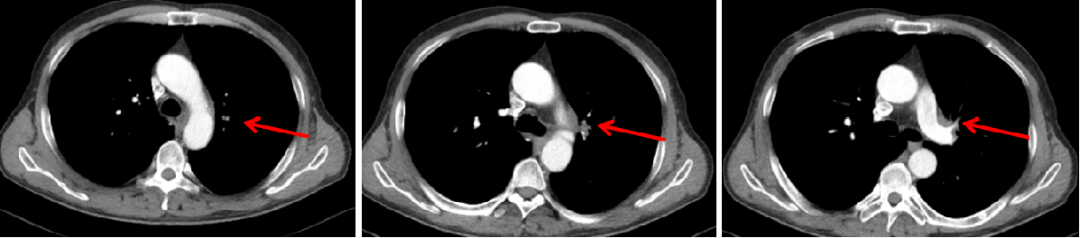
图7:2020年3月25日,联合治疗2周期后头颅MRI
(3)治疗4周期
疗效评价:持续PR。
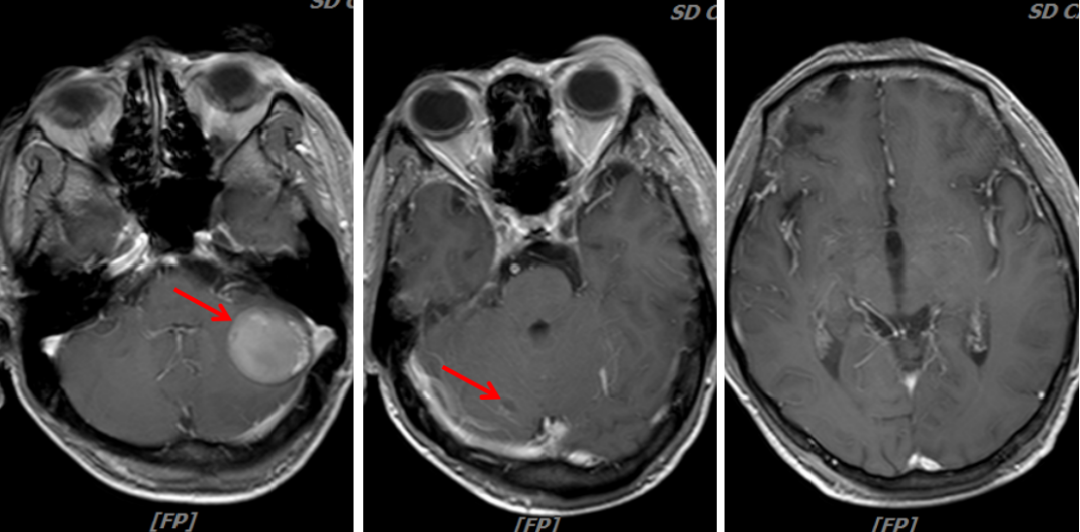
图8:2020年5月4日,联合治疗4周期后胸部CT
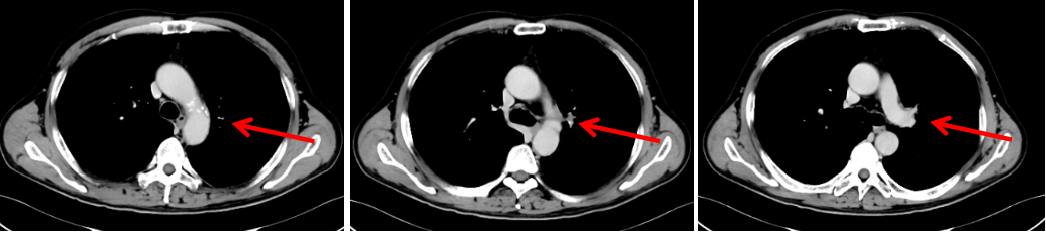
图9:2020年5月6日,联合治疗4周期后头颅MRI
(3)治疗6周期
PET-CT:无高代谢区。
疗效评价:CR。
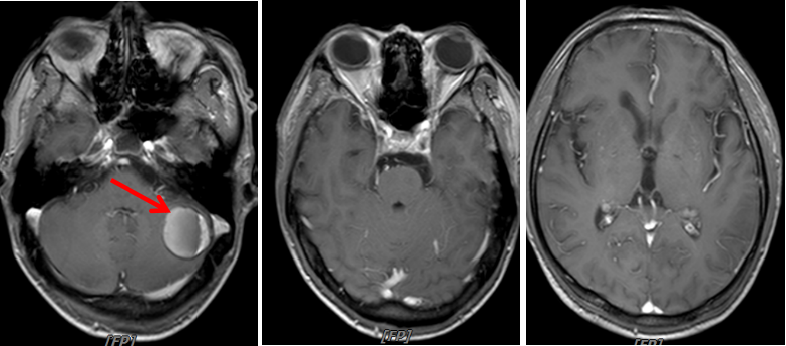
图10:2020年6月22日,联合治疗6周期后PET-CT
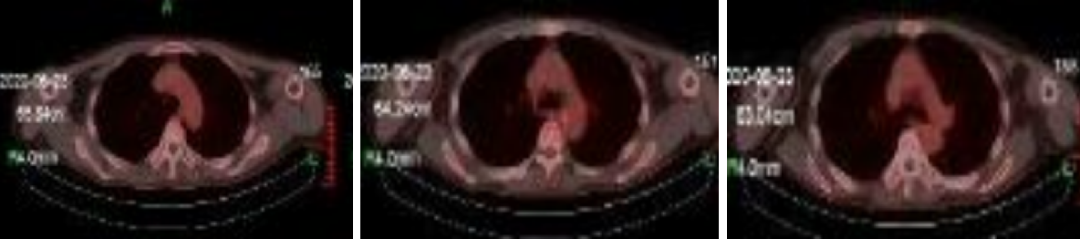
图11:2020年6月24日,联合治疗6周期后头颅MRI
病例二总结
本例患者为“左肺上叶小细胞癌(广泛期,cT3N1M1,IV期),伴左肺门淋巴结转移、多发脑转移”,考虑予以免疫联合化疗。为明确并监测患者可能出现的毒副反应,先予以患者1周期EP方案化疗,同时予以全脑放疗1个月。患者未出现明显不良反应,予以患者加用替雷利珠单抗免疫治疗2周期,疗效评价即达到PR,治疗6周期后疗效达到CR。随访至今PFS已超过7个月,疗效持续CR,安全性良好,患者可以耐受。
专家点评

朱慧 教授
山东省肿瘤医院
山东大学临床副教授
山东大学、济南大学肿瘤学硕士研究生导师
美国斯坦福大学肿瘤中心访问学者(国家公派)
山东省肿瘤医院首届“十百千人才”
中国抗癌协会放疗专业委员会肺癌学组委员
中国抗癌协会放疗专业委员会青年副主任委员
中国老年医学会放疗专业委员会常务委员
山东省抗癌协会放疗专业委员会常委、青年副主任委员
山东省医师协会放疗专业委员会住培委副主任委员
山东省医学会肺癌多学科联合委员会委员
肿瘤的治疗已经进入精准治疗时代,对于驱动基因阳性的肺腺癌,靶向治疗取得了非常大的成果。但对于病例一患者,由于鳞状NSCLC一直没有找到明确的驱动基因,治疗仍然停滞于化疗时代,一线治疗的中位生存期均不足1年[1-7],鳞状NSCLC在近20年来生存获益提高相当有限。
同样,对于病例二患者,广泛期小细胞肺癌(SCLC)在近30年来也只能依赖含铂化疗方案,OS仅为10~12个月,且目前已开展的分子靶向单药或联合化疗或联合抗血管生成药物在SCLC治疗领域的研究中,均未证实明确的生存获益,难以满足患者生存需求[8]。此外,SCLC因其侵袭力强、瘤体倍增时间短、早期即可发生远处转移,而成为恶性程度最高的肺癌类型。约有15%的患者在确诊时已存在脑转移,这类患者中位生存期仅为4~6个月[9-11],预后极差。
在鳞状NSCLC领域,KEYNOTE 407研究[12]开启了一线鳞癌免疫联合治疗的新时代,但该研究纳入的中国患者较少,尽管后续进行了中国人群扩展研究,但也仅纳入了125例中国鳞癌患者,且其中接受免疫联合化疗方案的患者仅65例,仍不足以满足我国一线免疫联合治疗的大样本量的三期临床研究需求。随着后续多项研究的失败,一线鳞状NSCLC患者再次陷入治疗选择上的困难。
一项替雷利珠单抗联合化疗一线治疗肺癌的多队列II期RATIONALE 206研究显示[13],鳞癌队列治疗ORR可达80%,DCR达到93.3%,体现出良好的治疗前景。随后,今年ASCO上公布的、针对中国人群的大型III期RATIONALE 307研究显示[14],对比传统化疗方案,替雷利珠单抗联合紫杉醇/白蛋白紫杉醇+卡铂方案能够显著提升患者无进展生存时间(7.6个月 vs 5.5个月)、提高患者的客观缓解率(ORR)(74.8% / 72.5% vs 49.6%)、改善患者的持续缓解时间(DOR)(8.6 / 8.2个月 vs 4.2个月)。病例一鳞状NSCLC患者经替雷利珠单抗治疗,起效快速,获得持续PR,安全性良好。
在SCLC领域,有研究提示免疫联合化疗一线治疗广泛期SCLC,相比单纯化疗OS显著延长近3个月,且一年后仍有23%的患者持续缓解[15]。此外,另一项全球多中心研究也显示[16],联合治疗方案的中位OS(12.3 vs 10.3个月)和中位PFS(5.2 vs 4.3个月)明显延长,疾病进展风险降低23%,提示化疗药物与免疫治疗药物可能具有协同抗肿瘤作用。
一项替雷利珠单抗联合化疗一线治疗肺癌的多队列II期RATIONALE 206研究显示[13],SCLC队列中替雷利珠单抗联合依托泊苷和铂类的ORR达到77%,DCR达到88%,中位OS达到15.6个月,中位PFS达到6.9个月。研究过程中,替雷利珠单抗相关的AE以轻、中度为主,患者整体耐受良好。病例二SCLC患者免疫联合化疗及全脑放疗,疗效达到CR,PFS已超过7个月,极大地延长了预后生存。
本期2例患者的优异疗效可能是基于替雷利珠单抗的独特结构优势——替雷利珠单抗对Fc段进行了特殊基因工程改造,可以避免Fc段与Fc&γ;R效应细胞的结合,最大限度地降低ADCP可能性,从而避免T细胞消耗,进而增强药物的抗肿瘤活性[18,19]。此外,替雷利珠单抗的Fab段具有独特的抗原结合表位,与靶点亲和力更强,解离速率较帕博利珠单抗和纳武单抗约放缓100倍和50倍,或可更彻底持久地阻断PD-1与PD-L1的结合,降低脱靶效应发生几率[20]。
无论是鳞状NSCLC还是SCLC,在既往均是肺癌领域的治疗难点。本期两例患者,经替雷利珠单抗治疗后均获得快速免疫应答和深度缓解,同时靶病灶和非靶病灶都获得了深度缓解,显现出较强的抗肿瘤疗效。免疫治疗开辟了肿瘤治疗的新途径,随着研究者们不断深入探索,也必将给肺癌的研究带来更多启发和思考,也期待替雷利珠单抗作为目前全球第二个、中国第一个全面获得一线鳞状及非鳞状NSCLC III期注册临床研究成功的PD-1抗体,能够早日获批适应症,成为我国肺癌患者的福祉。
参考文献:
[1] Kuribayashi K, et al. J Cancer Biol Res. 2014;2:1026.
[2] Bonomi PD, et al. J Clin Oncol 1989;7:1602-1613.
[3] Scagliotti GV, et al. J Clin Oncol. 2008 Jul 20;26(21):3543-51.
[4] Ciuleanu T, et al. Lancet. 2009 Oct 24;374(9699):1432-40.
[5] Pérol M, et al. J Clin Oncol. 2012 Oct 1;30(28):3516-24.
[6] Scagliotti G, et al. Oncologist. 2009 Mar;14(3):253-63.
[7] Thatcher N, et al. Lancet Oncol 2015;16:763-774.
[8] Arik Bernard Schulze, Georg Evers, Andrea Kerkhoff, et al. Future Options of Molecular-Targeted Therapy in Small Cell Lung Cancer.Cancers(Basel). 2019 May; 11(5): 690.
[9] Hu L, Zhang J, Zhu H, et a1. Biological characteristics of a specific brain metastatic cell line derived from human lung adenocarcinoma[J]. Med Oncol, 2010, 27(3): 708-714.
[10] Socha J, Kepka L. Prophy’lactic cranial irradiation for small-cell lung cancer:how, when and for whom?[J]. Expert Rev Anticancer Ther, 2012, 12(4): 505-517.
[11] Kalemkerian GP, Akefley W, Bogner P, et a1. Small cell lung cancer[J]. J Nail ComprCane Netw, 2013, 11(1): 78-98.
[12] Luis Paz-Ares et al. 2019 ESMO LBA082.
[13] Zhijie Wang, et al. CSCO 2018; Jun Zhao, et al. ASCO 2019; Zhijie Wang, et al. CSCO 2019.
[14] Jie Wang, et al. 2020 ASCO, Abstract 9554.
[15] Luis PA presented at 2019 WCLC.
[16] Liu SV et al., WCLC 2018. PL02.07.
[17] Dahan R, et al. Fc&γ;Rs Modulate the Anti-tumor Activity of Antibodies Targeting the PD-1/PD-L1 xis. Cancer Cell. 2015;28(3):285-95.
[18] Zhang T, et al. The binding of an anti-PD-1 antibody to Fc&γ;RΙ has a profound impact on its biological functions. Cancer Immunol Immunother. 2018;67(7):1079-1090.
[19] Abstract #4048 American Association for Cancer Research March 29-April 3, 2019, Atlanta, GA.
中国医学论坛报编辑 | 蔺磐 整理