2020年ESMO指南: 胃肠胰神经内分泌肿瘤的诊治和随访
2020年,欧洲肿瘤内科学会在时隔8年后推出了新版胃肠胰神经内分泌肿瘤诊治与随访指南。在此将指南的精华浓缩翻译分享给大家参考。

神经内分泌肿瘤概述
神经内分泌肿瘤(Neuroendocrineneoplasms, NENs) 是起源于神经内分泌细胞的肿瘤,可以发生在体内任何部位,但最常见的是胃、肠、胰腺等消化系统器官,其次为肺。NENs包括分化好的神经内分泌瘤(neuroendocrinetumours,NETs)以及分化差的神经内分泌癌(neuroendocrinecarcinomas,NECs)。该指南主要关注点为散发性小肠NENs(smallintestinal NENs, SI-NENs) 和胰腺NENs(pancreaticNENs, Pan-NENs)的诊治,因为这是晚期胃肠胰(gastroenteropancreaticneuroendocrine neoplasms,GEP)-NENs中最常见的类型, 而其他胃肠道来源的NENs处理均应遵循同样的原则。肿瘤的增殖活性、生长抑素受体(somatostatinreceptor , SSTR) 的表达水平、肿瘤的生长速度以及肿瘤负荷均为临床治疗决策制定过程中需要考虑的重要因素。
诊断与病理/分子生物学
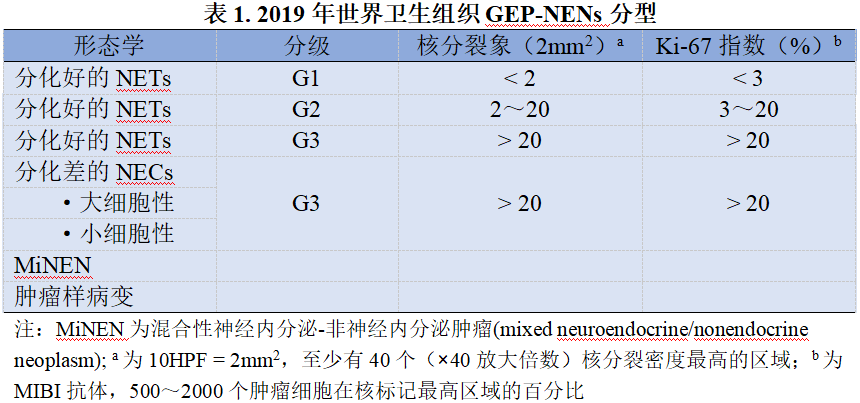
2020版指南采用了2019年世界卫生组织GEP-NENs的分类标准(表1)。病理诊断报告中需要包括形态学、肿瘤分级、嗜铬蛋白A(CgA)和突触素(Syn) 等免疫组化染色。根据临床需要选择行SSTR或肽类激素(如胃泌素、胰岛素、胰高血糖素和血清素等) 的特异性染色。
分期和风险评估
TNM(tumour, node and metastasis) 分期和肿瘤分级是两项主要的孤立预后因素,应持续进行评估。CT及MRI是最常用的影像学评估手段。而对于CT或MRI均无法明确的肝脏病灶,超声造影有时不失为一种很好的检查方法。内镜超声是目前诊断Pan-NETs的最佳成像方法,且可进行胰腺病灶穿刺活检明确病理诊断。SSTR功能显像是NENs重要的检查手段。68Ga、64Cu标记的生长抑素类似物(somatostatinanalogues,SSA) PET-CT可以分辨出绝大多数的NET病灶,并可用于疾病分期、术前影像学评估和疾病再分期。18F-FDG-PET-CT更有利于评估G3 NENs 和Ki-67指数较高的G2 NENs。若18FDG-PET-CT显示摄取阳性提示NENs预后较差。对于所有G2级以上NENs患者同时行18FDG-PET-CT和68Ga-SSA-PET-CT检查可能获得最佳的诊断和预后信息,但应个体化评估,平衡潜在优势和经济成本。
局部/局部进展期病变的处理
对于局部/局部进展期G1/G2 NETs,手术切除是首选的治疗方法。肿瘤长径<2 cm无症状的无功能Pan-NETs可以选择观察等待而无需立即手术,可以采用每年1次的高质量影像学检查进行观察。伴随疾病较多且胰头部位病灶只能行胰十二指肠切除术的老年患者,可以考虑观察等待。出现局部侵犯征象的年轻患者,应行标准胰腺切除术和淋巴结清扫术。对于有功能的Pan-NETs,无论肿瘤大小,均应考虑手术切除。肿瘤长径>2 cm的Pan-NETs推荐标准胰腺切除术联合区域淋巴结切除术。局部剜除适用于肿瘤长径<2 cm有功能的Pan-NETs(如胰岛素瘤)。对于SI-NETs,根治性切除手术可以降低肠道并发症(肠梗阻和局部缺血) 的发生风险,并且可以改善预后。
进展期/转移性病变的管理
1. 转移性病变的手术治疗
对于Ⅳ期GEP-NETs患者,如果转移病灶仅在或主要累及肝脏,可以选择手术治疗。对于晚期SI-NETs,为了预防肠梗阻或肠缺血相关并发症,可考虑行姑息性原发病灶切除。对于肿瘤负荷大的转移性有功能的SI-NETs(如类癌综合征) 或有功能的Pan-NETs, 减瘤手术可以减轻相关症状。对于不可切除的肝转移,肝移植可能是较好的选择,也可以考虑肝动脉栓塞或局部消融治疗。手术切除联合术中射频消融可以达到根治性手术的目的,并可以保留足够的肝功能。
2. 术后辅助治疗
对于G1/G2 NETs,不推荐行术后辅助治疗,但是对于NEC可以考虑铂类为基础的辅助化疗。
3. 控制功能性GEP-NENs症状的药物治疗
长效奥曲肽或兰瑞肽为功能性NETs的标准一线治疗,可以改善70%~80%的类癌综合征症状(潮红和腹泻)。短效奥曲肽皮下注射可用于症状间歇性加重的补救治疗。常规治疗失败时,可以考虑使用长效帕瑞肽。症状顽固时,可以采用IFN-α联合SSA作为二线治疗。Telotristat ethyl是血清素合成限速酶,已被批准用于SSA治疗后仍有类癌综合征腹泻的患者。对于转移性胰岛素瘤或疾病进展时的难治性类癌综合征,还可以选择依维莫司治疗。其他控制症状的药物还包括:氯甲苯噻嗪用于转移性胰岛素瘤,PPI可以长期控制转移性胃泌素瘤的症状。
4. 抗增殖治疗
GEP-NENs的抗增殖治疗包括生物治疗(SSA、IFN-α)、靶向药依维莫司、舒尼替尼和化疗。 SSTR阳性,生长缓慢且Ki-67指数≤10%的晚期GI-和Pan-NETs,推荐使用SSA控制肿瘤生长。 IFN-α可考虑用于SSTR功能显像阴性,特别是中肠NETs患者。推荐依维莫司用于化疗或未化疗过的进展期G1/G2 Pan-NETs和明确进展的无功能GI-NETs。功能性Pan-NETs可以考虑SSA联合依维莫司治疗。推荐舒尼替尼用于进展期Pan-NETs的治疗。
5. 全身化疗
推荐化疗用于进展期Pan-NETs和任一部位的进展期G3 NENs,而对于分化良好、生长缓慢的GI-NETs不推荐全身化疗。然而,但对于短期内快速进展或Ki-67指数接近于G3的G2 NETs患者则可考虑。链脲霉素联合5-氟尿嘧啶化疗一直是晚期G1/G2 Pan-NETs的一线推荐。也可以采用替莫唑胺单药或替莫唑胺联合卡培他滨(CAPTEM)作为晚期Pan-NETs的治疗。转移性高级别NEC推荐顺铂/依托泊苷或卡铂/依托泊苷方案进行一线化疗。二线治疗没有明确方案,替莫唑胺单药或CAPTEM和/或贝伐珠单抗,5-氟尿嘧啶或卡培他滨联合奥沙利铂或伊立替康等方案可以考虑。
6. 肽受体放射性核素治疗(peptidereceptor radionuclide therapy,PRRT)
PRRT用于SSTR功能显像显示为SSTR高表达的进展期NETs。177Lu-DOTATATE推荐用于进展的中肠NETs和Pan-NETs的治疗。177Lu-DOTATATE治疗的安全性较好,但仍有3%~4%的患者治疗后可能出现不可逆的骨髓毒性,如白血病或骨髓增生不良,30%的患者发生1/2级长期的肾损伤。对于类癌综合征患者,SSA应与PRRT联合使用,以预防PRRT治疗后腹泻和/或潮红及激素分泌危象等症状的加重。
随访和生存
随访应该是终生的,包括临床症状的观察、生化指标的检测、常规影像学和SSTR功能显像检查。对于R0/R1切除的G1和G2(Ki-67指数<5%) NETs,建议每6个月进行1次影像学检查,Ki-67指数>5%的G2 NETs 则每3个月复查1次,NEC 每2~3个月复查1次。来源于阑尾或直肠的小的(<1 cm) 局部G1 NETs ,行R0切除且无不良组织学特征,不需要随访。随访过程中,如果出现新发肝转移或其他部位转移,或肿瘤生物学行为发生变化(如短时间内快速进展),建议再次活检评估分级。