乳腺癌中DKKL1的表达、作用及机制探讨
乳腺癌中DKKL1的表达、作用及机制探讨
王 丁1,甘 霖2,张国铎1,刘 莉3,陈 艳3
Expression and effects of DKKL1 in breast cancer and its mechanism
WANG Ding1, GAN Lin2, ZHANG Guoduo1, LIU Li3, CHEN Yan3
作者单位
1. 重庆市中医院普外科,重庆 400011;2. 重庆市中医院甲状腺乳腺外科,重庆 400011;3. 重庆市中医院手术室,重庆 400011
基金项目
重庆市科研机构绩效激励引导专项(编号:cstc2018jx1130063)
AUTHORS FROM
1. Department of General Surgery, Chongqing Traditional Hospital, Chongqing 400011, China; 2. Department of Thyroid and Breast Surgery, Chongqing Traditional Hospital, Chongqing 400011, China; 3. Department of Surgical Anesthesiology, Chongqing Traditional Hospital, Chongqing 400011, China
GRANT
Chongqing Scientific Research Institutions Performance Incentive Guidance Project(No. cstc2018jx1130063)
[摘要]
目的:研究Dickkopf样蛋白1(dickkopf-like protein 1,DKKL1)基因在乳腺癌组织和细胞系中的表达水平,探讨DKKL1基因过表达对人乳腺癌MDA-MB-231和MCF-7细胞增殖、迁移的影响及其分子作用机制。
方法:采用实时荧光定量PCR检测乳腺癌细胞系、80例人乳腺癌和癌旁组织以及20例正常乳腺组织中DKKL1 mRNA的表达水平;免疫组织化学法检测人乳腺癌组织中DKKL1蛋白的表达水平并分析与患者临床病理特征的相关性。选取表达水平最低的MDA-MB-231和MCF-7细胞,分别转染空载体pcDNA3.1(+)-Flag质粒(作为对照组)和重组pcDNA3.1(+)-Flag-DKKL1质粒(作为实验组)后,采用蛋白质印迹法验证DKKL1蛋白是否过表达;然后分别采用CCK-8法、软琼脂克隆形成实验、吖啶橙/溴化乙锭双染实验和Transwell小室迁移实验检测MDA-MB-231和MCF-7细胞增殖和迁移的变化;并采用蛋白质印迹和实时荧光定量PCR法分别检测DKKL1过表达对上皮-间质转化及下游靶分子表达和Wnt/&β;-连环蛋白(&β;-catenin)通路的影响。
结果:人乳腺癌细胞系MDA-MB-231、MCF-7、BT549、MDA-MB-468、T47D和ZR-75-1中DKKL1 mRNA表达水平均明显低于正常乳腺上皮细胞MCF-10A(P 值均<0.001)。与20例正常乳腺组织和80例配对癌旁组织相比,人乳腺癌组织中DKKL1 mRNA和蛋白表达均明显下调(P 值均<0.01);DKKL1蛋白表达与乳腺癌的淋巴结转移、组织学分级及TNM分期具有明显相关性(P 值均<0.05)。DKKL1过表达质粒转染后,乳腺癌MDA-MB-231和MCF-7细胞中DKKL1蛋白的表达水平明显上调,而细胞增殖、克隆形成、凋亡和迁移能力均被明显抑制(P 值均<0.001)。DKKL1过表达可上调上皮标志物E-钙黏蛋白(E-cadherin)mRNA及蛋白表达水平,同时下调波形蛋白(Vimentin)、N-钙黏蛋白(N-cadherin)、Snail、BMI-1、KLF4和CD44 mRNA及蛋白的表达水平(P 值均<0.001)。DKKL1过表达后活化的&β;-catenin蛋白、磷酸化的糖原合成酶激酶-3&β;(glycogen synthase kinase 3&β;,GSK-3&β;)蛋白及其下游c-Myc和cyclin D1蛋白的表达水平均明显下调(P 值均<0.001)。
结论:乳腺癌组织和细胞系中DKKL1表达水平下调,可能通过拮抗Wnt/&β;-catenin信号通路调控乳腺癌的发展进程。
[关键词]乳腺肿瘤;DKKL1基因;细胞增殖;细胞运动;Wnt/&β;-catenin信号通路
[ABSTRACT]
Objective: To investigate the expression of dickkopf-like protein 1(DKKL1) in human breast cancer tissues and cell lines, and to analyze the effects of DKKL1 overexpression on the proliferation and migration of breast cancer MDA-MB-231 and MCF-7 cell lines, and to explore the possible mechanism.
Methods: The real-time fluorescent quantitative-PCR was performed to detect DKKL1 mRNA expression levels in human breast cancer cell lines and tissues, respectively. The expression of DKKL1 protein in human breast cancer tissues was detected by immunohistochemistry, and the relationship between the expression of DKKL1 protein and the clinicopathological characteristics of breast cancer patients was analyzed. The pcDNA3.1(+)-Flag(Vetor group) and pcDNA3.1(+)-Flag-DKKL1(experimental group) plasmids were transfected into breast cancer MDA-MB-231 and MCF-7 cells, then the expression of DKKL1 was detected by Western blotting. The effects of DKKL1 overexpression on the proliferation and migration of MDA-MB-231 and MCF-7 cells were investigated by CCK-8, soft agar colony formation, acridine orange/ ethidium bromide double staining and Transwell chamber assay, respectively. Western blotting and real-time fluorescent quantitative-PCR were used to detect the effects of DKKL1 overexpression on the epithelial-mesenchymal transition(EMT) progress, its downstream target molecule expressions and Wnt/&β;-catenin pathway.
Results: The expression of DKKL1 mRNA was down-regulated in MDA-MB-231, MCF-7, BT549, MDA-MB-468, T47D and ZR-75-1 as compared with the normal breast MCF-10A cells(all P < 0.001). The expression level of DKKL1 mRNA as also lower in human breast cancer than those in 20 cases of normal breast tissues and 80 cases of matched cancer adjacent tissues(all P < 0.01). The expression level of DKKL1 proteins were correlated with lymph node metastasis, histological grade and TNM stage(all P < 0.05). After transfection with DKKL1 overexpression plasmids, the expression of DKKL1 protein in MDA-MB-231 and MCF-7 cells was significantly up-regulated, while the cell proliferation, colony formation, apoptosis and migration were significantly inhibited(all P < 0.001). Furthermore, the overexpression of DKKL1 up-regulated the mRNA and protein expressions of E-cadherin (P < 0.001), and downregulated the mRNA and protein expressions of Vimentin, N-cadherin, Snail, BMI-1, KLF4 and CD44(all P < 0.001). Moreover, after DKKL1 overexpression, the expressions of active &β;-catenin and its downstream targets including phosphorylated GSK-3 &β;, c-Myc and cyclin D1 were downregulated(all P < 0.001).
Conclusion: DKKL1 expression is down-regulated in breast cancer cell lines and tissues, and DKKL1 may be a functional tumor suppressor regulating tumorigenesis of breast cancer by antagonizing Wnt/&β;-catenin signaling pathway.
[Key words]Breast neoplasms; DKKL1 gene expression; Cell proliferation; Cell movement; Wnt/&β;-catenin signaling pathway
乳腺癌是中国乃至全球女性最常见的恶性肿瘤之一,近年来其发病率和死亡率有逐年上升的趋势[1-2]。2019年全球肿瘤数据统计结果显示:乳腺癌发病率高居全球恶性肿瘤的首位,其在所有女性肿瘤中占比约30%;乳腺癌死亡率和死亡人数是女性恶性肿瘤死亡原因的第2位[3]。尽管外科手术、新辅助化疗、内分泌治疗、靶向治疗和术后放疗等临床综合治疗手段在一定程度上延长了患者总生存期,但乳腺癌患者仍有临床复发可能;尤其是对于局部晚期或转移性乳腺癌患者,化疗和靶向治疗等引起的不良反应仍无有效的规避方法[4]。因此,选择能早期诊断及提升预后评估效率的方法,以及探索新的治疗方式,对延长乳腺癌患者生存期、提高其生存质量具有重要意义。
Dickkopf样蛋白(dickkopf-like protein,DKKL)1是一种精子顶体相关基因的表达产物,属于分泌型糖蛋白,在Wnt信号家族成员筛选过程中得到鉴定。Dickkopf相关蛋白(dickkopf-related proteins,DKKs)家族的成员可与Wnt共受体即低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein,LRP)结合并调节其活性,从而调控Wnt信号的转导[5-6];此功能由2个与LRP细胞外结构域结合的富含半胱氨酸(Cys)的保守结构域介导[7-9]。DKKL1功能不同于DKKs家族成员:DKKL1与DKKs成员的同源性仅限于DKK3中的离散区域,而且DKKL1缺乏两个富含Cys的LRPs相互作用域,但DKKL1能否调控肿瘤的进程尚不清楚。本研究拟分析乳腺癌中DKKL1基因的表达水平及其与临床病理特征的相关性,并探讨DKKL1基因过表达对乳腺癌细胞功能的影响及其分子机制,以期阐明DKKL1基因参与乳腺癌发生、发展的相关通路,为乳腺癌诊断和治疗提供新的潜在靶点。
1 材料与方法
1.1
病例来源及其资料信息
收集2012年1月—2016年1月由重庆市中医院普外科和甲状腺乳腺外科收治的80例乳腺癌患者的手术标本,包括乳腺癌组织和癌旁正常组织,其中癌旁组织距肿瘤边缘3~5 cm;同时收集20例正常乳腺组织,均为重庆市中医院普外科行乳腺整形相关手术时获取。乳腺癌患者的年龄范围为32~69,中位年龄为55.4岁;所有患者在术前均未接受过放疗、化疗、靶向治疗或免疫治疗。临床样本的收集和使用均通过重庆市中医院伦理委员会批准,并经所有患者签字同意。所有组织及样本的临床病理均由本院病理科医师确诊和提供。
1.2
细胞及主要试剂
7株乳腺癌细胞系(MDA-MB-231、MCF-7、BT549、MDA-MB-468、T47D、ZR-75-1和SK-BR-3)购自美国模式培养物保藏所(American type culturecollection,ATCC)细胞库,正常乳腺上皮细胞(MCF-10A)购自中国科学院上海生命科学院细胞资源中心。RPMI 1640 细胞培养液和胎牛血清购自美国Gibico公司。重组质粒pcDNA3.1(+)-Flag-DKKL1(货号:Z9250)和空载体质粒pcDNA3.1(+)-Flag购自广州复能基因有限公司;转染试剂Lipofectamine 2000购自美国Invitrogen公司。PCR引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。实时荧光定量PCR试剂框购自美国KAPA Biosystems公司。吖啶橙/溴化乙锭双染液购自美国σ公司。Transwell小室试剂框购自美国Millipore公司,CCK-8试剂框购自日本同仁株式会社化学研究所。鼠抗人DKKL1单克隆抗体购自英国Abcam公司,鼠抗人E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、N-钙黏蛋白(N-cadherin)、Snail、B细胞特异性莫洛尼白血病毒插入位点1(B-cell specific moloney leukemia virus insertion site-1,BMI-1)、Kruppel样因子4(Kruppel-like factor 4,KLF4)、CD44、总&β;-环连蛋白(&β;-catenin)、活化的&β;-catenin和磷酸化糖原合成酶激酶-3&β;(phospho-glycogen synthase kinase-3 &β;,p-GSK-3&β;)、转录信号转导子和激活子3(transcriptional signal transducer and activator 3,STAT3)、SRY染色体连锁基因构成的基因家族2(SRY-related HMG框-2)、细胞性骨髓细胞瘤病病毒癌基因(cellular-myelocy-tomatosis viral oncogene,c-Myc)、细胞周期蛋白D1(cyclin D1)和&β;-actin单克隆抗体均购自美国CST公司。
1.3
实时荧光定量PCR检测乳腺癌细胞和组织中DKKL1及相关基因的表达
分别收集7株乳腺癌细胞(MDA-MB-231、MCF-7、BT549、MDA-MB-468、T47D、ZR-75-1和SK-BR-3)、正常乳腺上皮MCF-10A细胞以及组织样本(参阅1.1节),用TRIzol试剂抽提细胞和组织的总RNA,用Nano Drop 2000分光光度计测定RNA浓度。将RNA反转录为cDNA,行实时荧光定量PCR检测DKKL1 mRNA的表达水平。检测流程参阅实时荧光定量PCR检测试剂框提供的操作说明书和参考文献[9]提供的步骤进行。PCR扩增反应条件:95 ℃预变性10 min;95 ℃变性15 s,55 ℃退火并延伸1 min,共40个循环。以2-&δ;&δ;Ct值表示DKKL1 mRNA的相对表达水平。
1.4
免疫组织化学法检测乳腺癌组织中DKKL1表达及其与临床病理特征的关系
采用免疫组织化学方法检测乳腺癌组织中DKKL1蛋白的表达情况,具体步骤参阅参照文献[10];主要过程包括:组织切片脱蜡、脱缸、抗原修复(微波热修复法)、3% H2O2室温下消除内源性氧化物酶活性,封闭液封闭后、加入一抗和二抗孵育、DAB显色、苏木精复染细胞核、封固。在倒置光学显微镜下随机选取5个视野,计算相对光密度。选用已知阳性切片作阳性对照,PBS代替一抗作阴性对照。免疫组织化学的评分标准参阅参考文献[11],由2位病理医师采用双盲法阅片,判定DKKL1蛋白在乳腺组织中的表达情况。按染色深浅进行评分:无阳性染色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分;按阳性染色细胞所占百分比进行评分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;将二者相乘,0~4分为低表达组,4~12分为高表达组。最后分析DKKL1蛋白表达与乳腺癌临床病理特征的关系。
1.5
细胞培养、质粒转染和实验分组
乳腺癌细胞用含10%胎牛血清的RPMI 1640培养液,置于37 ℃、CO2体积分数为5%的细胞培养箱中培养;2~3 d后细胞培养瓶中RPMI 1640培养液变黄时,常规用胰蛋白酶消化并离心,更换培养液继续培养。
将活性状态下的乳腺癌MDA-MB-231和MCF-7细胞(约1×105个)消化、离心,接种于6孔板中,待细胞融合度为60%~70%时进行质粒转染[10]。采用Lipofectamine 2000,分别将重组质粒pcDNA3.1(+)-Flag-DKKL1(实验组)或空载体质粒pcDNA3.1(+)-Flag(对照组)转入MDA-MB-231和MCF-7,继续培养48 h,加入含有待成活的细胞G418的RPMI 1640培养液;继续培养约2周时形成单克隆,收集细胞进行相应的功能检测。
1.6
CCK-8法和软琼脂克隆形成实验检测DKKL1对细胞增殖活性的影响
CCK-8法:分别将实验组和对照组乳腺癌MDA-MB-231和MCF-7细胞消化后离心、计数,将细胞稀释至3×103个/mL,每孔接种100 μL的细胞悬液于96孔板中。在检测前1 h,各孔中分别加入20 μL CCK-8试剂,避光孵育0、24、48和72 h后,通过酶标仪检测490 nm波长处的D值,并绘制细胞生长曲线。
软琼脂克隆形成实验:收集对数生长期的实验组和对照组乳腺癌MDA-MB-231和MCF-7细胞,消化、离心后,将细胞稀释至3×103个/mL以备用。基本方法包括:用蒸馏水分别制备浓度为1.3%和0.8%的低溶点琼脂,并按体积比为1∶1分别与RPMI 1640培养液混合,待其自然冷却凝固,形成双琼脂层;再加入0.1 mL各组细胞悬液,充分混匀后平铺于1.3%琼脂糖底层培养皿中,待上层琼脂凝固后,置于细胞培养箱中继续培养约2周;观察克隆形态并计数,以对照组的克隆形成能力为1,计算实验组的相对克隆形成率。
1.7
吖啶橙/溴化乙锭双染实验检测DKKL1对细胞细胞凋亡的影响
待细胞转染后48 h,将实验组和对照组细胞悬液置于盖玻片上培养至对数生长期,然后用95%乙醇溶液固定5 min,用PBS洗涤细胞,加入100 μg/mL吖啶橙溶液和100 μg/mL溴化乙锭溶液,4 ℃避光环境下染色10 min。使用荧光显微镜评估细胞形态变化,包括核凝结和细胞收缩;分别取5个不同的视野进行分析,细胞凋亡率(%)=凋亡细胞数/计数细胞总数×100%。
1.8
Transwell小室法检测DKKL1对细胞迁移的影响
收集实验组和对照组乳腺癌MDA-MB-231和MCF-7细胞,消化离心后,倒置光学显微镜下计数,取4×103个/孔接种于Transwell小室的上室,下室中加入含15%胎牛血清的RPMI 1640培养液约1 mL。将Transwell小室放入细胞培养箱中,继续培养20 h后取出小室,固定、染色,光学显微镜下观察细胞形态并随机选取5个视野计数,并评价细胞迁移能力。
1.9
蛋白质印迹法检测相关蛋白表达
取乳腺癌组织和细胞系,收集蛋白并用BCA法测定蛋白浓度,每孔上样50 μg蛋白液;行SDS-PAGE分离蛋白,然后转移至PVDF膜上。加入TBS配制的5%脱脂奶粉封闭液,室温封闭1 h,加入一抗(体积稀释比均为1∶500),4 ℃孵育过夜;用Tris磷酸盐缓冲液漂洗2~3次,每次15 min;室温下加入二抗(辣根过氧化物酶标记的羊抗鼠IgG,体积稀释比为1∶2 000),封闭孵育1~2 h,TBST漂洗2~3次;显色剂显色。采用Bio-Rad 2000型凝胶成像系统扫描,对各条带进行吸光度分析,以目的基因与内参&β;-actin的比值表示目的蛋白的表达量。
1.10
统计学分析
应用SPSS 16.0统计学软件进行数据分析。实验均孤立重复3次,计量资料以 ¡À s表示。两孤立样本间比较采用双侧t检验;多组数据比较采用方差分析,组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1
人乳腺癌组织和细胞系中DKKL1表达下调
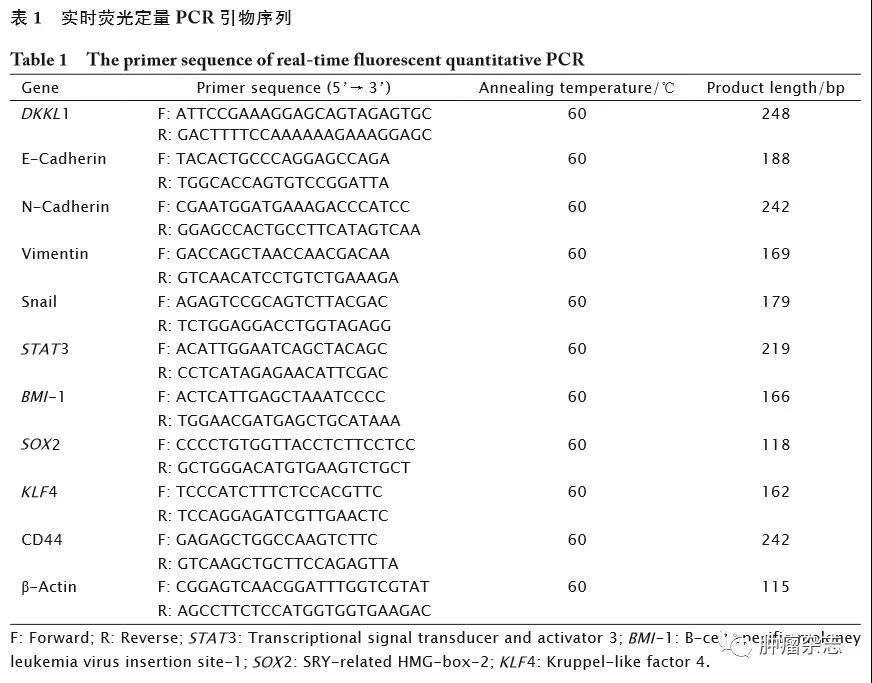
实时荧光定量PCR检测结果(图1A)显示,与正常乳腺上皮细胞MCF-10A相比,DKKL1 mRNA在乳腺癌MB-231、MCF-7、BT549、MDA-MB-468、T47D和ZR-75-1细胞中表达下调(P<0.001),并以MB-231和MCF-7细胞中DKKL1 mRNA表达水平最低。
进一步采用实时荧光定量PCR法检测人乳腺癌组织中DKKL1 mRNA的表达情况。结果显示,与正常乳腺组织(20例)相比,DKKL1 mRNA在乳腺癌组织(80例)中表达下调,差异具有统计学意义(图1B,P<0.001);与癌旁组织(80例)相比,DKKL1 mRNA在乳腺癌组织(80例)中表达下调,差异具有统计学意义(图1C,P=0.003 1)。上述结果提示,DKKL1 mRNA在乳腺癌细胞系和组织中表达下调,其可能作为潜在的抑癌基因参与乳腺癌的发生与发展进程。
2.2
乳腺癌组织中DKKL1蛋白表达下调
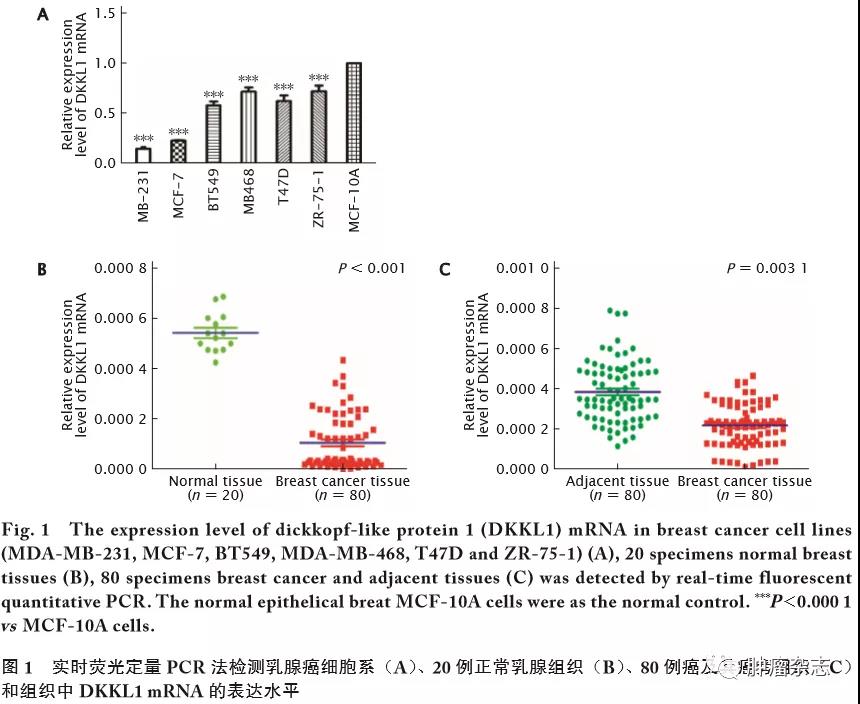
免疫组织化学法分析80对乳腺癌癌旁和乳腺癌组织中DKKL1蛋白的表达情况。应用IPP 6.0软件分析DKKL1蛋白表达水平,结果(图2)显示,癌旁组织的DKKL1蛋白的光密度值为0.213±0.011,乳腺癌组织中DKKL1蛋白的光密度值为0.134±0.023;与癌旁组织相比,乳腺癌中DKKL1蛋白表达下调,差异具有统计学意义(t=16.66,P<0.001)。
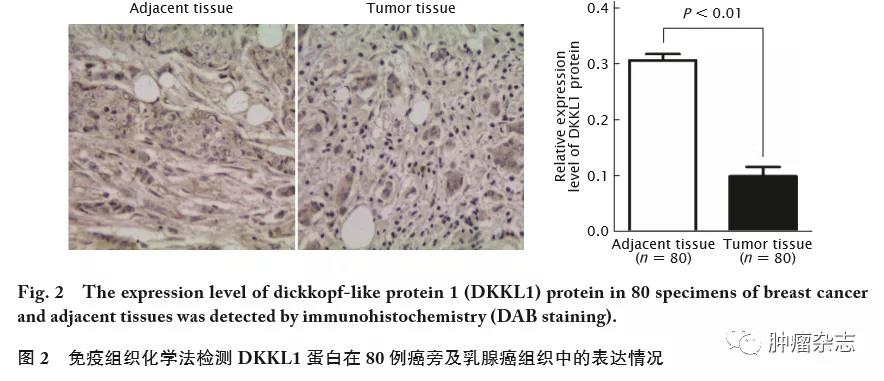
进一步分析DKKL1蛋白表达与乳腺癌临床病理特征的相关性,结果(表2)显示,乳腺癌中DKKL1蛋白表达与淋巴结转移(P=0.033)、组织学分级(P=0.011)和TNM分期(P=0.034)均相关,与患者年龄、肿瘤直径、ER、PR和HER-2表达状况均无明显相关性(P 值均>0.05)。这一结果提示,DKKL1可能参与乳腺癌的进程。
2.3
DKKL1基因过表达抑制乳腺癌细胞增殖
为验证DKKL1是否作为功能性抑癌基因参与乳腺癌的发生和发展,本课题组选择表达水平较低的乳腺癌细胞系MDA-MB-231和MCF-7作为研究对象,采用基因转染技术将DKKL1基因重组质粒转染进入乳腺癌细胞,然后采用蛋白质印迹法证实DKKL1过表达(图3A)。进一步采用CCK-8实验检测发现:DKKL1过表达的MDA-MB-231和MCF-7细胞培养48和72 h后,细胞存活率明显下降,差异具有统计学意义(图3B,t值分别为12.48和13.12,P<0.001)。软琼脂克隆形成实验结果显示:与对照组相比,过表达DKKL1后,MDA-MB-231 和MCF-7细胞克隆形成能力明显受到抑制,克隆团的大小和体积明显小于对照组细胞(图3C,t 值分别为22.14和17.16,P<0.001)。
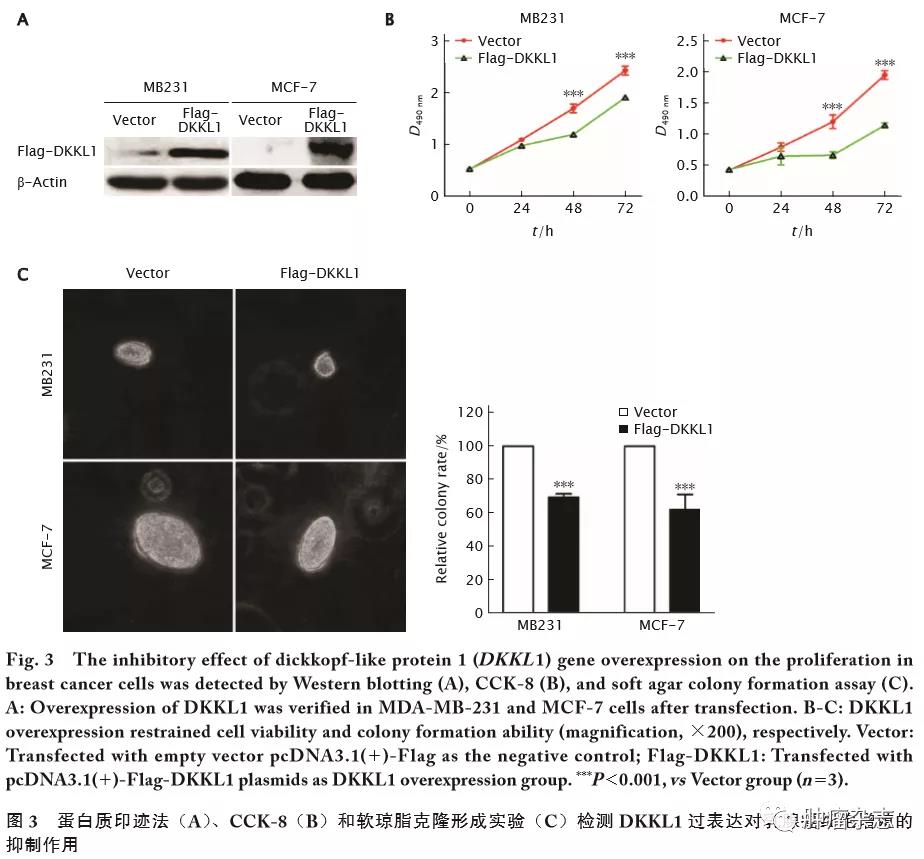
2.4
DKKL1基因过表达诱导细胞凋亡
采用吖啶橙/溴化乙锭双染实验分析DKKL1抑制细胞增殖的机制,结果显示:与对照组相比,乳腺癌MDA-MB-231和MCF-7细胞过表达DKKL1后,细胞凋亡率明显升高(图4,t 值分别为18.22和17.46,P<0.001)。
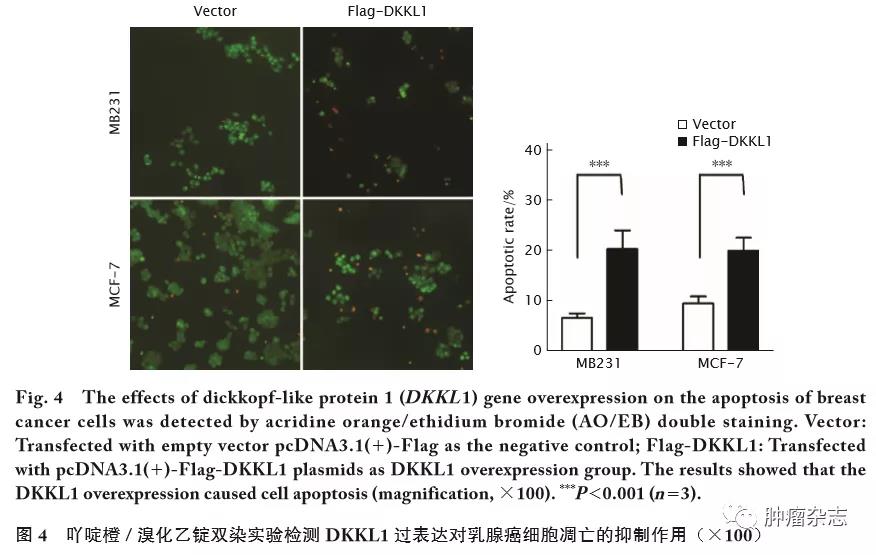
2.5
DKKL1基因过表达抑制乳腺癌细胞迁移
Transwell细胞迁移实验结果显示:与对照组细胞相比,实验组在转染pcDNA3.1(+)-Flag-DKKL1质粒48 h后穿过小室膜的细胞数明显减少(P 均<0.01);实验组和对照组乳腺癌MDA-MB-231、MCF-7细胞穿膜数分别为(378±32)vs(198±41)和(216±22)vs(136±29)个,LSD-t值分别为20.26和15.68,差异均有统计学意义(P<0.001,图5)。
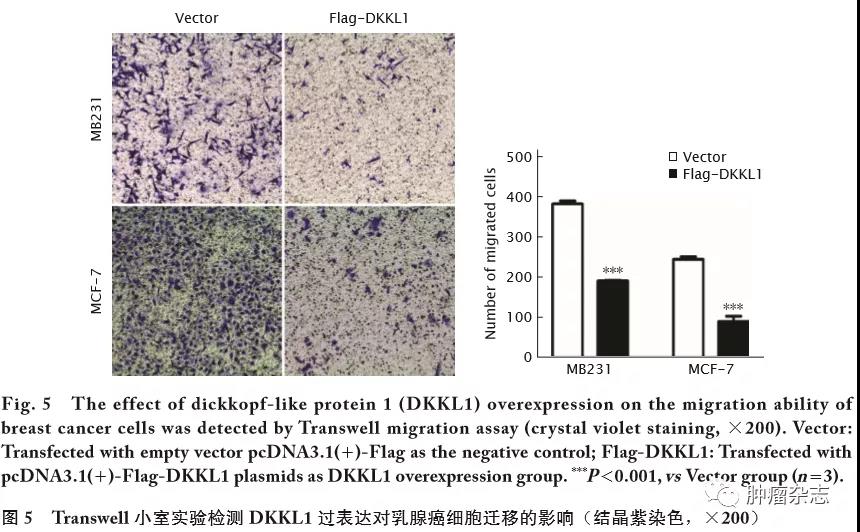
2.6
DKKL1基因过表达抑制干细胞标志物表达及下游信号转导
乳腺癌的发生和发展过程中,上皮-间质转化(epithelial-mesenchymal transformation, EMT)影响与肿瘤转移相关的一系列恶性表型,包括肿瘤干细胞、循环肿瘤细胞、肿瘤血管生成和耐药性等[10-12]。因此本研究进一步探讨DKKL1对EMT及下游干细胞标志物等的影响。蛋白质印迹法和实时荧光定量PCR法(图6)检测发现:过表达DKKL1的乳腺癌细胞MDA-MB-231和MCF-7中,上皮标志物E-cadherin明显上调(t=11.14,P<0.001),而Vimentin、N-cadherin、Snail、BMI-1、KLF4和CD44表达均明显下调(t 值分别为16.36、20.12、10.48、18.64、21.33和15.46,P 值均<0.001)。因此,DKKL1可能通过调控肿瘤细胞的干细胞表型来调控乳腺癌进程。
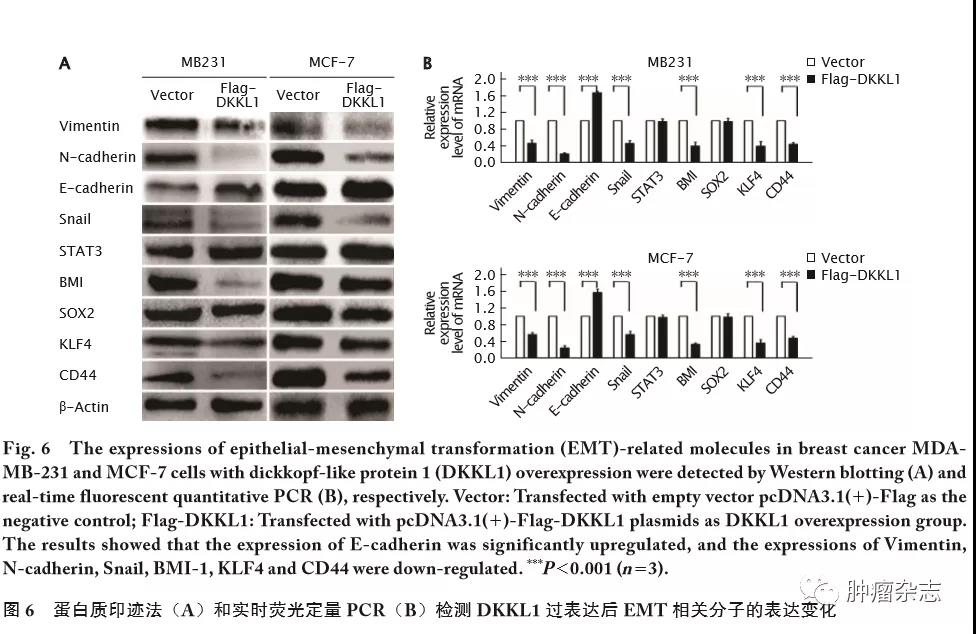
2.7
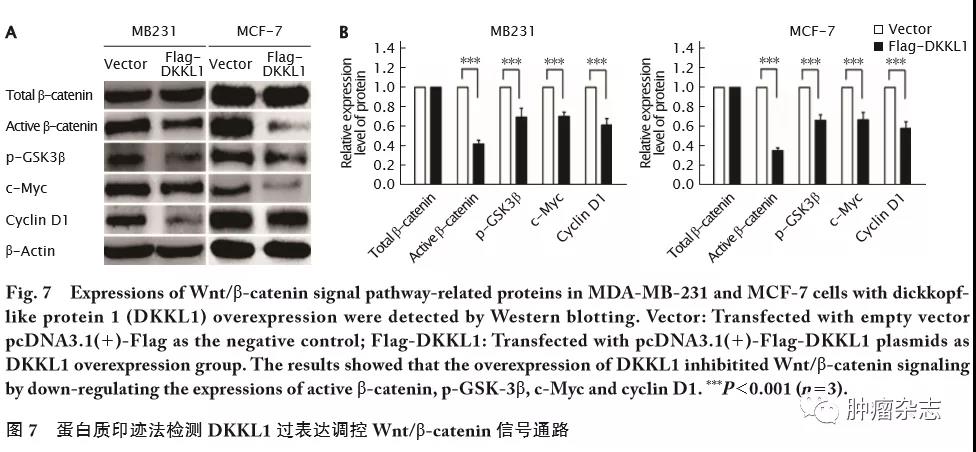
DKKL1基因过表达对Wnt/&β;-catenin信号通路的影响
Wnt/&β;-catenin信号与乳腺癌细胞增殖、细胞周期、凋亡、转移、侵袭和肿瘤干细胞等一系列生物学行为相关[11-12]。本研究进一步检测DKKL1对Wnt/&β;-catenin信号通路的影响,蛋白质印迹结果(图7)显示:过表达DKKL1后,活化的&β;-catenin(t=17.33,P<0.001)和p-GSK-3&β;蛋白(t=16.36,P<0.001)表达下调,同时其下游的c-Myc(t=24.24,P<0.001)和cyclin D1蛋白(t=21.32,P<0.001)表达也明显下调。
3 讨 论
乳腺癌发生和发展是一个复杂的多因素影响的过程,其致病因素包括家族遗传史、月经因素、流产、肥胖和情绪等[13]。研究报道,Wnt信号在乳腺癌的发生和发展中起重要作用。多种Wnt信号通路调控因子如WIF1[14]、SFRP1[15]、SFRP2[16]和DKK2[17]等参与乳腺癌的发生和发展。DKKL1蛋白属于DKKs家族,是Wnt信号转导蛋白的分泌拮抗剂。DKKL1 mRNA在小鼠胚胎和发育中的神经组织中首先被发现。文献报道,DKKL1通过其C末端区域结构与其他蛋白质相互作用,这赋予DKKL1特定的特征和功能[5-6]。DKKL1最初被认为在先天免疫和适应性免疫中起作用,然而最近的研究表明它们参与了肿瘤发生和其他细胞反应[7]。DKKL1在乳腺癌中的表达、功能和作用机制目前未见报道。
本研究首先分析了DKKL1 mRNA和蛋白的表达,通过RT-PCR、实时荧光定量PCR和蛋白质印迹法检测发现:DKKL1 mRNA及蛋白在乳腺癌细胞系和组织中表达下调(P<0.001)。同时免疫组织化学检测发现,与癌旁正常组织相比,DKKL1蛋白在乳腺癌组织中表达下调;通过临床病理分析发现:乳腺癌中DKKL1蛋白表达与乳腺癌的淋巴结转移、组织学分级和TMN分期均相关,与患者年龄、肿瘤直径、ER、PR、HER-2表达状况均无相关性,提示DKKL1可能作为潜在的抑癌基因参与乳腺癌发生与发展。随后细胞功能实验验证 DKKL1是否作为功能性抑癌基因参与乳腺癌的进程。细胞增殖实验结果提示,乳腺癌 MDA-MB-231细胞和MCF-7细胞中DKKL1过表达后细胞增殖活性明显受到抑制(P<0.001);而软琼脂克隆形成实验发现,乳腺癌MDA-MB-231和MCF-7细胞过表达DKKL1后,细胞克隆团的大小明显受到抑制(P<0.001)。Transwell迁移实验发现,过表达DKKL1 后实验组细胞的迁移能力明显下调(P<0.001)。EMT使细胞具有干细胞特性,包含侵袭性,增加间充质特性,上皮特性丢失,而调节肿瘤转移的两个主要因素是肿瘤细胞侵入和细胞外基质被蛋白水解酶降解[18]。据报道,阻断基质金属蛋白酶的表达和活性可能是导致肿瘤细胞活性降低和肿瘤转移的主要原因[11]。本研究结果表明,DKKL1过表达能调节EMT相关蛋白表达,抑制其下游BMI-1、SOX2和CD44等标志物表达,因此推测DKKL1可能是乳腺癌干细胞的抑制因子,在疾病的发生中发挥重要作用。
Wnt/&β;-catenin信号转导影响一系列肿瘤进程[19]。DKKL1能够通过激活&β;-catenin抑制乳腺癌进展[9];DKKL1还通过转录调控cyclin-CDK复合物,影响细胞周期相关蛋白的表达,从而调控肿瘤进程[9]。由于Wnt/&β;-catenin信号转导在调节肿瘤细胞增殖、迁移和侵袭中起重要作用,本研究进一步分析了DKKL1抑制肿瘤的机制是否与Wnt信号转导有关。结果显示:DKKL1拮抗Wnt/&β;-catenin信号转导,DKKL1过表达显著抑制活性&β;-catenin的表达,而不影响总&β;-catenin表达。进一步研究DKKL1拮抗Wnt/&β;-catenin信号的分子机制,发现DKKL1过表达后,Wnt/&β;-catenin下游靶基因的相关标志蛋白,包括p-GSK3&β;、c-Myc和cyclin D1蛋白表达也显著下调。Cyclin D1蛋白作为细胞周期中的关键调控因子,能与cyclin-CDK复合物中的碱基对相结合,从而抑制CNK激酶的细胞活性,阻滞细胞于G0/G1期[14];同时促进DNA损伤的细胞修复,维持基因组的稳定性,防止细胞恶性转化。有研究报道[12-13],EMT相关标志物在多种肿瘤中异常表达,如皮肤癌、肺癌、乳腺癌、肝癌和胰腺癌等;EMT表达与癌细胞去分化和侵袭行为有关,通常提示患者预后不良[14-15]。
综上所述,本研究发现DKKL1在人乳腺癌中表达下调,其可能作为功能性抑癌基因参与乳腺癌进展;DKKL1可能是乳腺癌恶性演进过程中的重要因子,有望成为监测与预警乳腺癌侵袭、转移及预后的重要靶点。
更多《肿瘤》杂志文章,请访问以下网址:
https://navi.cnki.net/knavi/JournalDetail?pcode=CJFD&pykm=ZZLL
参考文献
[1]Gray JM, Rasanayagam s, Engel c, et al. State of the evidence 2017: An update on the connection between breast cancer and the environment[J]. Environ Health, 2017, 16(1):94.
[2]PICON-RUIZ M, MORATA-TARIFA C, VALLE-GOFFIN JJ, et al. Obesity and adverse breast cancer risk and outcome: Mechanistic insights and strategies for intervention[J]. CA Cancer J Clin, 2017, 67(5):378-397.
[3]JIN L, HAN B, SIEGEL E, et al. Breast cancer lung metastasis: Molecular biology and therapeutic implications[J]. Cancer Biol Ther, 2018, 19(10):858-868.
[4]HELM JS, RUDEL RA. Adverse outcome pathways for ionizing radiation and breast cancer involve direct and indirect DNA damage, oxidative stress, inflammation, genomic instability, and interaction with hormonal regulation of the breast[J]. Arch Toxicol, 2020, 94(5):1511-1549.
[5]YAN QX, MA Y, CHEN RQ, et al. Expression of DKKL1 in spermatozoa of men with asthenospermia[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2018, 38(3):324-328.
[6]LU K, LI YX, SHI TS, et al. Changes in expression of Wnt signaling pathway inhibitors dickkopf-1 and sclerostin before and after total joint arthroplasty[J]. Medicine(Baltimore), 2017, 96(39):e8082.
[7]MARTIN G, SELCUKLU SD, SCHOUEST K, et al. Allele-specific splicing effects on DKKL1 and ZNF419 transcripts in HeLa cells[J]. Gene, 2017, 598(2):107-112.
[8]SIBBE M, JAROWYJ J. Region-specific expression of Dickkopf-like1 in the adult brain. Abbreviated title: Dkkl1in the adult brain[J]. Neurosci Lett, 2013, 535(5):84-89.
[9]KOHN MJ, SZTEIN J, YAGI R, et al. The acrosomal protein Dickkopf-like 1(DKKL1) facilitates sperm penetration of the zona pellucida[J]. Fertil Steril, 2010, 93(5):1533-1537.
[10]XIE HT, CHEN SY, LI GG, et al. Limbal epithelial stem/progenitor cells attract stromal niche cells by SDF-1/CXCR4 signaling to prevent differentiation[J]. Stem Cells, 2011, 29(11):1874-1885.
[11]BAUWENS CL, PEERANI R, NIEBRUEGGE S, et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories[J]. Stem Cells, 2008, 26(9):2300-2310.
[12]LEE HJ, KIM JM, KIM KH, et al. Genotoxic stress/p53-induced DNAJB9 inhibits the pro-apoptotic function of p53[J]. Cell Death Differ, 2015, 22(1):86-95.
[13]NIE ZL, WANG YS, MEI YP, et al. Prognostic significance of long noncoding RNA Z38 as a candidate biomarker in breast cancer[J]. J Clin Lab Anal, 2018, 32(1):116-122.
[14]TRIFA F, KARRAY-CHOUAYEKH S, JMAL E, et al. Loss of WIF-1 and Wnt5a expression is related to aggressiveness of sporadic breast cancer in Tunisian patients[J]. Tumour Biol, 2013, 34(3):1625-1633.
[15]SCHAFER SA, HULSEWING C, BARTH P, et al. Correlation between SFRP1 expression and clinicopathological parameters in patients with triple-negative breast cancer[J]. Future Oncol, 2019, 15(16):1921-1938.
[16]HUANG C, YE Z, WAN J, et al. Secreted frizzled-related protein 2 is associated with disease progression and poor prognosis in breast cancer[J]. Dis Markers, 2019, 2019(2):6149381.
[17]SHAO YC, NIE XC, SONG GQ, et al. Prognostic value of DKK2 from the Dickkopf family in human breast cancer[J]. Int J Oncol, 2018, 53(6):2555-2565.
[18]SONG B, LIN HX, DONG LL, et al. MicroRNA-338 inhibits proliferation, migration, and invasion of gastric cancer cells by the Wnt/&β;-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(5):1290-1296.
[19]SEEBIO A, KAHN M, LENZ HJ. The potential of targeting Wnt/&β;-catenin in colon cancer[J]. Expert Opin Ther Targets, 2014, 18(6):611-615.