芥子碱硫氰酸盐抑制胶质瘤T98细胞的增殖、迁移与侵袭并促进其凋亡
芥子碱硫氰酸盐抑制胶质瘤T98细胞的增殖、迁移与侵袭并促进其凋亡
谢 明1,曾智锐2, 3,陈 鹏4,周 璐1,朱俊德1
Sinapine thiocyanate inhibits the proliferation, migration and invasion of giloma T98 cells and promotes its apoptosis
XIE Ming1, ZENG Zhirui2, 3, CHEN Peng4, ZHOU Lu1, ZHU Junde1
作者单位
1. 贵州医科大学基础医学院人体解剖学教研室,贵州 贵安 550025;2. 贵州医科大学基础医学院生理学教研室,贵州 贵安 550025;3. 贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州 贵安 550025;4. 贵州医科大学临床医学院,贵州 贵阳 550004
基金项目
国家自然科学基金资助项目(编号:81660243)
AUTHORS FROM
1. Department of Human Anatomy, School of Basic Medical Sciences, Guizhou Medical University, Guian 550025, Guizhou Province, China; 2. Department of Physiology, School of Basic Medical Sciences, Guizhou Medical University, Guian 550025, Guizhou Province, China; 3. Key Laboratory of Pathogenesis and Drug Research of Common Chronic Diseases in Guizhou Province, Guian 550025, Guizhou Province, China; 4. College of Clinical Medicine, Guizhou Medical University, Guizhou 550004, Guizhou Province, China
GRANT
National Natural Science Foundation of China(No. 81660243)
[摘要]
目的:探讨芥子碱硫氰酸盐(sinapine thiocya-nate,ST)对人胶质瘤T98细胞增殖、凋亡、迁移与侵袭,以及Wnt/&β;-连环蛋白(&β;-catenin)信号通路的影响。
方法:以不同浓度(0、50、100和200 μmol/L )的ST处理人胶质瘤T98细胞,分别采用CCK-8法和FCM法检测不同浓度的ST对T98细胞增殖率和凋亡率的影响。划痕愈合实验和Transwell小室法分别检测T98细胞的迁移和侵袭能力。计算机分子对接法分析ST与Wnt/&β;-catenin信号通路关键蛋白&β;-catenin的结合情况。最后采用蛋白质印迹法检测不同浓度ST处理后T98细胞中&β;-catenin蛋白的表达水平、凋亡相关蛋白Bcl-2与Bax的表达水平,以及基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)和MMP-9的表达水平。
结果:不同浓度的ST能抑制T98细胞的增殖,并诱导细胞凋亡(P 值均<0.05);ST还能明显抑制胶质瘤T98细胞的迁移和侵袭(P 值均<0.05)。ST能与&β;-catenin的活性口袋稳定结合。ST可明显抑制T98细胞中&β;-catenin、Bcl-2、MMP-2和MMP-9蛋白的表达水平,而上调Bax蛋白的表达水平(P 值均<0.05)。
结论:ST可能通过结合Wnt/&β;-catenin信号通路关键分子&β;-catenin,抑制胶质瘤T98细胞的增殖、迁移和侵袭。
[关键词]神经胶质瘤;芥子碱硫氢酸盐;细胞凋亡;细胞运动;Wnt/&β;-catenin信号通路
[ABSTRACT]
Objective: To investigate the effects of sinapine thiocyanate(ST) on the proliferation, migration and invasion of human glioma T98 cells, and on the Wnt/&β;-catenin signaling pathway.
Methods: Human glioma T98 cells were treated with ST at different concentrations(0, 50, 100 and 200 μmol/L), and then the relative cell proliferation rate was detected by CCK-8 method. The cell apoptotic rate was detected by flow cytometry. The cell migration and invasion abilities were detected by wound healing assay and Transwell chamber method. Computer molecular docking method was used to analyze the binding between ST and &β;-catenin, a key protein of Wnt/&β;-catenin signaling pathway. Finally, the expressions of key protein &β;-catenin in Wnt/&β;-catenin signaling pathway, apoptosis-related BCL-2 and Bax proteins, as well as the matrix metalloproteinase(MMP)-2 and MMP-9 reflecting cytotoxicity in glioma T98 cells treated with different concentrations of ST were detected by Western blotting.
Results: ST significantly inhibited the proliferation of glioma T98 cells and induced their apoptosis(both P < 0.05). ST significantly inhibited the migration and invasion of glioma T98 cells(both P < 0.05). ST stably binded to the active pocket of &β;-catenin. ST significantly reduced the expressions of &β;-catenin, Bcl-2, MMP-2 and MMP-9 proteins in T98 cells, while increased the expression of Bax protein(allP < 0.05).
Conclusion: ST may inhibit the proliferation, migration and invasion of glioma T98 cells by combining &β;-catenin, a key molecule in Wnt/&β;-catenin signaling pathway.
[Key words]Glioma; Sinapine thiocyanate; Apoptosis; Cell movement; Wnt/&β;-catenin signaling pathway
神经胶质瘤(简称胶质瘤)也称为胶质细胞瘤,是最常见的原发性颅内肿瘤,其以侵袭性强、增殖速度快和术后易复发为显著特点[1]。胶质瘤约占颅内肿瘤的50%~60%,即使经过手术、放疗和化疗等综合治疗后,患者的平均生存时间也只有18个月左右[2]。目前使用的放化疗药物对机体正常组织造成伤害的同时,易产生耐药性[3]。因此,寻找新的药物治疗胶质瘤具有重要的临床价值。
近年来研究表明,Wnt信号通路参与胶质瘤细胞的增殖、迁移和侵袭等过程[4]。Wnt信号通路以Wnt/&β;-连环蛋白(&β;-catenin)信号通路为主。Chen等[5]发现,Wnt/&β;-catenin信号通路中的关键分子&β;-catenin可以增加泛素化特异性肽酶1的转录,进而促进胶质瘤U87MG和LN18细胞的增殖和转移。&β;-catenin在高级别胶质瘤中的表达水平高于低级别胶质瘤和正常脑,同时用siRNA沉默&β;-catenin表达后可导致细胞凋亡、细胞周期被阻滞在G0/G1期,以及细胞周期蛋白表达水平下调 [6]。有研究显示,微RNA(microRNA,miRNA,miR)miR-188过表达抑制了胶质瘤细胞中&β;-catenin mRNA的表达[7]。因此,抑制胶质瘤细胞中Wnt/&β;-catenin信号通路关键分子&β;-catenin的表达或功能可能是治疗胶质瘤的一种重要策略。
芥子碱硫氰酸盐(sinapine thiocyanate,ST)分子式是C17H24N2O5S,为十字花科物种的生物碱,具有抗氧化剂和放射性保护等活性。据报道,ST能降低胆固醇和低密度脂蛋白,显著改善高血压症状,防止血栓形成,同时对血管内皮细胞炎性损伤引起的血栓形成具有保护作用[8]。另研究发现,在体外穴位贴敷ST后对皮肤作用部位有显著降低炎性反应过程中凝血因子表达,抑制血管内皮促凝状态的疗效[9]。ST可能在肿瘤中通过抑制G蛋白偶联受体(G protein-coupled receptor,GPR)-磷脂酶C(phospho-lipase C,PLC)-二酰甘油(diacylglycerol,DG)-PKC信号通路的激活,降低炎性反应过程中凝血因子表达,从而抑制血管内皮促凝状态。ST是活性化合物,能通过皮肤显著增强白细胞介素-1和肿瘤坏死因子的释放[10]。然而,ST对胶质细胞瘤的作用及机制尚未见报道。因此,本实验旨在探讨ST对胶质瘤细胞增殖、迁移、侵袭及Wnt/&β;-catenin信号通路的影响,以期为ST应用于胶质瘤患者的临床治疗提供实验依据。
1 材料与方法
1.1
细胞、试剂和仪器
人脑神经胶质瘤细胞株T98由南方医科大学神经外科实验室馈赠。ST购自美国MedChemExpress(MCE)公司。胎牛血清(fetal bovine serum,FBS)、DMEM高糖培养液、1%青霉素-链霉素和不含EDTA的0.05%胰蛋白酶均购自美国Gibco公司,CCK-8试剂购自武汉博士德生物工程有限公司。AnnexinⅤ-FITC/碘化丙啶(propidium iodide,PI)凋亡检测试剂框购自大连美伦生物技术公司。Transwell小室(孔径0.8 μm)购自美国JET公司,基质胶(Matrigel)购自美国BD公司。多聚甲醛和结晶紫购自武汉赛维尔生物科技有限公司,蛋白酶抑制剂PMSF、蛋白裂解液RIPA、BCA蛋白定量试剂框、SDS-PAGE制胶试剂框、5×loading buffer和电化学发光剂购自北京索莱宝科技有限公司。PVDF膜购自美国GE公司。兔抗人&β;-catenin多克隆抗体购自美国Cell Signaling Technology公司,鼠抗人基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)和MMP-9单克隆抗体及兔抗人Bcl-2和Bax多克隆抗体均购自武汉三鹰生物技术有限公司。
蛋白成像系统和5.2.1型多功能酶标仪为美国Bio-Rad公司产品,Novocyte型流式细胞仪为艾森生物有限公司产品,BX53型倒置光学显微镜为日本Olympus公司产品。
1.2
细胞培养
人胶质瘤细胞株T98用含10%FBS和1%青霉素-链霉素的高糖DMEM培养液,置于37 ℃、CO2体积分数为5%的培养箱中培养,隔天换液。待细胞生长至融合度为80%~90%时,用0.25%胰蛋白酶溶液消化后传代,取对数生长期的状态良好细胞进行后续实验。
1.3
CCK-8法检测
将人胶质瘤细胞株T98接种于96孔板中,每孔3×103个细胞,每组设置6个复孔,分别用浓度为50、100和200 μmol/L的ST处理细胞48 h;对照组用含有0.5% DMSO的DMEM培养液处理。药物处理后,将CCK-8液与细胞培养液(体积比1∶9)加入每个孔中,放置培养箱中培养2 h。在多功能酶标仪的450 nm波长下读取各孔D值。计算各组细胞的相对增殖率,相对增殖率(%)=[1-(各药物组D值-调零孔D值)/(对照组D值-调零孔D值)]×100%。药物对胶质瘤T98细胞的半数抑制浓度(half-maximal inhibitory concentraton,IC50)是在GraphPad软件中根据各组浓度对应的增殖抑制率构建非线性回归函数公式推导得出。
1.4
流式细胞术检测
取对数生长期的T98细胞,用胰蛋白酶消化后,按照5×104个/孔的密度,接种于6孔板中。以等体积DMSO、不同浓度(50、100和200 μmol/L)的ST处理48 h后,弃培养液,用1×PBS洗2次,每孔加入1 mL不含EDTA的0.05%胰蛋白酶溶液消化,直接加入含10% FBS的培养液终止消化后,收集细胞到EP管。常规低速离心后,弃上清液,加入冷PBS。15 000 r/min(半径为15 cm)离心5 min,洗涤细胞2次;每管加入1 mL的1×Binding Buffer,轻轻重悬细胞,实验组每管各加5 μL Aunexin Ⅴ-FITC和5 μL PI,室温避光15 min,再加400 μL的1×Binding Buffer,上流式细胞仪检测各组药物的细胞凋亡率。其中,Q1象限为机械所致的死亡细胞百分率,Q2象限为早期凋亡细胞百分率,Q3象限为早期凋亡细胞百分率,Q4象限为存活的细胞百分率。本研究统计凋亡率为Q2+Q3。
1.5
划痕愈合实验检测
将人胶质瘤细胞株T98按每孔2×105个/孔的密度接种于6孔板中。细胞生长到融合度为85%~90%时,换为无血清培养液,置于37 ℃、CO2体积分数为5%培养箱中继续培养24 h。用移液器的枪头在6孔板上每隔0.5~1 cm划一条直线,PBS冲洗3次,观察及拍照0 h划痕情况。再加入含不同浓度(50、100和200 μmol/L)ST的无血清DMEM培养液,以只加入含0.5% DMSO的无血清DMEM培养液为对照组。24 h后随机选取5个视野进行拍照,用Image J软件测划痕面积,计算相对迁移率(%)=各药物组24 h划痕愈合面积/对照组24 h划痕愈合面积×100%,计算每组细胞的相对迁移率。
1.5
Transwell小室法检测细胞的侵袭能力
Matrigel与细胞培养液按体积比1∶8混匀后,加入Transwell小室中,置于37 ℃培养箱中1 h后除去培养液。将人胶质瘤细胞株T98用无血清培养液重悬后,取200 μL细胞悬液,加入到Transwell上室中,再分别加入0.5% DMSO(对照组)和不同浓度(50、100和200 μmol/L)的ST处理细胞。再用移液枪取700 μL含10% FBS的DMEM培养液加入到Transwell下室中,置于37 ℃、CO2体积分数为5%的培养箱中培养24 h后,除去培养液。用4%多聚甲醛溶液固定细胞,结晶紫染色15 min。每孔随机选5个视野(放大倍数为100),在倒置光学显微镜下采集图像,计数每张图片的侵袭细胞数。
1.6
计算机分子对接分析
计算机分子对接在Sybyl软件(版本号1.3)中进行模拟。从PubChem Compound Search database在线数据库(https://www. ncbi.nlm.nih.gov/pccompound)中下载的ST三级结构(ID编号91973791)和从Protein Data Bank( https://www.rcsb.org/)下载的&β;-catenin晶体结构(ID编号3SL9)同时导入到Sybyl软件中。蛋白的功能及结构稳定性由其活性口袋调控。因此,在对&β;-catenin晶体结构进行去除原配体、修复黏性末端和加氢操作后,应用自动模式分析&β;-catenin蛋白的活性口袋。以柔性对接模式对接ST和&β;-catenin蛋白的活性口袋,得出结合评分(范围为0~5)。其中,结合评分为4和5,则认为稳定结合。
1.7
蛋白质印迹法检测
人胶质瘤T98细胞用不同浓度(0、50、100、200 μmol/L)的ST处理后,用含1% PMSF的RIPA裂解液放在冰上裂解,将蛋白用移液枪收集到离心管中,12 000 r/min(半径为15 cm)离心15 min。用移液枪吸取蛋白上清液放在1.5 mL EP管中,用BCA蛋白浓度测定试剂框测定各组蛋白浓度。根据SDS-PAGE凝胶制备试剂框说明书,制12% SDS-PAGE胶。每孔加入30 μg蛋白。先以80 V 40 min分离蛋白Marker后,再改用120 V 80 min电泳至蛋白分离到底。切取所需要的PVDF膜大小,先浸泡于甲醇15 s,然后放在ddH2O中浸泡1~5 min,转膜条件为300 MA 120 min。用封闭液在常温下摇床机上慢摇封闭2 h,TBST洗涤3次(5 min/次),加入稀释比例为1∶1 000的&β;-catenin、MMP2、MMP9、Bcl-2和Bax抗体,摇床上慢摇4 ℃过夜。TBST洗涤3次(10 min/次),加入稀释比例为1∶2 000的辣根过氧化物酶标记的山羊兔或鼠IgG,室温摇床上慢摇孵育2 h。最后用ECL曝光液在Bio-Rad成像仪中曝光后,测定各蛋白条带的灰度值。实验重复3次。
1.8
统计学方法
采用SPSS 21.0软件进行统计分析。各组实验均孤立重复 3次,结果数据以 ¡À s表示;多组间比较采用单因素方差分析后,组内两两比较用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1
ST抑制胶质瘤细胞增殖
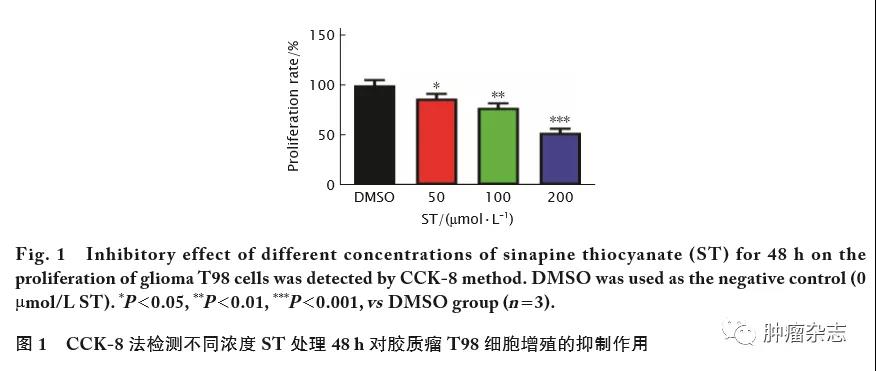
CCK-8法检测结果(图1)显示,0、50、100和200 μmol/L的ST作用48 h后,各组胶质瘤T98细胞的相对增殖率分别为(100.00±2.93)%、(86.54±2.77)%、(77.28±2.61)%和(47.77±3.78)%;48 h时0~200 μmol/L相邻浓度组之间相比的t值分别为 3.33、5.79和12.64,P 值均<0.01。结果提示,ST对人胶质瘤T98细胞增殖具有明显的抑制作用。此外,在GraphPad 8.0.2软件中根据各组浓度对应的增殖抑制率构建非线性回归函数公式,可以推导出:ST对胶质瘤T98细胞的IC50为190.4 μmol/L。
2.2
ST促进胶质瘤细胞凋亡
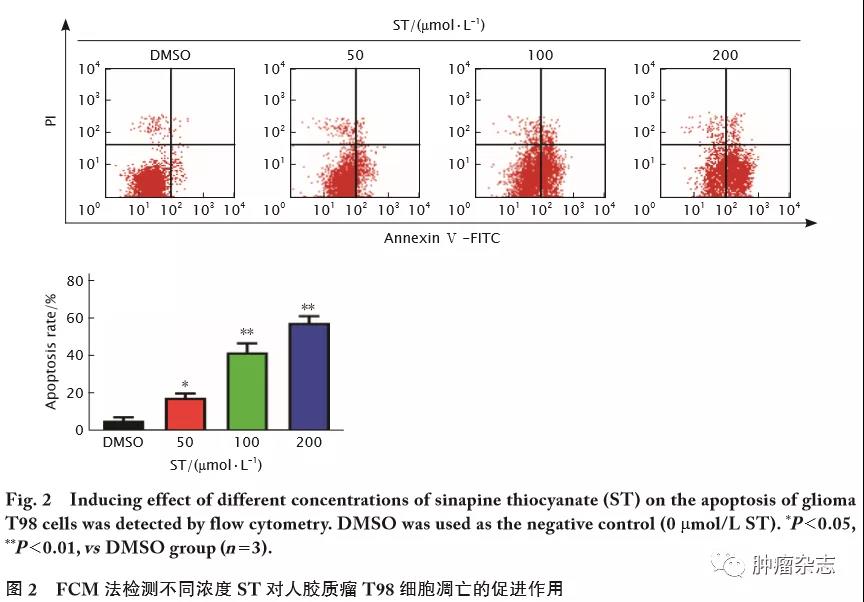
流式细胞术检测结果(图2)显示,0、50、100、200 μmol/L的ST作用48 h后,胶质瘤T98细胞的凋亡率分别为(5.20±1.31)%、(17.47±1.63)%、(41.77±3.44)%和(57.55±2.55)%;与0 μmol/L ST即DMSO对照组相比,各浓度ST组凋亡率明显增加,差异均有统计学意义(F=98.11,t 值分别为5.87、9.95和18.26,P 值分别为0.028、0.010和0.003 )。结果提示,ST能够促进人胶质瘤T98细胞凋亡。
2.3
ST抑制胶质瘤细胞迁移
划痕愈合实验结果(图3)显示,0、50、100、200 μmol/L的ST处理后,T98细胞的相对迁移率分别为(95.00±1.000)%、(77.00±3.00)%、(47.50±2.50)%、(28.50±1.50)%;与0 μmol/L ST即DMSO对照组相比,各浓度ST作用组的T98细胞相对迁移率均明显降低,差异有统计学意义(F=190.70,t 值分别为 5.69、17.64和36.89,P 值均<0.05)。

2.4
ST抑制胶质瘤细胞侵袭
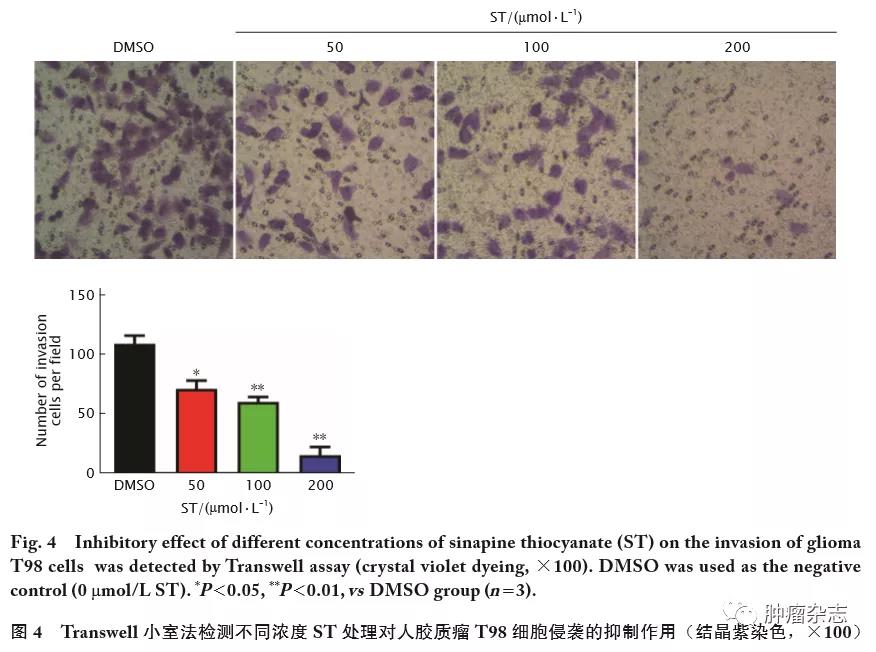
Transwell小室法检测结果(图4)显示,DMSO对照组每视野下侵袭细胞数为(109±5)个,而50、100和200 μmol/L的ST处理组每视野下侵袭细胞数分别为(71±5)个、(60±3)个和(15±5)个;与DMSO对照组相比,各浓度ST处理后胶质瘤T98细胞的侵袭细胞数均明显减少,差异具有统计学意义(F=71.28,t 值分别为 5.37、8.40和13.29,P 值均<0.05)。
2.5
ST能够与&β;-catenin蛋白稳定结合
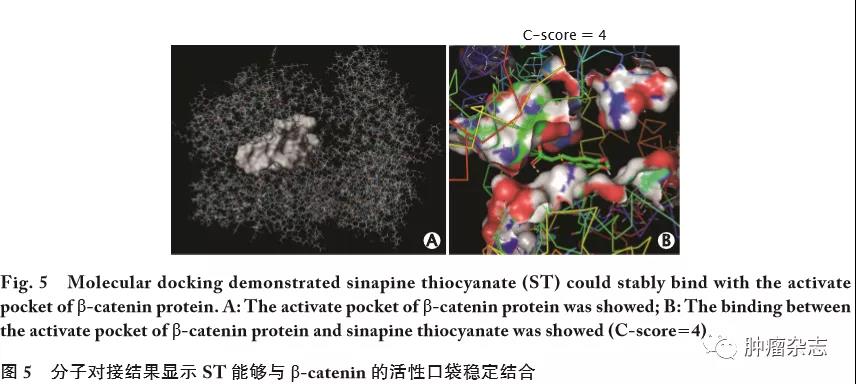
应用Sybyl软件模拟ST与&β;-catenin蛋白的对接,结果显示ST能够与&β;-catenin蛋白的活性口袋稳定结合,其结合评分为4(图5)。结果提示,ST对胶质瘤T98细胞的作用可能是通过影响Wnt/&β;-catenin信号通路关键分子&β;-catenin所介导的。
2.6
ST可能抑制Wnt/&β;-catenin信号通路
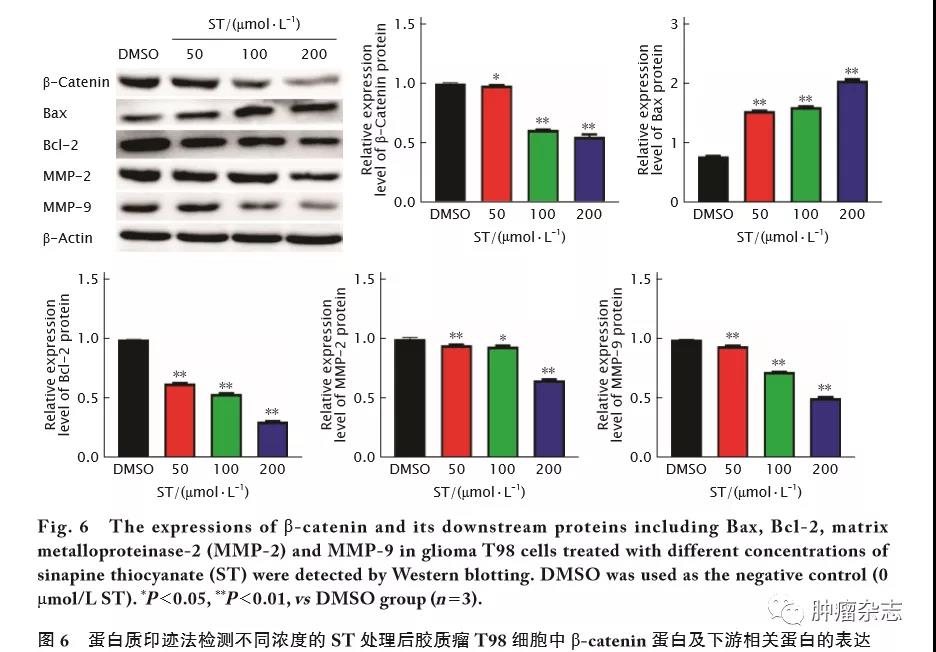
蛋白质印迹法检测结果(图6)显示,与DMSO对照组相比,不同浓度(50、100和200 μmol/L)的ST处理胶质瘤T98细胞后,&β;-catenin蛋白的相对表达量均明显减少(F=1352,t 值分别为2.65、69.06和34.72,P 值均<0.01),Bax蛋白的相对表达量明显增加(F=4187,t值分别为169.70、107.00和93.17,P 值均<0.01);Bcl-2蛋白的相对表达量明显减少(F=33407,t 值分别为201.90、231.80和390.10,P值均<0.01);MMP-2和MMP-9蛋白的相对表达量均明显减少(FMMP-2=169.20,t 值分别为6.16、5.60和39.14,P 值均<0.01;FMMP-9=4286,t 值分别为23.83、159.30和101.40,P 值均<0.01)。以上结果提示,ST可能通过抑制Wnt/&β;-catenin信号通路关键蛋白&β;-catenin、凋亡相关蛋白Bcl-2与Bax,以及细胞毒性相关蛋白MMP-2和MMP-9的表达,抑制人胶质瘤T98细胞的增殖、迁移和侵袭。
3 讨 论
人胶质瘤具有侵袭性强和复发率高的特点[11-12]。经过手术切除后行化疗等标准治疗后,胶质瘤患者的生存期依旧很低[13]。目前,化疗和放疗对胶质瘤的治疗效果较差,且具有明显的毒副作用。因此,急需寻找新的药物以提高胶质瘤疗效及预后。
近些年来,传统中成药物在治疗人胶质瘤方面中显示非常重要的价值。根据文献报道,陈俊等[14]发现,鞣云实素能有效抑制人胶质瘤细胞的增殖活性和迁移能力;楚丽丽等[15]发现,人参皂苷Rd能诱导胶质瘤细胞凋亡。本实验结果显示,ST能够显著抑制人胶质瘤T98细胞的增殖,并诱导细胞凋亡;ST还能够显著抑制人胶质瘤T98细胞的迁移和侵袭,提示ST可能是一种具有抗胶质瘤作用的小分子药物。
在胶质瘤细胞的增殖、迁移和侵袭过程中,&β;-catenin扮演着重要角色,其受多种上游调控信号活化后,转位入细胞核,转录调控多种促癌基因表达[16]。其中,葡萄糖调节蛋白(glucose-regulated protein 94,GRP94)在胶质瘤中高表达,其能促进&β;-catenin从细胞质转移到细胞核,提高&β;-catenin的转录活性,最后诱导肿瘤细胞侵袭。&β;-catenin调控的某些下游成员及微RNA能够通过作用于MMP家族促进胶质瘤细胞侵袭[17]。目前,多种具有&β;-catenin抑制活性的药物展示了良好的抗胶质瘤作用。本研究通过计算机分子对接技术发现,ST能够与&β;-catenin蛋白的活性口袋稳定结合,提示ST可能是通过影响&β;-cantenin及其下游信号蛋白发挥其抑制增殖和转移的作用。进一步用蛋白质印迹法检测证明,ST处理后&β;-catein蛋白表达量明显减少,其调控的下游蛋白Bax的表达量明显增加,Bcl-2、MMP-2和MMP-9的表达量明显减少。
综上所述,本研究发现ST可以通过下调Wnt/&β;-catenin信号通路关键蛋白&β;-catenin的表达水平,抑制胶质瘤细胞增殖、迁移和侵袭,促进细胞凋亡,提示ST在胶质瘤临床治疗中可能有良好的应用前景。
更多《肿瘤》杂志文章,请访问以下网址:
https://navi.cnki.net/knavi/JournalDetail?pcode=CJFD&pykm=ZZLL
参考文献
[1]LOUIS DN, PERRY A, REIFENBERGER G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathol, 2016, 131(6):803-820.
[2]αNDERY E. Glioblastoma treatments: an account of recent industrial developments[J]. Front Pharmacol, 2018, 9:879.
[3]SZE CI, CHIANG MF, SU WP, et al. Assessing current therapeutic approaches to decode potential resistance mechanisms in glioblastomas[J]. Front Oncol, 2013, 3:59.
[4]KAHLERT UD, MACIACZYK D, DOOSTKAM S, et al. Activation of canonical WNT/&β;-catenin signaling enhances in vitro motility of glioblastoma cells by activation of ZEB1 and other activators of epithelial-to-mesenchymal transition[J]. Cancer Lett, 2012, 325(1):42-53.
[5]Chen H, Lu Q, Chen C, et al. &β;‑catenin regulates effects of miR‑24 on the viability and autophagy of glioma cells[J]. Exp Ther Med, 2019, 18(2):1285-1290.
[6]Liu X, Wang L, Zhao S, et al. &β;-Catenin overexpression in malignant glioma and its role in proliferation and apoptosis in glioblastma cells[J]. Med Oncol, 2011, 28(2):608-614.
[7]Li N, Shi H, Zhang L, et al. miR-188 inhibits glioma cell proliferation and cell cycle progression through targeting &β;-catenin[J]. Oncol Res, 2018, 26(5):785-794.
[8]Li Y, Zhang X, Yang W, et al. Mechanism of the protective effects of the combined treatment with rhynchophylla total alkaloids and sinapine thiocyanate against a prothrombotic state caused by vascular endothelial cell inflammatory damage[J]. Exp Ther Med, 2017, 13(6):3081-3088.
[9]Chen S, Jin YT, Zhu ZY, et al. In vivo study on site of action of sinapine thiocyanate following acupoint herbal patching[J]. Evid Based Complement Alternat Med, 2018, 2018:9502902.
[10]Guo X, Lu H, Lin Y, et al. Skin penetration of topically applied white mustard extract and its effects on epidermal Langerhans cells and cytokines[J]. Int J Pharm, 2013, 457(1):136-142.
[11]LIU P, YU J, TIAN X, et al. The effect of downregulation of Stathmin gene on biological behaviors of U373 and U87-MG glioblastoma cells[J]. Biol Res, 2018, 51(1):16.
[12]SEYSTAHL K, WICK W, WELLER M. Therapeutic options in recurrent glioblastoma—An update[J]. Crit Rev Oncol Hematol, 2016, 99:389-408.
[13]刘永吉, 魏明华, 张永斌, 等. 胶质母细胞瘤的治疗现状[J]. 中国保健营养, 2017, 27(17):178-179.
[14]陈 俊, 周佳彬, 李根华, 等. 柯里拉京对神经胶质瘤U373MG细胞增殖和迁移能力的影响[J]. 济宁医学院学报, 2019, 42(3):158-161.
[15]楚丽丽, 宛 蕾. 人参皂苷Rd对U251神经胶质瘤细胞凋亡的影响[J]. 贵州医科大学学报, 2020, 45(2):179-183.
[16]FANG L, ZHU Q, NEUENSCHWANDER M, et al. A small-molecule antagonist of the &β;-catenin/TCF4 interaction blocks the self-renewal of cancer stem cells and suppresses tumorigenesis[J]. Cancer Res, 2016, 76(4):891-901.
[17]刘 静, 王小刚, 郭 庚, 等. Wnt/&β;-catenin信号转导通路影响神经胶质瘤侵袭的机制[J]. 国际肿瘤学杂志, 2017, 44(2):139-141.