卵巢癌免疫治疗 假新闻还是真交易?
【摘要】肿瘤免疫疗法已经成为肿瘤学中最有希望的方法之一,肿瘤的免疫疗法包括激活免疫系统以诱导肿瘤免疫监视或逆转肿瘤免疫逃逸。近年来,卵巢癌的治疗策略发生了变化。早在30年前,第一批临床研究就聚焦于调节肿瘤细胞因子网络,特别关注干扰素介导的免疫反应。随着在卵巢癌和其他恶性肿瘤中表达的特异性肿瘤抗原如NY-ESO-1的探索,开发了治疗性癌症疫苗,开启了个体化抗癌药物时代。几乎在同一时间,转基因自体肿瘤反应性T细胞的过继转移出现,但卵巢癌的应答率令人失望。今天,在这方面可能最有希望的治疗方法是阻断免疫检查点,例如程序性细胞死亡蛋白1(PD-1)及其配体之一(PD-L1)或细胞毒性T淋巴细胞相关抗原4(CTLA-4),其在恶性黑素瘤和非小细胞肺癌中的应答率令人印象深刻。尽管针对卵巢癌肿瘤免疫监测的治疗方法越来越多,但由于缺乏可预测的生物标志物,选择从这些治疗模式中获益的患者群体在临床上仍具有挑战性。在这里,我们总结了卵巢癌的不同免疫治疗方法,并讨论了为什么卵巢癌的免疫治疗仍处于起步阶段。
前言
自十九世纪以来,免疫疗法领域已经从理论发展到科学研究,再到临床试验,再到最前沿的癌症治疗,成为最有希望的癌症治疗方式。检查点抑制剂的免疫疗法可将肺癌患者的生命延长数月,而且能够阻止晚期黑色素瘤的进展。特异性靶向由体细胞突变基因编码的蛋白质的自体淋巴细胞的过继转移疗法已经在转移性胆管癌,结肠癌,乳腺癌和宫颈癌患者中有大量的客观临床获益,但在卵巢癌中报道的结果尚未令人信服。然而,早期试验的强烈反对有助于理解免疫疗法的原理并发展出更有前景的概念。在ClinicalTrials.gov上列出了大量研究(表1),显示了对不同方法的巨大兴趣和广泛组合。
卵巢癌的免疫治疗试验
实验
包含
阶段
规模
方案
主要研究终点
检查点抑制剂
Study of Atezolizumab vs Placebo in
Combination With Paclitaxel, Carboplatin,
and Bevacizumab in Participants With NewlyDiagnosed Stage III or Stage IV Ovarian,
Fallopian Tube, or Primary Peritoneal Cancer
First-line OC
Phase III
1300
Arm A: atezolizumab + paclitaxel +
carboplatin + bevacizumab
Arm B: placebo + paclitaxel +
carboplatin + bevacizumab
PFS, OS
A Study of Avelumab Alone or In Combination
With Pegylated Liposomal Doxorubicin vs
Pegylated Liposomal Doxorubicin Alone in
Patients With Platinum Resistant/Refractory
Ovarian Cancer(JAVELIN Ovarian 200)
PROC/
PRROCPhase III
566
Arm A: avelumab alone
Arm B: avelumab plus PLD
Arm C: PLD aloneOS, PFS
Avelumab in Previously Untreated Patients with
Epithelial Ovarian Cancer(JAVELIN OVARIAN
100)First-line OC
Phase III
998
Arm A: chemotherapy followed by
observation
Arm B: chemotherapy followed by
avelumab in maintenance
Arm C: chemotherapy in
combination with avelumab followed
by avelumab in maintenancePFS
ATALANTE: Atezolizumab vs Placebo Phase III
Study in Late Relapse Ovarian Cancer Treated
with Chemotherapy + Bevacizumab(ATALANTE)
PSOC
Phase III
405
Arm A: atezolizumab + avastin +
platinum-based chemotherapy
placebo
Arm B: avastin + platinum-based
chemotherapy
PFS
Pegylated Liposomal Doxorubicin Hydrochloride
With Atezolizumab and/or Bevacizumab in Treating Patients With Recurrent Ovarian, Fallopian Tube, or Primary Peritoneal Cancer
PROC
Phase II/III
488
Arm A: pegylated liposomal
doxorubicin hydrochloride(PLD),
atezolizumab
Arm B: PLD, atezolizumab,
bevacizumab
Arm C: PLD, bevacizumab
ORR, PFS,
CTCAE, DFS,
PRO
Study of Azacitidine and Durvalumab in
Advanced Solid Tumors(METADUR)
PROC Type II
Phase II
60
Azacitidine and durvalumab
ORR
Trial of Durvalumab(MEDI4736) and
Tremelimumab Administered in Combination vs
Sequentially in Recurrent Platinum-Resistant
Epithelial Ovarian Cancer
PROC
Phase II
100
Tremelimumab, durvalumab
irPFS
Phase 1b/2 Study of Avelumab With or Without
Entinostat in Patients With Advanced Epithelial
Ovarian Cancer
PROC
Phase I/II
140
Arm A: entinostat plus avelumab
Arm B: placebo plus avelumab
Adverse
events, PFS
(Umbrella) Trial in Patients With Relapsed
Ovarian Cancer
PSOC/
PROC/
PRROC
Phase II
75
Arm A: MEDI9447(CD73) +
durvalumab
Arm B: MEDI0562(OX40) +
durvalumab
Arm C: MEDI0562(OX40) +
tremelimumab combination
DCR
Phase II: Pembrolizumab/Carboplatin/
Taxol in Epithelial OC
First-line
OC with
measurable/
macroscopic
disease
Phase II
30
Pembrolizumab, carboplatin,
paclitaxel for 6 cycles followed by
12 months pembrolizumab every 21
days
PFS
A Study of Pembrolizumab With Standard
Treatment in Patients With Recurrent PlatinumResistant Ovarian Cancer(PemCiGem)
PROC
Phase II
25
Single group: gemcitabine
and cisplatin combined with
pembrolizumab
ORR
Safety and Efficacy of CRS-207 With
Epacadostat in Platinum Resistant Ovarian,
Fallopian or Peritoneal Cancer(SEASCAPE)
PROC
Phase I/II
126
Single group: CRS-207,
epacadostat, pembrolizumab
Phase 1: DLT,
CTCAE
Phase 2: ORR,
PFS
Immunotherapy With Neoadjuvant
Chemotherapy for OVarian Cancer(INeOV)
NACT
Phase I/II
66
Arm A: durvalumab/chemotherapy
Arm B: durvalumab/tremelimumab/
chemotherapy
Toxicity after
neoadjuvant
treatment
A Phase 1/2 Study of Motolimod(VTX-2337) and
MEDI4736 in Subjects With Recurrent, PlatinumResistant Ovarian Cancer for Whom Pegylated
Liposomal Doxorubicin(PLD) is Indicated
PROC
Phase I/II
53
Single group: toll-like Receptor 8
agonist motolimod(VTX-2337) plus
anti-PD-L1 antibody durvalumab
(MEDI4736)
Phase 1: MTD
Phase 2: PFS
Niraparib in Combination With Pembrolizumab in
Patients With Triple-Negative Breast Cancer or
Ovarian Cancer(TOPACIO)
Recurrent
disease
Phase I/II
121
Single group: niraparib plus
pembrolizumab
Phase 1: DLTs
Phase 2: ORR
PARP-Inhibition and CTLA-4 Blockade in BRCAD eficient Ovarian Cancer
PSOC/
PROC with
germline
BRCA-1
BRCA-2
mutation
Phase I/II
50
Single group: olaparib,
tremelimumab
Phase 1:
recommended
phase II dose
Phase 2: ORR
基于细胞
Administration of Autologous T-Cells Genetically
Engineered to Express T-Cell Receptors Reactive
Against Mutated Neoantigens in People With
Metastatic Cancer
PROC/
PRROC
Phase II
210
Single group: cyclophosphamide,
fludarabine, aldesleukin, individual
patient TCR-transduced PBL
ORR
Phase I/II Study of Metastatic Cancer Using
Lymphodepleting Conditioning Followed by
Infusion of Anti-Mesothelin Gene Engineered
Lymphocytes
PSOC/PROC/
PRROC
expressing
mesothelin
Phase I/II
136
Anti-mesothelin CAR transduced
PBL, fludarabine, aldesleukin,
cycolphosphamide
Frequency and severity
Of treatmentrelated AEs;
ORR
A Phase I/IIa, Open Label Clinical Trial Evaluating
the Safety and Efficacy of Autologous T-Cells
Expressing Enhanced TCRs Specific for NYESO-1 in Patients With Recurrent or Treatment Refractory Ovarian Cancer.
PROC/ PRROC
Phase I/II
10
NY-ESO-1c259 T-cells
Safety and
tolerability
Phase II Study of Metastatic Cancer That
Expresses NY-ESO-1 Using Lymphodepleting
Conditioning Followed by Infusion of AntiNY ESO-1 Murine TCR-Gene Engineered Lymphocytes
PSOC/PROC/
PRROC
expressing ESO
Phase II
43
Anti-NY-ESO-1 mTCR PBL,
fludarabine, aldesleukin,
cycolphosphamide
ORR
Adoptive Transfer of NY-ESO-1 TCR Engineered
Peripheral Blood Mononuclear Cells(PBMC)
After a Nonmyeloablative Conditioning Regimen,
With Administration of NY-ESO-1157–165 Pulsed
Dendritic Cells and Interleukin-2, in Patients With Advanced Malignancies
Advanced
malignancies
Phase II
22
NY-ESO-1 reactive TCR retroviral
vector transduced autologous PBL,
DC vaccine therapy, fludarabine,
aldesleukin, cyclophosphamide
Safety,
feasibility, ORR
Phase 1 Dose Escalation, Multi-Tumor Study
to Assess the Safety, Tolerability and Antitumor
Activity of Genetically Engineered MAGE-A4ᶜ¹°³²T
in HLA-A2+ Subjects With MAGE-A4 Positive
Tumors
MAGE-A4
positive tumors
Phase I
42
Autologous genetically modified
MAGE-A4ᶜ¹°³² T-cells
AEs, DLTs,
evaluation of
persistence
of genetically
modified
T-cells,
measurement
of RCL in
genetically
modified T-cells
Phase I/II Study Administering Peripheral Blood
Lymphocytes Transduced With a CD70-Binding
Chimeric Antigen Receptor to Patients With
CD70 Expressing Cancers
PSOC/PROC/
PRROC
expressing
CD70
Phase I/II
113
Anti-hCD70 CAR PBL, fludarabine,
aldesleukin, cyclophosphamide
MTD, ORR
A Phase 1 Study of Intraperitoneal MCY-M11
Therapy for Women With Platinum Resistant
High Grade Serous Adenocarcinoma of the
Ovary, Primary Peritoneum, or Fallopian Tube,
or Subjects With Peritoneal Mesothelioma With
Recurrence After Prior Chemotherapy
Metastatic or
unresectable
OC
Phase I
15
MCY-M11 (intraperitoneal
administration)
AEs
Clinical Study to Assess Efficacy and Safety
of MDA-TIL(Autologous Expanded Tumor
Infiltrating Lymphocytes) Across Multiple Tumor
Types
PSOC/PROC/
PRROC
Phase II
60
Autologous tumor infiltrating
lymphocytes MDA-TIL,
interleukin-2 (IL-2), fludarabine,
cyclophosphamide
ORR
A Phase 2, Single-Center, Open Label Study of
Autologous, Adoptive Cell Therapy Following
a Reduced Intensity, Non-Myeloablative,
Lymphodepleting Induction Regimen in
Metastatic Ovarian
PROC/ PRROC
Phase II
15
TIL, IL-2, fludarabine, total body
radiation
ORR, AEs
A Phase I Study Evaluating the Feasibility and
Safety of Infusion of “Re-Stimulated” Autologous
Tumor-Infiltrating Lymphocytes(TILs) Followed
by Low-Dose Interleukin-2 Therapy in Patients
With Platinum Resistant High Grade Serous
Ovarian, Fallopian Tube, or Primary Peritoneal
Cancer
PROC
Phase I
9
Re-stimulated TILs, IL-2,
cyclophosphamide
AEs
Intraperitoneal Infusion of Autologous Monocytes
With Sylatron(Peginterferon Alfa-2b) and
Actimmune (Interferon γ-1b) in Women
With Recurrent or Refractory Ovarian Cancer,
Fallopian Tube Cancer or Primary Peritoneal
Cancer
PROC
Phase I
40
Single group: autologous monocytes
+ Sylatron®(peginterferon alfa-
2b) and Actimmune®(interferon
γ-1b)
MTD
The ACTIVATE(Adoptive Cell Therapy
InVigorated to Augment Tumor Eradication) Trial
(ACTIVATE)
PROC
Phase I
24
Single group: cyclophosphamide,
fludarabine, pembrolizumab, tumorinfiltrating lymphocytes, IL-2
Serious
adverse events
TIL Therapy in Combination With Checkpoint
Inhibitors for Metastatic Ovarian Cancer
PROC
Phase I/II
12
Single group: cyclophosphamide,
fludarabine, TIL infusion, IL-2,
ipilimumab, nivolumab
Number
and type
of reported
adverse events
基于疫苗接种
Trial of Active Immunotherapy With Globo H-KLH
(OPT-822/821) in Women Who Have NonProgressive Ovarian Cancer
First-line OC
maintenance
Phase II
110
Single group: OPT-822/OPT-821
PFS
Ability of a Dendritic Cell Vaccine to Immunize
Melanoma or Epithelial Cancer Patients Against
Defined Mutated Neoantigens Expressed by the
Autologous Cancer
Metastatic
OC
Phase II
86
Single group: peptide-loaded DC
vaccine
Response rate,
percentage of
patients who
have a clinical
response to
treatment
Phase 2 Study of Pembrolizumab, DPX-Survivac
Vaccine and Cyclophosphamide in Advanced Ovarian, Primary Peritoneal or Fallopian Tube Cancer
PSOC/
PROC
Phase II
42
Single-dose expansion groups:
pembrolizumab, DPX-Survivac,
cyclophosphamide
ORR
GL-ONC1 Oncolytic Immunotherapy in Patients
With Recurrent Ovarian Cancer(VIRO-15)
PROC/
PRROC
Phase Ib/II
52
Single group: GL-ONC1(a
genetically-engineered oncolytic
vaccinia virus)
Safety and
tolerability
Intensive Locoregional Chemoimmunotherapy
for Recurrent Ovarian Cancer Plus Intranodal DC
Vaccines
PSOC Phase I/II 49
Cisplatin + celecoxib + DC vaccine vs cisplatin + IFN + rintatolimod + celecoxib + DC vaccine
Change
CD8+ tumorinfiltrating
T-cells in the
peritoneal fluid,
adverse events
资料来源:ClinicalTrials.gov2018年9月。
AEs,不良事件;CTCAE,不良事件通用术语标准;DC,树突细胞;DCR,疾病控制率(定义为CR+PR+SD);DFS,无病生存期;DLTs,剂量限制毒性;IL,白细胞介素;MTD,最大耐受剂量;NACT,新辅助治疗;OC,卵巢癌;ORR,总体反应率;OS,总生存期;PBL,外周血淋巴细胞;PD-L1,程序性细胞死亡蛋白配体1;PFS,无进展生存期;PRO,患者报告的结果;PROC,铂耐药OC;PRROC,铂耐药难治性OC;PSOC,铂敏感复发OC;TCR,T细胞受体;TIL,肿瘤浸润淋巴细胞;irPFS,免疫相关的无进展生存期。
卵巢癌是一种可被宿主免疫系统识别的免疫原性肿瘤。抗肿瘤免疫反应可通过肿瘤反应性T细胞和抗体的形式进行检测。肿瘤源性或外周血T细胞识别自体肿瘤相关抗原(TAAs),如睾丸分化抗原,或通用TAAs。然而,仅有约50%的卵巢癌患者出现自发的抗肿瘤免疫应答,这些患者的肿瘤中含有丰富的T细胞浸润物。T细胞浸润患者无进展生存期(PFS)和总生存期(OS)更长。相反,主要由T调节细胞等抑制性细胞介导的免疫逃避机制与低存活率相关。
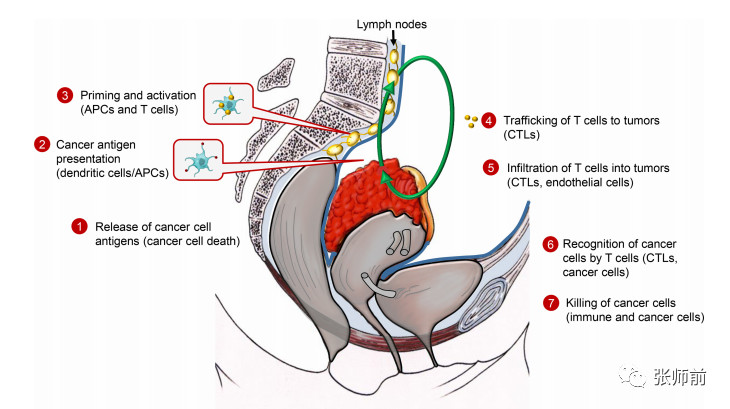
Chen和Mellman发展了他们所说的癌症免疫周期(图1),在第一步中,产生的肿瘤相关新抗原被专业的抗原呈递细胞如树突状细胞(DCs)释放和捕获(步骤1)。接下来,DCs处理并将主要组织相容性复合物(MHC)I类和MHCII类分子上的抗原呈递给T细胞(步骤2)。该步骤导致效应T细胞的启动和激活,其能够对癌症特异性抗原做出反应(步骤3)。最后,激活的效应T细胞移动到(步骤4)并渗入卵巢癌(步骤5),特异性地通过其T细胞受体(TCR)与MHCI在细胞表面显示的同源抗原之间相互作用识别并结合肿瘤细胞(步骤6),然后杀死这些靶向的癌细胞(步骤7)。
细胞因子
卵巢癌的生长可被认为是癌症免疫周期的失败。近年来已经测试了激活或恢复此过程的几种可能性。最初,人们对细胞因子的治疗寄予厚望。干扰素最初被发现是一种抗病毒蛋白,其对细胞免疫应答起关键作用,并诱导抗原呈递给特定的T细胞。此外,还发现干扰素通过抑制关键受体如人表皮生长因子受体-2(HER-2)直接阻断卵巢癌细胞的增殖。
图1卵巢癌免疫周期(根据Chen和Mellman修改)。APC,抗原呈递细胞; CTL,细胞毒性T淋巴细胞。
人干扰素&α;(IFN-&α;)或IFN-&γ;在卵巢癌患者中表现出一定的疗效。不过,在晚期卵巢癌一线治疗的大型III期临床试验显示,IFN-&γ;皮下注射+标准卡铂/紫杉醇和卡铂/紫杉醇单药相比,加入这种免疫调节剂对患者有不利的影响,IFN-&γ;组患者的中位总生存期降低,HR(死亡率)为1.45。为什么这种形式的“免疫疗法”会失败?非特异性激活的效应细胞如巨噬细胞会分泌包括血管内皮生长因子(VEGF)在内的生长因子,而且可能无法识别和攻击卵巢癌细胞从而导致进展。
此外,IFN-&γ;在卵巢癌中诱导检查点分子如程序细胞死亡蛋白1(PD-1)及其配体PD-L1的表达。PD-1和PD-L1的高表达均与免疫抑制相关,可能导致肿瘤免疫逃逸,导致临床效果不佳。特别是IFN-&γ;通过激活巨噬细胞和相关细胞的先天免疫反应产生新喋呤。已经注意到包括卵巢癌在内的恶性疾病患者与尿液或血清中新蝶呤浓度高之间存在相关性,这种相关性会导致生存率降低和预后受损。因此,有证据表明泌尿系新蝶呤不能反映卵巢癌组织的局部抗肿瘤免疫环境。细胞因子治疗的失败还应在替代和补充癌症医学的背景下进行讨论,这与总生存期的减少有关。例如,槲寄生提取物广泛用于提高免疫刺激,并已显示促进IFN-&γ;释放。然而,这种对免疫系统的作用可能导致相反的和不希望的效果,这反过来又会恶化预后。
疫苗
为了在体内产生具有识别肿瘤能力的效应T细胞,癌症疫苗具有免疫治疗作用,可以利用免疫系统延长缓解率,防止进一步的恶性生长。癌症疫苗的原理是刺激针对特定恶性细胞的免疫应答。
疫苗接种候选的人肿瘤抗原主要来源于分化抗原、突变抗原、扩增抗原、剪接变异体抗原、糖脂抗原、病毒抗原或肿瘤睾丸抗原。理想的抗原不应在正常组织中表达,而应在肿瘤组织中高浓度表达。免疫原性以及在肿瘤进展中的作用也是候选抗原重要的特性。然而,目前已知的抗原中没有一种完全符合这些标准。肿瘤抗原的肿瘤睾丸(CT)家族包括>250个成员,最常见的研究包括纽约食管-1(NY-ESO-1),它在卵巢癌和其他恶性肿瘤中均表达。Odunsi等报道了上皮性卵巢癌患者CT抗原NY-ESO-1和L-抗原家族成员1(LAGE-1)的高表达,并在患者中成功靶向这些分子。为了进一步提高NY-ESO-1的表达,抑制DNA甲基化的表观遗传调节因子也与NY-ESO-1疫苗和标准化疗联合使用。研究发现,该方案增加了NY-ESO-1抗体和T细胞应答,而且6/10复发卵巢癌患者达到疾病稳定和部分缓解(PR)。其他疫苗针对单一抗原,如CA125、MUC-1、HER2、间皮素或p53。最近有报道称,一项II期试验评估了一种名为CVac的黏液蛋白1靶向DC治疗作为上皮性卵巢癌患者的维持治疗的结果。在所有CVac治疗组和部分标准治疗组中均诱导了可变但可测量的黏液蛋白T细胞特异性应答,但治疗组的PFS与标准治疗组相比并没有显著延长。
更有前途的是使用来自不同抗原的不同肽段,或使用肿瘤细胞、肿瘤裂解物或肿瘤衍生的RNA产生的完整肿瘤抗原方法。这种个体化疫苗的概念包括对单个突变的全基因组测序鉴定、新表位的计算预测以及通过基于RNA的方法设计和制造针对每个患者独特的多特异性疫苗。已在黑色素瘤中证明了疫苗诱导的T细胞浸润和新表位特异性杀伤自体肿瘤细胞。这是开创免疫抗癌方法的先河,也是实现真正个性化用药的一个很好的例子。
细胞疗法
以体细胞突变基因编码的蛋白为靶点的自体淋巴细胞过继转移,在不同类型转移癌患者中介导了大量客观的临床回归。最近,Zarachakis等人提出了一名接受肿瘤浸润淋巴细胞(TILs)治疗的转移性乳腺癌患者,淋巴细胞对四种蛋白的突变形式均具有应答。这些突变蛋白特异性TILs的过继转移结合白细胞介素(IL)-2和检查点阻断能使转移性乳腺癌的完全缓解。根据目前应用的方案,这种治疗方式淋巴细胞必须通过白细胞分离术,培养,活化和离体扩增,然后在淋巴清除化疗后重新输注到肿瘤患者体内,通过创造空间、清除免疫抑制细胞以及诱导支持转移T细胞的体内存活和扩增的细胞因子来准备宿主。维持高剂量IL-2输注在过继细胞疗法(ACT)中的应用仍存在争议。虽然有报道称这种治疗支持体内新转移的T细胞,但新的证据表明高剂量IL-2促进T调节细胞的重建,这与ACT的临床应答呈负相关。
一些临床研究已经研究了TILs在卵巢癌中的疗效,其中大多数评估了化疗与TILs联合的疗效。报告的应答率并未超过单独化疗的预期,应答时间相当短。然而,在Rosenberg和Dudley在ACT中建立淋巴清除预处理和IL-2输注联合之前,这些早期试验已经完成。
最近,在一项非随机I期试验中,T细胞过继疗法用于晚期卵巢癌患者,这些患者在手术切除和顺铂化疗后无疾病证据,在该试验中,部分患者连续接受自体TILs联合化疗,而其他患者则单独接受化疗.实验组3年的OS为100%,对照组中为67.5%。最近,报道了一项联合方法的I期研究,该方法包括基于DC的自体全肿瘤免疫接种,然后过继转移自体疫苗引发的CD3/CD28共刺激的淋巴细胞,证明临床效益与疫苗诱导的抗肿瘤免疫的恢复相关。
然而,过继性T细胞疗法受到肿瘤特异性淋巴细胞可用性的限制。TCR工程改造的T细胞和嵌合抗原受体(CAR)修饰的T细胞已成为包括卵巢癌在内的人类恶性肿瘤的有希望的治疗方式。最有希望的TCRs是从已知的卵巢癌抗原(如NY-ESO-1或p53)中识别出HLA-A2限制性表位。
另外,不依赖于MHC的CAR修饰T细胞的免疫疗法,在治疗癌症上取得了巨大的成功,尤其是B细胞血液恶性肿瘤。嵌合抗原受体是包含细胞外抗原识别区域的重组受体,该识别区域与肿瘤表位、跨膜区域和激活T细胞的细胞质信号区域特异性结合。因此,表达CAR的T细胞可以被设计成识别多种细胞表面抗原,包括糖脂类、碳水化合物和蛋白质,并通过激活细胞质共刺激,攻击表达这些抗原的恶性细胞。已经研究过并且可能与卵巢癌有关的一些产生的CARs有叶酸受体-&α;(FR&α;),HER-2,间皮素和L1-CAM。总之,就实体癌症而言,CAR导向策略的效果令人失望。
NK细胞参与先天免疫和肿瘤监测;它们还能够通过一类独特的受体识别靶细胞上的MHCI类或I类分子。例如,与TILs相比,NK细胞可以不经HLA-无限制方式致敏而发挥抗肿瘤活性并裂解肿瘤细胞。研究表明,卵巢癌患者腹水可产生细胞毒性NK细胞。迄今为止,临床经验局限于低部分应答和短时间的PFS。
免疫学检查点
当T细胞的TCR与癌细胞表面的特定配体结合时,TCR信号可以通过增强(共刺激)或抑制(共抑制)信号的共信号通路(称为免疫检查点)来修饰。已经描述了两个重要的抑制免疫检查点:通过PD-1和PD-L1或PD-L2信号和通过CTLA-4及其配体B7-1或B7-2信号传导。许多其他免疫调节途径以及肿瘤微环境中骨髓和基质细胞表达或分泌的抑制因子是与免疫检查点阻断协同作用的潜在靶标。
PD-1和CTLA-4是负性调节因子,其减弱正常T细胞活化以抑制炎症并防止免疫系统过度应答和组织损伤。然而,这种自我调节成为癌细胞逃避激活的免疫系统进攻的一个理想机会窗口。因此,抑制抑制性免疫检查点信号传导通过恢复T细胞功能来增强抗肿瘤免疫应答。CTLA-4和PD-1免疫检查点在这一过程中起不同的作用,这可能解释了它们的不同活性和毒性。CTLA-4免疫检查点通过与CD28早期必不可少的共刺激配体B7-1和B7-2结合负性调控T细胞的启动和活化。抑制CTLA-4导致自反应T细胞(包括肿瘤特异性T细胞)的扩增失调。像ipilimumab这样的抗CTLA-4抑制剂已经被证明具有显著的免疫相关毒性,这可能是不加选择地激活自反应T细胞的结果。PD-1是一种细胞表面受体,在正常T细胞活化过程中上调并调节抗原感受性T细胞的活性。PD-1与已知的两种配体PD-L1和PD-L2相互作用,抑制T细胞信号转导和细胞因子的产生,由于T细胞增殖受限和对凋亡的敏感性增加,也导致效应T细胞数量减少。在这两种配体中,PD-L1似乎在肿瘤微环境中更相关,并在多种肿瘤细胞上表达。肿瘤浸润淋巴细胞可诱导肿瘤细胞PD-L1表达,导致抗肿瘤免疫功能下降。PD-L1的表达也可以通过基因扩增或致癌信号通路进行调控。针对CTLA-4、PD-1或PD-L1的抗体可消除负信号,从而恢复T细胞功能,并且这些抗体的许多临床试验正在评估中(表1-3)。
表2 免疫检查点抑制剂
Drug
Target
FDA or EMA label
Ipilimumab
CTLA-4
Yes
Pembrolizumab
PD-1
Nivolumab
Atezolizumab
PD-L1
Durvalumab
Tremelimumab
CTLA-4
No
AGEN1884
REGN 4659
TSR-042
BMS-936558(MDX-1106)
Pidilizumab
REGN2810
Spartalizumab
Camrelizumab
JNJ-63723283
AGEN 2034
CS 1003
BCD-135
MDX1105-01
KN035
HLX20
LY3300054
BGB-A333
FAZ053
PD-1
PD-L1
CTLA-4,细胞毒性T淋巴细胞相关抗原4;EMA,欧洲药品管理局;FDA,美国食品药品监督管理局;PD-1,程序性细胞死亡蛋白1;PD-L1,程序性细胞死亡蛋白配体1。
表3卵巢癌中使用免疫检查点抑制剂的研究
Checkpoint inhibitor
Inclusion
Phase
N
Prior therapy
(number of lines)
Response rate
Reference
Anti-CTLA-4
Ipilimumab
Recurrent OC
I
9
Vaccination and
>1
10% PR, 33% SD
Hodi et al 2008
Anti-PD-1
Nivolumab
PROC
II
20
≥4(55%)
10% CR, 5% PR,
30% SD
Hamanishi et al 2015
Pembrolizumab
(KEYNOTE-28)
Recurrent OC
Ib
26
≥3(65%)
4% CR, 8% PR,
23% SD
Varga et al 2015
Pembrolizumab
(KEYNOTE-100)
Recurrent OC
Cohort A: TFI of≥3 to 12 months
Cohort B: TFI of≥3 months
II
376
A: 1–3
B: 4–6
8% ORR(17.3%
ORR CPS>10)
Matulonis et al 2018
Anti-PD-L1
Avelumab
PROC
Ib
124
≥3(58%)
9.7% PR, 44% SD
Disis et al 2016
Atezolizumab
Recurrent OC
Ib
12
>6(58%)
25% ORR
Infante et al 2016
BMS-936559
Recurrent OC
I
17
>1
6% PR,18% SD
Brahmer et al 2012
Combination therapy
Durvalumab
+ olaparib
Recurrent OC
I
12
>1,
50%>4
17% PR, 66% SD
Lee et al 2017
Durvalumab
+ cediranib
12
50% PR, 25% SD
Durvalumab
+ olaparib
(MEDIOLA)
PSOC BRCA mut
II
32
>1
19% CR, 44% PR,
9% SD
Drew et al 2018
TSR-042
+ niraparib
(TOPACIO)
PROC
II
62
<5
Evaluable: 25%
ORR, 42% SD;
BRCAmut: 25%
ORR, 38% SD
Konstantinopoulos et al
2018
CPS,综合得分;CR,完全缓解;CTLA-4,细胞毒性T-淋巴细胞相关抗原4;OC,卵巢癌;ORR,总体反应率;PD-1,程序性细胞死亡蛋白1;PDL1,程序性细胞死亡蛋白配体1;PR,铂耐药;PROC,铂耐药性卵巢癌;PSOC,铂敏感复发性卵巢癌;SD,疾病稳定;TFI,无治疗间隔。
Hodi等人首先注意到在使用粒细胞-巨噬细胞集落刺激因子(GM-CSF)转导的自体卵巢肿瘤细胞疫苗后,给2名患者一次性输注ipilimumab,给9名患者高达11次输注ipilimumab,然后检测卵巢癌。仅有3例患者病情稳定2个月以上。Ipilimumab作为单一药物还没有得到进一步的评估,在ClinicalTrials.gov上列出的CTLA-4抑制剂的大多数试验均未招募。
Hamanishi及其同事首次报道,PD-L1在卵巢癌细胞上的高表达与预后不良和肿瘤中细胞毒性T淋巴细胞浸润减少有关,提示PD-L1表达通过抑制T细胞浸润促进免疫抑制微环境。PD-L1表达和TIL均为孤立的预后因素,但PD-L1表达与生存率呈负相关。这些发现最近被Wieser等人证实,在卵巢癌中,PD-1和PD-L1mRNA的高表达与PFS和OS的降低有关。此外,PD-L1在TP53突变或BRCA-1/2突变的卵巢癌中表达较高。
用针对PD-1或PD-L1的抗体治疗卵巢癌患者有明确的理论基础。Nivolumab是一种完全人源化的针对PD-1受体的IgG4单克隆抗体,美国食品和药物管理局(FDA)批准用于治疗包括黑色素瘤和肾细胞癌在内的各种恶性肿瘤。Hamanishi等人发表了nivolumab在复发性卵巢癌中的首次试验。20例铂耐药卵巢癌患者每2周接受nivolumab单抗治疗,直至病情进展或最长48周。最佳总体反应为15%,但有4例患者达到较长时间的疾病控制,其中2例患者达到长时间的完全缓解(CR)。16例PD-L1高表达患者中14例无应答,而4例低表达患者中1例为应答者,提示PD-L1表达不是应答的可靠预测因子。
最近KEYNOTE100试验显示,pembrolizumab(PD-1抗体)单药治疗与晚期复发性卵巢癌抗肿瘤活性相关。所有患者均接受pembrolizumab治疗,其中285例复发性晚期卵巢癌患者既往化疗方案少于4周期,无治疗间隔3- 12个月,总缓解率(ORR)为7.4%,平均应答持续时间为8.2个月。第二组中91例患者,该组患者之前接受过3次以上的化疗,且至少有3个月的无治疗间隔,ORR为9.9%,本组未达到应答的平均持续时间。总体而言,ORR为8%,包括7个完全缓解和23个部分缓解。平均应答持续时间为8.2个月,有趣的是65.5%的应答持续时间超过6个月。无论年龄、既往治疗方式、无进展/无治疗间隔时间、铂敏感性和组织学如何,均观察到应答。本实验中PD-L1的表达采用联合阳性评分(CPS)的方法进行评估,CPS的定义是肿瘤细胞总数x100中PD-L1阳性细胞的数量,包括肿瘤细胞和免疫细胞。CPS小于1的患者ORR为5.0%,CPS大于1的患者ORR为10.2%,CPS大于10或更高的患者ORR为17.1%。有趣的是,所有CRs均发生在CPS≥10的患者中。然而,PD-L1表达作为免疫检查点抑制剂应答的预测因子的有效性尚不清楚,在CPS<1的样本中,临床获益率为32.6%。有趣的是,在一项包含10多万个肿瘤样本的大型研究中,约0.7%的患者和1.3%的卵巢癌患者发现PD-L1扩增,表明PD-L1扩增只发生在一小部分恶性肿瘤中。大多数PD-L1扩增的肿瘤(85%)具有低至中等的肿瘤突变负荷(TMB)。免疫组化检测PD-L1扩增并不总是与PD-L1表达相关。目前尚不清楚PD-L1扩增的癌症是否对检查点阻断具有较高的应答率,即使在微卫星不稳定、PD-L1IHC高表达和TMB高的情况下也是如此。
Avelumab是一种完全人源化的单克隆抗PD-L1抗体,已在124例难治性或复发性卵巢癌患者中进行Ib期试验。中位治疗持续时间为12周。6.4%的患者发生3/4级不良事件,8.1%的患者因不良事件而停止治疗。12名患者的ORR部分缓解为9.7%。疾病控制率为54%。PD-L1阳性肿瘤总有效率为12.3%,PD-L1阴性肿瘤总有效率为5.9%。基于PD-L1表达,中位PFS和OS差异无统计学意义。目前,avelumab对卵巢癌进行了两项III期试验:一项是与卡铂和紫杉醇联合一线用药(JAVELIN100),另一项是与聚乙二醇化脂质体阿霉素联合治疗复发铂耐药疾病(JAVELIN200)。
检查点抑制剂观察到的反应率较低,然而,反应显示出意想不到的长时间。已经通过多种途径提高治疗效果,包括联合化疗、抗血管生成药物、聚ADP-核糖聚合酶(PARP)抑制剂(PARPi)、疫苗、靶向治疗、放疗和其他免疫刺激化合物。
PARPi阻断DNA修复,导致DNA断裂。这些DNA片段可以进入细胞质并与环鸟苷单磷酸腺苷AMP合成酶(cGAS)结合,导致肿瘤微环境中干扰素基因刺激因子(STING)通路上调,这是I型干扰素和其他免疫调节分子的有效激活物。这可以解释为什么PARPi上调PD-L1表达。此外,还观察到PARPi诱导的新抗原表达增加和T细胞肿瘤浸润增强。
TOPACIO是一项I/II期临床试验,旨在评估niraparib联合pembrolizumab治疗复发、铂耐药/难治性卵巢癌的安全性和有效性。在数据截止时,在62名卵巢癌患者中,有60人可以进行初步反应评估。数据显示,可评估人群的ORR为25%,疾病控制率(DCR)为67%;BRCA突变组ORR为25%,DCR为63%;BRCA野生组ORR为24%,DCR为65%。根据研究者的评估,铂耐药卵巢癌患者ORR为23%(7/30),铂难治性患者ORR为24%(4/17),铂不合格患者ORR为31%(4/13)。有趣的是,应答率并不依赖于突变状态或铂状态。
第二项试验(MEDIOLA)仅在二线或晚期治疗中纳入了具有生殖系BRCA突变的复发性铂敏感卵巢癌患者。治疗开始用olaparib单药治疗4周,然后与PARPi和durvalumab同时治疗。联合应用后,12周DCR为81%,ORR为63%。对归档组织中PD-L1和TILs的分析显示,PD-L1在肿瘤细胞、CD3或CD8TILs中的表达与最佳客观反应无统计学意义。研究人员发现,在有客观反应或病情稳定的患者中,PD-L1表达和TIL密度有增加的趋势。此外,在12周达到疾病控制的患者中,肿瘤细胞中PD-L1的数值表达也较高。最近,在包括卵巢癌在内的晚期实体肿瘤中研究了BGB-A317(一种变体单克隆抗体,一种不具有Fc&γ;受体结合的变体单克隆抗体)与BGB-290(一种有效的PARP1/2抑制剂)一起靶向PD-1。提供的结果支持检查点抑制剂与PARPi联合使用。
将血管生成抑制剂与免疫检查点抑制剂结合的基本原理是深远的(参见Li等人的综述)。VEGF可以抑制T细胞和DCs,并刺激免疫抑制Treg。III期IMpower150研究证明,与贝伐单抗联合卡铂和紫杉醇相比,联合使用atezolizumab和贝伐单抗加卡铂和紫杉醇显著延长晚期非鳞状细胞肺癌患者一线治疗的OS。两项评估贝伐珠单抗和atezolizumab联合治疗复发性卵巢癌(ATALANTE)和一线卵巢癌(IMagyn050,表1)的大型试验目前正在招募患者。
鉴于这些经验,已设计了若干III期随机、双盲、安慰剂对照、多中心研究,包括免疫检查点抑制剂与PARPi和血管生成抑制剂的联合研究,并于2018年开始注册。在DUO-O试验中,新诊断的晚期卵巢癌患者将接受durvalumab联合化疗和贝伐珠单抗的治疗,其次是durvalumab、贝伐珠单抗和奥拉帕尼进行维持。ATHENA试验采用了一线铂类化疗后nivolumab和rucaparib维持的组合。在FIRST试验中,将铂类药物与TSR042(PD-L1抑制剂)联合,随后niraparib和TSR-042维持治疗与适应性标准铂类药物治疗进行比较。最后,计划进行紫杉醇/卡铂与紫杉醇/卡铂、pembrolizumab联合奥拉帕尼的比较试验。
讨论
与其他恶性肿瘤如黑色素瘤或肾细胞癌相比,免疫疗法尚未被批准用于卵巢癌的治疗;然而,数千名患者将被纳入明年即将进行的一线试验,以阐明免疫疗法在卵巢癌中的作用。大多数试验包括检查点抑制剂作为主动原则。从复发性卵巢癌的小型II期试验到一线治疗,这是一个非常快速和不寻常的进展。一些评论家认为我们是先跑后走。
然而,在疾病早期应用免疫疗法来逆转长期暴露于新抗原和多种化疗方案导致的T细胞衰竭是有充分理由的。耗尽的T细胞逐渐失去其增殖、产生细胞因子和细胞毒性能力。
为了提高治疗效果,大多数正在进行的试验评估检查点抑制剂与其他药物如PARPi或贝伐珠单抗的潜在协同作用。放疗在卵巢癌治疗中不发挥主要作用;然而,辐射诱导的癌细胞损伤暴露出肿瘤特异性抗原,使其可见于免疫监视和促进启动和激活细胞毒性T细胞。可以推测,对选定的肿瘤病灶进行照射,结合检查点抑制剂,可以治疗所有携带类似抗原的病灶。
其他方法,如疫苗接种或基于细胞的治疗,可能由于较少的工业支持,没有得到同样程度的研究。
由于区域淋巴结是识别新抗原和抗肿瘤免疫应答的必要环节,在恶性疾病过程中可能表现出重要的免疫记忆功能,因此有必要对淋巴结切除术的意义进行探讨。作为主要减瘤手术的一部分,去除未受影响的骨盆和腹主动脉旁淋巴结可能通过减少活化的T细胞严重损害后期的免疫抗肿瘤干预(图1)。尽管淋巴结经常呈阳性,但Lion试验最近已经证实,卵巢癌中系统性淋巴结切除术的治疗效果未能实现,至少部分可以通过减少淋巴结数量来解释。
越来越多的证据表明,肠道微生物群可以影响癌症免疫治疗的结果。三项研究提供了新的证据,证明肠道微生物群影响癌症患者抗PD-1免疫治疗的效果。这些发现也可能影响手术方法。在减瘤手术中,为了获得最佳的切除效果,经常进行肠道切除术,这不仅会导致肠道细菌在腹部的遗传,还会影响肠道微生物群的组成。当然,要完全阐明微生物组在卵巢癌手术和免疫治疗中的作用和意义还需要更多的研究。
虽然卵巢癌具有免疫原性,但除了BRCA突变、同源重组缺陷或错配修复缺陷的肿瘤外,TMB相当低。因此,与其他恶性肿瘤相比,T细胞浸润和新抗原表达可能不太明显。PD-L1的表达是一种广泛应用的标志物;然而证据仍然不足,而且值得怀疑。肿瘤细胞PD-L1的表达量单独不能作为PD-1/L1抑制的潜在益处的指标,因为如果肿瘤中没有免疫细胞的存在,就缺乏介导该作用的效应细胞。近年来,CD8+T细胞的效应基因与肿瘤对免疫治疗的抵抗或无反应有关。这些基因中的大多数与抗原呈递和IFN-&γ;反应相关。在免疫治疗耐药患者中,对这些基因的突变进行个性化的仔细评估和验证,可能有助于识别免疫逃逸的新机制,并加速开发一种新的药物来规避这些逃逸机制。
因此,主动免疫治疗的前提是将能够识别和攻击癌细胞的效应细胞带入肿瘤,并避免PD-1/PD-L1介导的抑制。答案仍在大量正在进行的试验的结果中。
Marth C, Wieser V,Tsibulak I, et al. Int J Gynecol Cancer 2019;29:201–211.
恒瑞医药公司 袁凤丽
山东大学齐鲁医院 张师前