李进教授 从研究者角度看中国抗肿瘤药物研发创新之路
2020年10月18日,中国药促会抗肿瘤药物临床研究专业委员会成立大会暨抗肿瘤创新药物临床研究高峰论坛在上海顺利召开。会议期间,同济大学东方医院的李进教授从研究者角度分析了中国抗肿瘤药物研发存在的问题、挑战和未来发展方向。

中国抗肿瘤创新制药的现状
近100多年来,大多数抗肿瘤药物的研发是西方研究者的贡献,中国研究者的贡献很少。从2011年开始,中国研究者和中国企业开始崭露头角。
国内肿瘤药研发的进步
近10年来,中国抗肿瘤新药经历了从无到有,从仿制走向创新的艰难历程。2014年之前,我国医药工业聚焦于原料药、仿制药的生产,甚少有创新药物面世。2014年,我国首个完全自主研发的抗癌新药甲磺酸阿帕替尼上市;2015年,自主创新抗肿瘤新药西达本胺上市;2018年,呋喹替尼、安罗替尼、吡咯替尼、特瑞普利单抗、信迪利单抗先后获批上市;2019年,卡瑞利珠单抗、替雷利珠单抗、氟马替尼、甲苯磺酸尼拉帕利(附条件批准)获批上市,索凡替尼上市申请获CDE优先审评公示;2020年,甲磺酸阿美替尼、泽布替尼、伊尼妥单抗获批上市。

呋喹替尼突破mCRC治疗困境,值得国人自豪
呋喹替尼是由中国学者发明、中国制药企业开发、中国临床医生开展临床研究、最终由CDE批准的本土抗肿瘤新药,从头到尾都属于中国制造。值得骄傲之处在于,呋喹替尼对比安慰剂用于转移性结直肠癌的三线治疗,可延长患者中位总生存期(OS)2.73个月,是目前无其他药物可打破的“世界纪录”。
推进新药创制符合国家战略
推进新药创制,对国计民生有很重要意义,在保障和改善民生、促进产业发展、支撑服务医疗等方面均发挥了重要作用。
中国新药创制存在的问题
国外研究主要关注西方国家高发瘤种药物的研发
国外临床研究主要关注西方国家高发瘤种(例如肺癌、乳腺癌、前列腺癌)药物的研发,而中国高发瘤种关注度较低,例如肝癌、胃癌、食管癌、甲状腺癌和鼻咽癌。中国研究者更应关注中国高发肿瘤新药的研发。
中国新药:基本没有创新
中国新药申报临床数据显示:2016年至2019年期间,抗肿瘤药物申报占比约为45.5%,中国本土产品60%。但令人遗憾的是,90%属于仿制或改良,基本没有创新。未来,我们需要真正意义上的创新。
Claudin18.2靶点,重蹈PD-1单抗覆辙
目前拥有Claudin18.2靶点药物专利的公司有15家,已有7家步入临床试验阶段。中国企业要避免进行重复性、扎堆的研究工作,避免同质化竞争,才能真正推进中国的新药创制。
热衷于IPO,而非为新药创制做贡献
有不少企业热衷于IPO(Initial Public Offering,首次公开募股),并未把患者利益置于首位。不能仅从股票价值来衡量创新对国家策略的贡献。
解决方案与展望
政策指导
中国抗肿瘤药物研发的主要问题主要体现在政策指导、临床试验质量把控、药企研发水平、主要研究者水平、患者招募和研发成本六个方面。
在政策指导方面,今年疫情期间,CDE出台了共35项抗肿瘤药物临床相关技术指导原则发布概况。其中,临床专业18项,其他专业17项。政策指导是指引方向,只有高举创新大旗才能推进中国药物临床研究走向世界。
今年CSCO大会上,从杨志敏部长的讲题中我们发现,对于临床研究的整体规划,CDE出台了新政策,已有多个同作用机制品种在相同适应证获批的后续监管考量:同类产品必须优效才能批准适应证。

科技部人类遗传资源管理流程有待进一步加速。从1998年制定的《人类遗传资源管理暂行办法》到2020年《中华人民共和国人类资源管理条例》,人类遗传资源管理流程经过多次优化,但是否能够像NMPA一样,从过去的“三批三报”到现在的“60天默认许可”?
就在10月17日,《中华人民共和国生物安全法》通过表决,该部法律将于2021年4月15日正式施行。第六章《人类遗传资源与生物资源安全》第五十六条规定,为了取得相关药品和医疗器械在我国上市许可,在临床试验机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源出境的,不需要批准;但是,在开展临床试验前应当将拟使用的人类遗传资源种类、数量及用途向国务院科学技术主管部门备案。
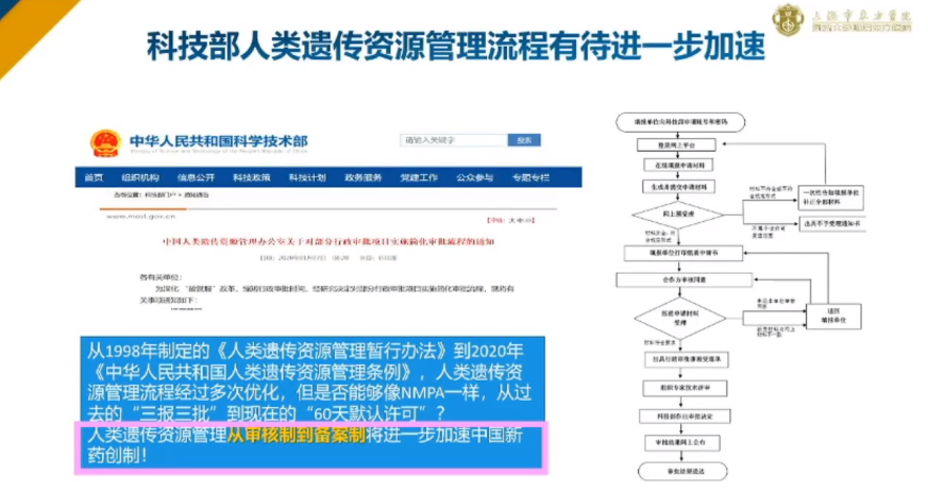
人类遗传资源管理从审核制到备案制将进一步加速中国新药创新。
企业发展模式
2020年全球Top20药企发展模式各有千秋,而新型的合作模式将助力新药创制,例如礼来-和黄的强强联合,从资金和临床方案上,新型合作模式将助力新药创制。
临床研究除了质量还是质量
临床研究牵头人是保证质量的关键。临床研究牵头人会及时做好临床试验中的风险管理:善于发现蛛丝马迹,包括有价值的生物标志物、不良反应和风险,为后续更大样本的临床研究提供依据。
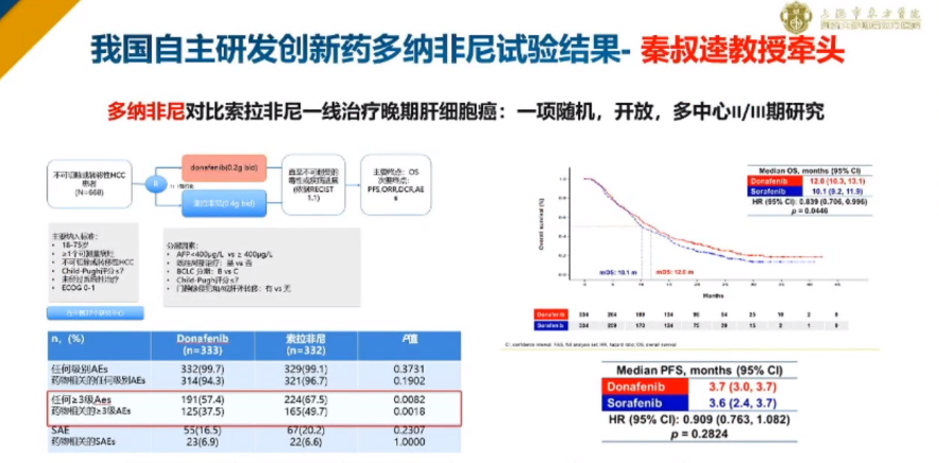
举例来说,由秦叔逵教授牵头的关于多纳非尼对比索拉非尼一线治疗晚期肝癌的多中心II/III期研究,最初这项研究是非劣效性研究,最终结果显示,多纳非尼疗效明显优效于索拉非尼。非劣效性试验转为优效试验很困难,一般情况下,非劣效性试验不失败已经很成功。
生物制药行业产业链,万事具备,只欠“源头创新”
对于东方医院的临床研究项目,每月可新入组50多例患者,每年可新入组600多例患者。
即使在新冠疫情最严重的3月份,中心也入组了29例患者。原因就在于我们团队的人工智能临床试验平台,今年将有新员工加入团队:数据核查员(彼得)。
通过人工智能方式进行实时数据审核,可以尽早发现数据问题,对研究过程中的数据问题及项目操作问题尽早识别,对研究中可能产生的风险尽早进行纠正和预防。“人工智能实时数据审核系统”将来可以使核查时间从原来的半年缩短到一个月。