王洁教授团队发现新型肺腺癌免疫治疗疗效预测生物标志物
近年来,免疫检查点抑制剂(Immune Checkpoint Inhibitors,ICIs)在包括非小细胞肺癌在内的多种恶性肿瘤中取得了革命性进展,极大的提高了患者的生存率。但是,并不是所有的患者都能从ICIs治疗中获益,不同的患者接受ICIs治疗之后的疗效也不尽相同。这就引出了一个新的临床问题:如何筛选获益患者人群,以及如何预测免疫治疗的疗效。
之前的研究表明,PD-L1高表达(≥1%)可能是筛选免疫治疗获益人群的生物标志物(biomarker),但是也有研究表示,PD-L1表达<1%的患者也能从ICIs治疗中获益。另外,PD-L1的表达可能存在瘤内异质性,影响检测的准确性。肿瘤突变负荷(tumor mutation burden,TMB)是另一个广泛研究且很有前景的biomarker,但是目前TMB预测免疫治疗疗效的最佳临界值(cut-off值)仍然存在争议。除此外,不同测序平台对于TMB计算方法各不相同。如何确定最佳的TMB cut-off值来筛选获益人群及预测免疫治疗疗效,是一系列亟待解决的问题。
2020年12月10日,国际肿瘤学杂志Journal for ImmunoTherapy of Cancer(影响因子10.25)在线发表了中国医学科学院肿瘤医院王洁/王志杰教授团队和中山大学附属肿瘤医院张力教授团队的最新合作研究成果:EPHA mutation as a predictor of immunotherapeutic efficacy in lung adenocarcinoma。

在该研究中,研究者建立了一个包含79例接受ICIs治疗的非小细胞肺癌患者队列,并对患者的肿瘤标本进行了全外显子测序(Whole Exon Sequencing, WES)。通过分析肝配蛋白A类受体(Ephrin type-A receptors, EPHA)家族基因突变与患者的疾病控制率(Disease Control Rate,DCR),无进展生存期(progression-free survival,PFS)的关系,发现:相较于EPHA野生型患者,携带有EPHA 突变的患者有着更高的疾病控制率(72.2% vs 36.1%, P=0.01)和更长的中位PFS,风险比(Hazard Ratio, HR)为0.38,95% 置信区间为 0.21~0.68,P<0.001。
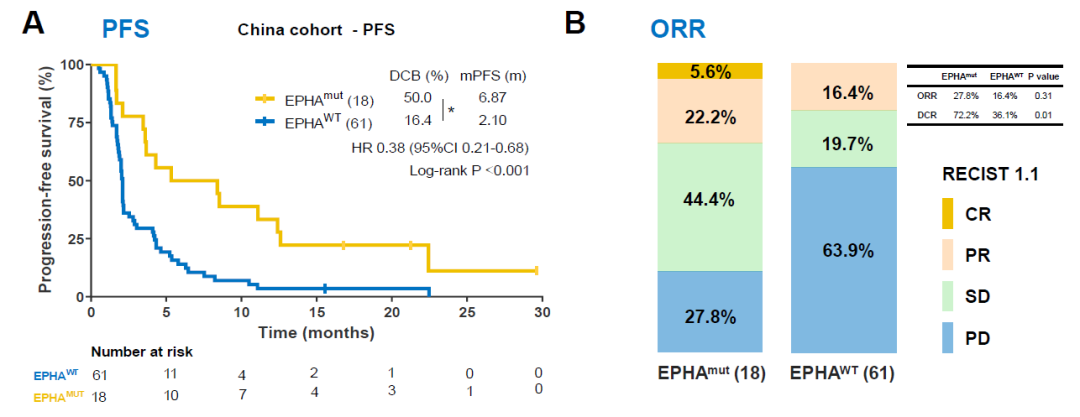
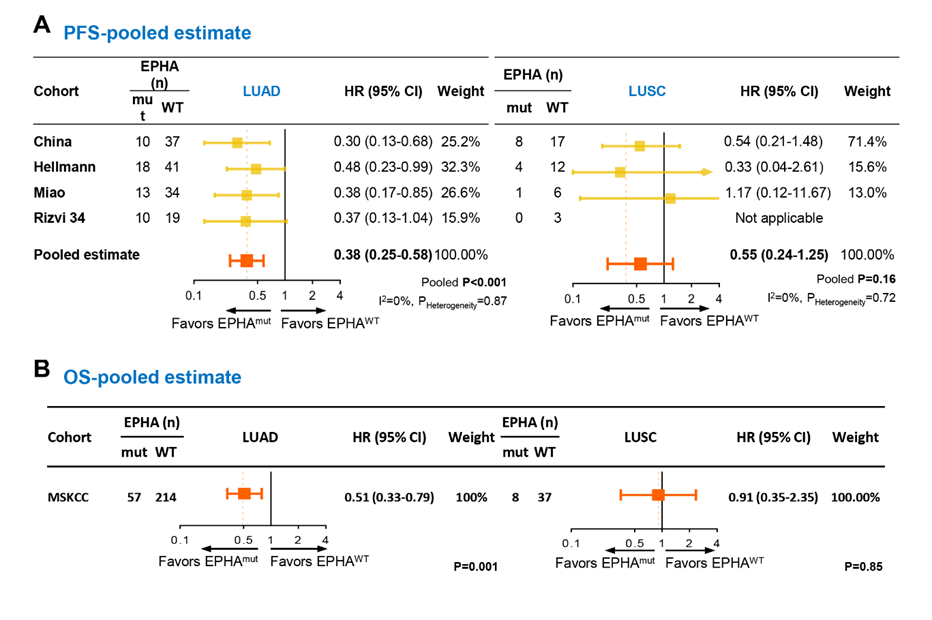
研究人员在两个公开的非小细胞肺癌ICIs治疗队列进一步验证了EHPA突变和疗效的关系。在验证队列1中,PFS的HR为0.59,95%置信区间为0.37~0.96,P=0.03;在验证队列2中,OS的HR为0.63,95%置信区间为0.41~0.98,P=0.04。进一步的荟萃分析表明,EHPA 突变只在肺腺癌中和更长的中位PFS、OS相关,而在肺鳞癌中没有显著的关系。
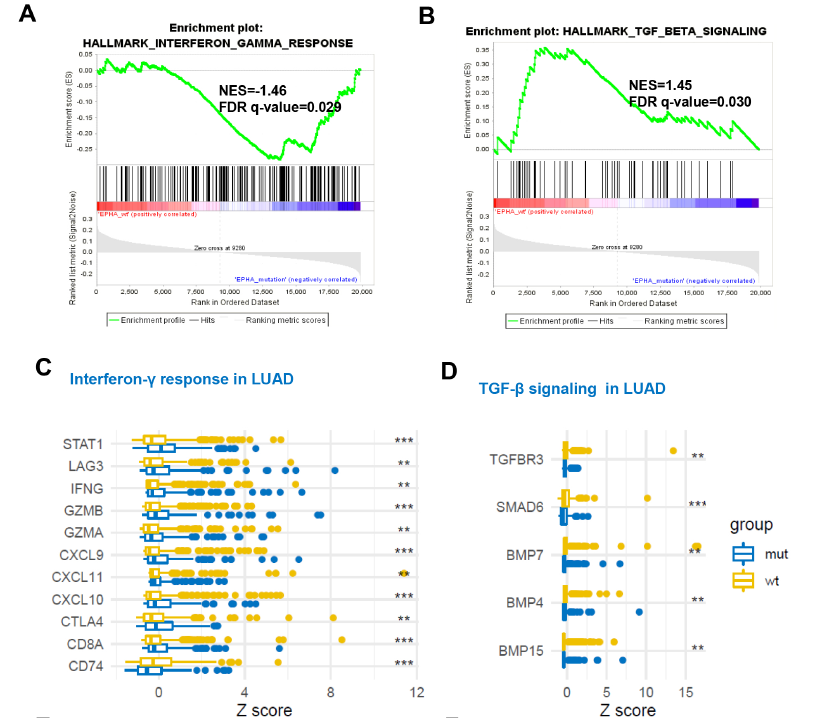
基于癌症基因组数据库(The Cancer Genome Atlas, TCGA)的基因富集分析表明,在肺腺癌中,EHPA 突变和上调的T细胞分子特征及下调的TGF-β通路有关,而在肺鳞癌中,EPHA突变和这两者无关,这进一步表明,EPHA突变可能通过调节TGF-β通路调控肿瘤免疫微环境,进而介导对ICIs的应答。
在该研究中,研究者利用一个发现队列和两个验证队列,验证了EHPA在肺腺癌免疫治疗患者中预测疗效的作用。相较于传统的PD-L1表达和TMB等连续性变化的生物标志物,EPHA突变可以直接根据测序结果分为突变型和野生型,避免了如何确定最佳cut-off值这一争议问题。另外,EHPA突变与否,可以直接由高通量测序测定,其在不同平台之间的检测异质性,远小于不同测序平台之间、不同测序panel之间带来的TMB计算异质性,适合大范围推广。另外,EPHA突变测定的费用也远小于全外显子或大基因panel测序,适用于更多的患者。因此,EHPA突变是一个十分有前景的肺腺癌免疫治疗生物标志物。当然,该结果仍然需要前瞻性临床实验进一步验证。
中国医学科学院肿瘤医院王志杰教授、王洁教授以及中山大学附属肿瘤医院张力教授是该论文的共同通讯作者,中国医学科学院肿瘤医院白桦研究员、段建春教授、李程程博士、谢文传博士以及中山大学附属肿瘤医院方文峰教授是该论文的并列第一作者。
原文链接:https://jitc.bmj.com/content/8/2/e001315.long
