化疗联合免疫治疗跃居食管癌一线治疗 敢教日月换新天
2020年的金秋,欧洲肿瘤内科学会(ESMO)年会如期而至,免疫治疗在消化系统肿瘤的治疗中大放异彩。其中食管癌领域最重磅级研究——Keynote-590研究在9月21日(欧洲中部时间)以口头报告的形式正式发布,北京大学肿瘤医院消化肿瘤内科作为该研究中国区域的组长单位在第一时间进行了详细解读。
1 Keynote-590报告内容
1.1 研究概述
Keynote-590是一项探索帕博利珠单抗联合化疗一线治疗食管癌的全球多中心、随机、对照、双盲、III期临床研究,旨在探索帕博利珠单抗联合化疗对比安慰剂联合单纯化疗作为食管癌一线治疗的疗效,化疗方案为5-FU联合顺铂,分层因素为地域(亚洲对比非亚洲区域)、病理类型(腺癌对比鳞癌)及ECOG评分(0分对比1分)。主要研究终点为OS和PFS,次要研究终点是客观有效率(ORR,RECIST v1.1)。
1.2 研究结果
研究共纳入749例不可切除的局部晚期或转移性食管癌患者,其中食管鳞癌548例。患者随机分配至帕博利珠单抗200 mg q3w(至多35个周期)联合化疗(简称P+C组,373例)、或安慰剂+化疗(简称C组,376例)。两组在基线临床病理特征方面基本均衡(表1),亚洲区域患者均在52.4%~52.5%左右,鳞癌患者占72.9%~73.5%左右,PD-L1 CPS≥10的比例在49.9%~52.4%左右。
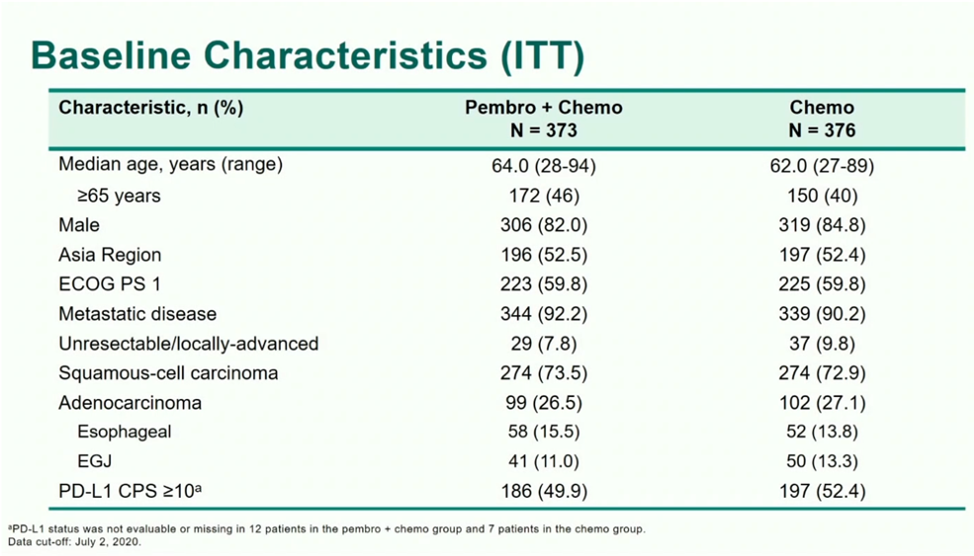
表1:患者基线特征
在总体人群中,P+C组的生存时间明显优于C组(中位生存时间(mOS):12.4月 vs 9.8月;P < 0.0001;HR:0.73;95%CI:0.62~0.86)。进一步分析CPS≥10的患者中,P+C组的生存优势更加显著(13.5月 vs 9.4月;P < 0.0001;HR:0.62;95%CI:0.49~0.78)(图1)。
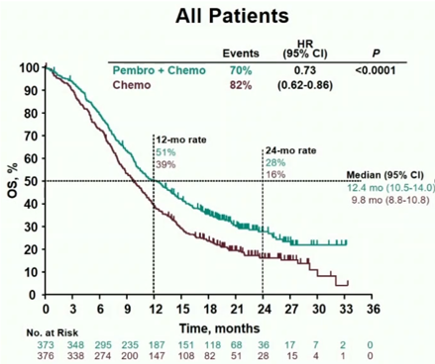
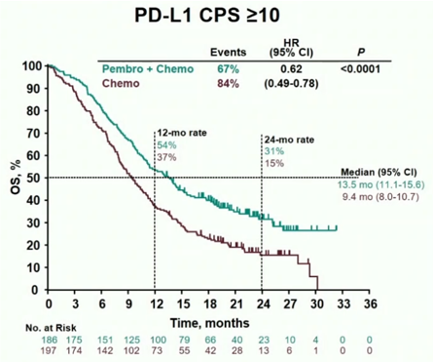
图1:总体人群的生存曲线
亚组分析发现,食管腺癌亚组中,P+C组患者的生存时间对比C组有一定延长,但并未达统计学差异(HR:0.74;95%CI:0.54~1.02)。而在食管鳞癌亚组中,P+C组的生存获益显著优于C组(mOS 12.6月 vs 9.8月;P = 0.0006;HR:0.72;95%CI:0.60~0.88);尤其在PD-L1 CPS≥10的食管鳞癌中,P+C组的获益优势就更加明显(13.9月 vs 8.8月;P < 0.0001;HR:0.57;95%CI:0.43~0.75)(图2)。
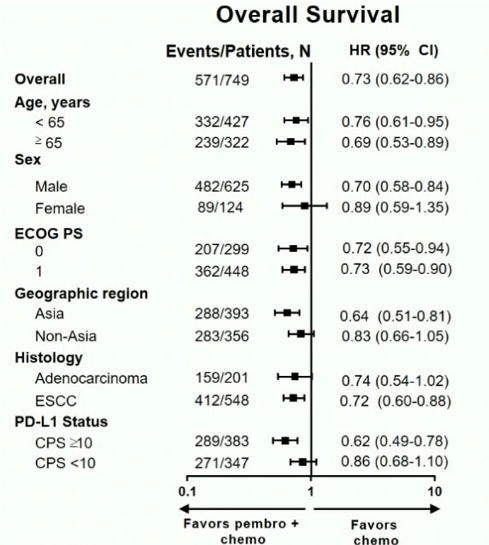
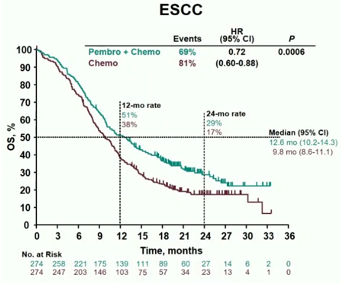
图2:食管鳞癌亚组的生存曲线
在无进展生存时间(PFS)方面,所有人群、PD-L1 CPS≥10人群和食管鳞癌人群均达到研究终点,即在三个人群中,P+C组的PFS都显著优于C组。所有人群:mOS 6.3月 vs 5.8月;P < 0.0001;HR:0.65;95%CI:0.55~0.76;PD-L1 CPS≥10人群:7.5月 vs 5.5月;P < 0.0001;HR:0.51;95%CI:0.41~0.65;食管鳞癌人群,6.3月 vs 5.8月;P < 0.0001;HR:0.65;95%CI:0.54~0.78(图3)。
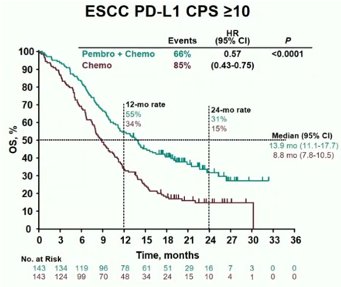
图3:不同人群的无进展生存曲线(PFS)
近期疗效方面,P+C组的客观有效率较高(45.0% vs 29.3%)、应答响应时间明显延长(8.3月 vs 6.0月,P < 0.0001)。在治疗相关不良事件方面,两组间差别并不显著,P+C组对比C组为98.4% vs 97.3%;3级及以上治疗相关不良事件,P+C组对比C组为71.9% vs 67.6%;3级以上免疫介导的不良事件和输注反应,P+C组对比C组为7.0% vs 2.2%(图4)。
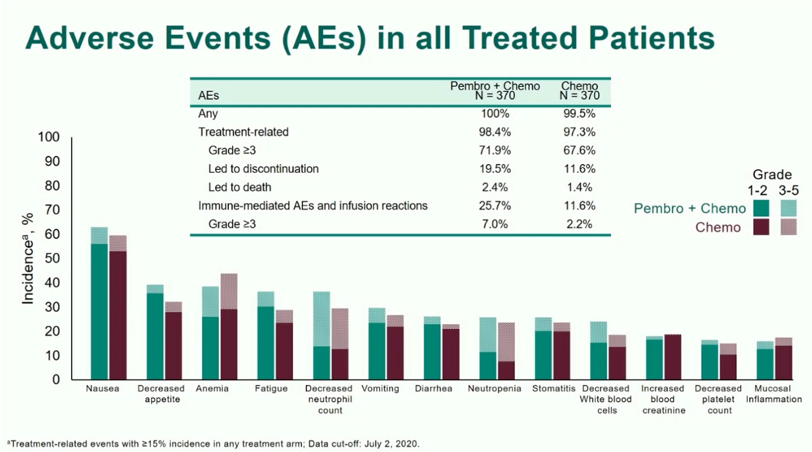
图4:不良反应
2 Keynote-590研究带来的启示
众所周知,我国是食管癌发病大国,90%左右为鳞癌,根据WHO实时数据,我国食管癌患病率和死亡率都排在全球第五位,新发患者和死亡患者都占全球的51%~55%左右。70%左右的食管鳞癌患者首诊即为晚期,丧失手术根治机会。近20年来,晚期食管鳞癌的一线治疗一直未有突破:患者常规接受顺铂为基础的联合化疗,中位无进展生存时间约4~6个月,中位生存时间仍约10个月左右,这远远不能满足目前的临床需求。
然而,免疫治疗,尤其PD-1单抗的应用使得晚期食管癌的治疗发生了翻天覆地的变化。去年Keynote-181,ATTRACTION-3,ESCORT三大临床研究刚刚确立了PD-1单抗在食管鳞癌二线治疗中的作用和地位,今天Keynote-590的发布就直接把化疗联合免疫治疗带进了晚期食管癌的一线治疗。显著的生存获益和良好的耐受性,迅速奠定了化疗联合免疫治疗在一线晚期食管癌治疗中的作用和地位。但鉴于食管鳞癌的高度异质性和地域差异,笔者认为针对我国晚期食管鳞癌患者,我们在实施一线治疗时应慎重解读。
2.1 Keynote-590研究的深入分析
(1)本研究入组患者同时包括食管鳞癌及腺癌(包括胃食管结合部腺癌),但这两个类型肿瘤有着截然不同的发病机制,分子分型,生物学行为及预后等特点。所以在解读该研究时,我们应理性看待其结果,重点深入分析鳞癌亚组的结果,来指导我国患者的治疗。
(2)另外还有一些问题需要进一步明确:比如鳞癌和腺癌患者中PD-L1的具体表达情况和疗效等;两组中帕博利珠单抗和化疗的具体暴露剂量等;不同病理类型中亚洲人群和欧美人群的具体疗效及PD-L1的表达等。这些数据将会对后续的临床实践和应用产生一定的影响。期待后续详细结果的发表和展示。
2.2 是否所有的食管癌患者均应接受一线化疗联合免疫治疗?
虽然,化疗联合免疫治疗在所有人群、ESCC和PD-L1 CPS≥10人群,均达到了研究终点。但笔者发现食管癌患者一线接受5-FU/顺铂联合免疫治疗的有效率仅为45%,这与既往一线化疗的疗效类似,这些均提示仍有很大一部分患者不能从化疗联合免疫治疗中获益,所以预测标志物的选择至关重要。
Keynote-181研究表明,PD-L1 CPS≥10的患者中,帕博利珠单抗与化疗相比显示出了明显生存优势,近期有效率达21.5%。本研究同样发现,PD-L1 CPS≥10的鳞癌患者接受化疗联合免疫治疗的HR明显低于全部人群,这提示PD-L1高表达的患者能从化疗联合免疫治疗中获得生存获益更多。然而在刚发表的针对我国食管癌一线替雷利珠单抗联合化疗的II期临床研究中,7名PR患者中,有3例PD-L1的表达<1%。笔者也在临床中看到PD-L1阴性患者接受化疗联合免疫治疗后,达到临床完全缓解,这均提示PD-L1低表达或不表达的食管癌患者同样可以从化疗联合免疫治疗中获益。因此,我们要谨慎看待PD-L1表达在食管癌联合免疫治疗的预测作用。
众所周知,化疗可以改变肿瘤的免疫微环境,那么针对PD-1单抗的标志物是否仍然可以预测化疗联合PD-1单抗的疗效呢?非小细胞肺癌的临床研究已经给了我们答案,肿瘤突变负荷(TMB)在肺癌的免疫单药中有一定的预测作用,但Keynote-189和Keynote-021研究均提示,TMB并非是化疗联合免疫治疗的良好标志物。所以笔者认为,未来我们需要深入探索不同化疗方案、剂量强度和联合模式等对食管癌免疫微环境的影响,只有正向的改变才有可能起到协同PD-1单抗的效应,才能真正延长患者的生存。而那些在化疗后发生正向免疫微环境改变患者群体的分子/临床特征,可能恰恰是化疗联合免疫治疗的潜在预测标志物。
2.3 一线联合化疗方案:氟尿嘧啶+顺铂 vs 紫杉醇+顺铂,孰优孰劣?
当前食管癌的标准一线化疗方案为铂类联合氟尿嘧啶或者紫杉醇,Keynote-590研究中的联合化疗方案是铂类+氟尿嘧啶,但我国食管癌患者更多的接受紫杉醇联合顺铂的治疗。虽然这两种方案对晚期食管癌患者的PFS和OS影响相似,但紫杉醇联合顺铂的近期有效率似乎更高(高出10%~20%左右),而这能否给患者带来更多的生存获益,目前尚不得而知。另外紫杉醇治疗前预处理的糖皮质激素是否会影响免疫治疗的疗效也存在一定的争议。
既往有限的研究发现,食管癌患者经过铂类药物联合紫衫醇化疗后,外周血TCR多样性增加,但也有报道发现紫杉醇联合顺铂可以降低食管癌中PD-L1的表达,所以PD-1单抗能否和化疗起到协同效应,需要我们深入了解化疗后食管癌微环境的变化,并据此进行严谨和精准的临床研究来进行探索和验证。因此,尽管Keynote-590获得成功,但它并不是一个终点,反而是全新的起点,如何优化联合化疗方案应该是未来进一步的研究方向,也期待多项针对我国晚期食管癌患者,PD-1单抗联合紫杉醇/顺铂一线治疗研究的结果。
2.4 食管腺癌是否同样可以从PD-1单抗联合化疗中获益?
Keynote-590研究显示,帕博利珠单抗联合化疗在全部人群和ESCC人群中均显示出明显的生存获益,然而食管腺癌是否也能从帕博利珠单抗联合化疗中获益?
亚组分析结果显示,虽然在PFS方面,食管腺癌患者能从帕博利珠单抗联合化疗中明显获益,但患者的OS延长并未显示出明显的统计学差异;同样,Keynote-181研究发现PD-L1 CPS≥10的食管鳞癌从帕博利珠单抗中获益明显,但在食管腺癌的获益并未得到广泛认可;另外,本研究中腺癌患者的比例仅26.5%~27.1%,样本量相对较小,所以笔者认为,帕博利珠单抗联合化疗在晚期食管腺癌和胃食管结合部腺癌中的作用尚需进一步研究来证实。
2.5 一线化疗联合免疫治疗仍需关注食管癌的地域差异
食管癌的地域差异非常显著,亚组分析结果显示亚洲食管癌患者从化疗联合免疫治疗中的获益明显优于非亚洲患者,这与Keynote-181中全人群的结果十分相似。
这可能与亚洲地区大部分食管癌病理类型为鳞癌相关;同时也可能与中国、日韩和欧美食管鳞癌在病因、分子病理学特征和免疫微环境等方面均存在明显的差异及不同的治疗反应性相关。期待该研究能针对我国、日韩和欧美等不同区域食管鳞癌中PD-L1等分子特征和免疫微环境进行探索,并结合疗效进行深入分析,这必将对未来食管癌一线精准联合免疫治疗的实施提供有力帮助。
总之,Keynote-590是本次ESMO大会食管癌治疗中最大的亮点,其研究结果证实了化疗联合免疫治疗在食管癌一线治疗中的地位,彻底打破了十几年没有进展的僵局,为晚期食管癌的治疗迎来了春天。后续很多针对我国食管鳞癌人群,一线化疗联合免疫治疗的研究将会陆续面世,这些结果必将改变目前的临床实践。该研究提示我们在设计临床试验时,需要考量食管癌的病理类型和地域差异,同时在化疗方案的优化、开发新型免疫药物、筛选联合免疫治疗获益人群等方面仍然需要做进一步的探索和研究,为晚期食管鳞癌患者的治疗带来了更多和更新的希望。
参考文献
1. Kato K, et al. Pembrolizumab Plus Chemotherapy Versus Chemotherapy as First-Line Therapy in Patients With Advanced Esophageal Cancer: The Phase 3 KEYNOTE-590 Study. ESMO abstract,2020.
2. Kojima T, et al. Pembrolizumab versus chemotherapy as second-line therapy for advanced esophageal cancer: Phase III KEYNOTE-181 study. 2019. 37(4_suppl): p. 2-2.
3. Bray F, et al. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin, 2018. 68(6):394-424.
4. Xu J, et al. Tislelizumab Plus Chemotherapy as First-line Treatment for Advanced Esophageal Squamous Cell Carcinoma and Gastric/Gastroesophageal Junction Adenocarcinoma. Clin Cancer Res. 2020.26(17):4542-4550.
5. Langer C, et al. OA04. 05 KEYNOTE-021: TMB and outcomes for carboplatin and pemetrexed with or without pembrolizumab for nonsquamous NSCLC. 2019. 14(10): p. S216.
6. Garassino M, et al. OA04. 06 Evaluation of TMB in KEYNOTE-189: pembrolizumab plus chemotherapy vs placebo plus chemotherapy for nonsquamous NSCLC. 2019. 14(10): p. S216-S217.
7. Sun S, et al. Phase II Study of S-1 plus Cisplatin as First-Line Therapy in Patients with Metastatic Esophageal Carcinoma. Oncol Res Treat. 2019;42(3):115-122.
8. Zhang C, et al. Immediate and substantial evolution of T cell repertoire in peripheral blood and tumor microenvironment of patients with esophageal squamous cell carcinoma treated with preoperative chemotherapy. Carcinogenesis. 2018.39(11):1389-1398.
9. Lim SH, et al. Changes in tumour expression of programmed death-ligand 1 after neoadjuvant concurrent chemoradiotherapy in patients with squamous oesophageal cancer. Eur J Cancer. 2016;52:1-9.
10. Deng J, et al. Comparative genomic analysis of esophageal squamous cell carcinoma between Asian and Caucasian patient populations. Nat Commun. 2017; 8(1):1533.