盛锡楠教授解读:上尿路尿路上皮癌研究进展
上尿路尿路上皮癌(UTUC)约占尿路上皮癌(UC)的5%-10%,但60%的UTUC初诊时即为侵袭性,相较而言,来源于下尿路的膀胱尿路上皮癌(UBC)的初诊时侵袭性疾病比例只有15-25% 1;因此UTUC比下尿路尿路上皮癌(LTUC)带来了更大的临床危害。而且,流行病学显示以中国为代表的亚洲人群UTUC发病率明显高于西方人群2 ,近年中国晚期尿路上皮癌临床研究发现来源于UTUC的病例接近一半。因此,国内对于UTUC的诊治更为关注。以下就将来自今年ASCO-GU大会的UTUC研究进展做出梳理并呈现给读者:
一、UTUC围手术期研究进展
1.术后辅助治疗何去何从
POUT研究更新数据是唯一一个进入到今年ASCO-GU大会Poster Highlight session并进行讨论的UTUC研究。2018年首次报道的POUT研究掀起了UTUC术后辅助化疗的新篇章。当时研究将56个中心261例 pT2-4N0-3M0分期的UTUC术后患者随机分配至辅助化疗组和观察组。辅助化疗方案包括:GP方案(要求eGFR>50ml/min)或GC方案(eGFR:30-49ml/min)术后辅助化疗4周期。
结果显示,与观察组相比,辅助化疗组显著改善无病生存时间(DFS)和无转移生存(MFS)时间,当时的总生存(OS)数据尚不成熟,但HR为0.55,有利于辅助化疗组。POUT研究是当时UTUC唯一的III期临床研究,循证医学证据级别较强,研究结果基本确定了UTUC术后辅助化疗的地位。

研究设计
但随后对于POUT研究的质疑声也开始出现,包括:1、认为根治性肾输尿管全长切除术(RNU)后肾功能的改变,可能影响术后化疗方案的选择,从而把新辅助化疗(此时的肾功能储备良好)推到UTUC治疗前沿;2、POUT研究的亚组人群获益不一致(N+或切缘+患者未明确获益);3、既往研究(EORTC 30994)3显示术后辅助化疗相比于延迟(至复发时)化疗并未显著改善OS。
伴随着质疑声,今年的ASCO-GU报道了POUT研究经过中位随访49.2个月的更新数据,其中两组DFS比较的HR值为0.51(95%CI:0.35-0.76;p = 0.0006),MFS比较的HR值为0.52(95%CI:0.36-0.77;p = 0.0007)。辅助化疗组与观察组的3年OS率分别为79%(95%CI:71%-86%)和67%(95%CI:58%-75%),而5年OS率分别为65%(95%CI:54%-74%)和57%(95%CI:46%-66%)。辅助化疗组死亡风险较观察组降低了30%,但统计学上无差异(HR = 0.70,95%CI:0.46-1.06;p = 0.09)。
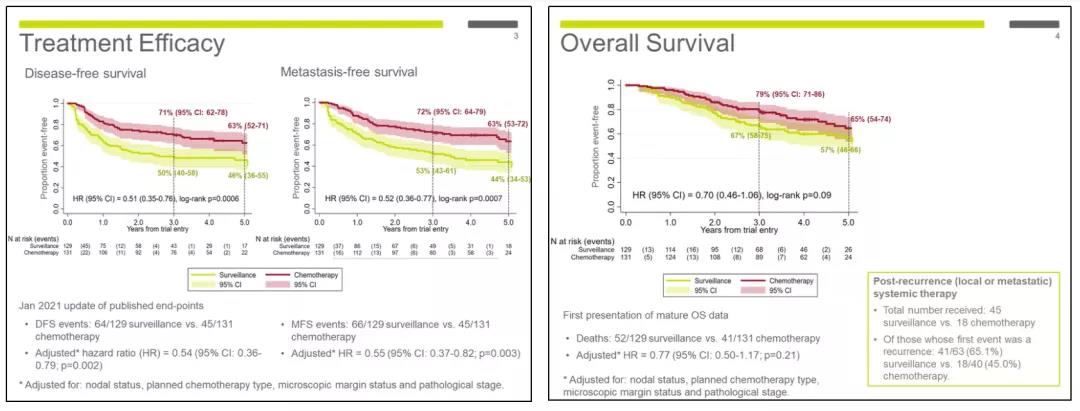
疗效数据
这项更新数据维持了2018年报道的UTUC患者从术后辅助化疗中获得DFS和MFS获益的结果,但最终未获得统计学上的OS获益。对于辅助化疗未取得显著OS获益的问题,作者在大会报告时解释到:
该研究预设的样本量原本是345例,但主要研究终点是DFS,而DFS在入组261例患者时已经达到统计学差异,从而被孤立数据监督委员会提前停止入组。因此作者认为261例这样的样本量可以达到DFS差异,但想要达到OS统计学差异是不够的;
相比于辅助化疗组,观察组中有更高比例(65.1% vs. 45.0%)的患者在疾病复发时接受了系统性治疗,而在如今新型免疫治疗的大背景中,系统性治疗的比例高可能意味着更好的生存,从而对POUT研究的OS结果产生了很大的影响。
作者这样的解释貌似是合理的,但这对于之前的“亚组人群获益不一致、术后肾功能影响化疗选择、以及新辅助化疗是否更加适合”等方面的质疑仍然没有给出合理的解答。因此,UTUC辅助治疗是否参照POUT研究结果去选择,可能会是一个见仁见智的问题。
2.术前诊断性检查的利与弊
输尿管镜检查(URS)的可视性为探查完整的上尿路提供了可行性,并降低了误诊率,URS检查所提供的信息还能够辅助UTUC危险分层,但URS操作给UTUC患者带来的潜在肿瘤播散导致膀胱内复发的风险也被大家所关注 4。有Meta分析显示:在RNU前接受诊断性URS与术后膀胱内复发有关。
今年ASCO-GU上,来自美国MD Anderson癌症中心的研究进一步评估了术前诊断方式对于UTUC术后膀胱内复发风险的影响。研究纳入1995-2019年单中心的接受RNU患者共878例,并分成四组,主要研究终点为比较四组RNU术后膀胱内复发率,具体如下:
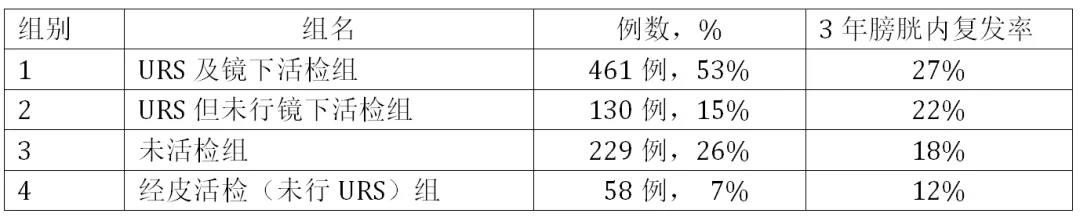
单因素分析显示年龄、女性、膀胱癌病史、当前吸烟状态、以及原发灶为多灶病变这些因素与膀胱内复发有关。多因素分析则进一步明确:与未活检组相比,URS及镜下活检组的膀胱内复发的风险增高(HR=1.41,p=0.03)。与URS但未行镜下活检组(HR=1.18,p=0.45)以及经皮活检组(HR=1.11,p=0.79)比较,URS及镜下活检组的膀胱内复发风险则未见明显差异。
该研究结果从表面上看,不论是否活检,只要做了URS(组1和组2)似乎其膀胱内复发率就更高;但是从多因素分析结果来看,除非不做术前活检,那么术后膀胱复发的风险降低;只要做了术前活检,不论是经皮活检还是URS活检,其术后膀胱复发风险相似。由此看来,虽然研究结果显示了URS加活检所致的膀胱复发风险,但同时由于URS提供的重要镜下肿瘤信息,因此作者实际上也否定了经皮活检等其它活检方式。看来今后的很长的一段时间,对于术前诊断性操作的争议还将继续下去。
二、晚期UTUC的免疫治疗研究进展
尽管现在认为上尿路和下尿路尿路上皮癌在起源、生物学行为、复发转移特点、化疗敏感性、分子改变等方面有诸多差异,甚至认为这是两种不同的疾病。但是两者在治疗上目前并没有明显的选择差异。UTUC的治疗主要还是参照LTUC的模式,传统化疗仍然是临床实践中的主要选择。近年来,免疫检查点抑制剂(ICI)在UC中的应用逐渐深入。但涉及ICI的大型临床研究纳入的患者基本也是以LTUC居多,UTUC对于ICI治疗是否同样有效,目前并不确定。今年关于UTUC免疫治疗研究进展主要体现在以下两个方面:
1.分子检测手段辅助下的UTUC基础研究不断深入
既往利用肿瘤组织大体标本的分子谱系研究曾显示,UTUC主要被归类于lunimal亚型和T细胞耗竭亚型,FGFR3的突变被认为与UTUC的T细胞耗竭表型有很大的关系5。这也提示UTUC可能对免疫治疗并不敏感,而以FGFR为代表的靶点抑制剂则有可能具有一定的治疗优势。
根据今年ASCO-GU的报道,来自美国MSKCC的研究者们采用有别于肿瘤大体标本检测的单细胞RNA测序(scRNA-seq)技术来分析UTUC的肿瘤免疫微环境(TME)。他们发现正如之前研究结果一样,他们检测的所有UTUC样本中无一例外的也表达了luminal基因表型,其中高级别UTUC样本中有更高的鳞状标志物表达,但同时也在高级别UTUC的TME中看到了显著的巨噬细胞浸润,表明UTUC的肿瘤免疫微环境具有显著的异质性,这种异质性提示我们,高级别UTUC仍然有可能从免疫治疗当中获益。
无独有偶,今年ASCO-GU报道中,另有研究者通过二代测序(NGS)和全外显子测序(WES)来分析UTUC样本,并通过免疫组化(IHC)、片段分析和NGS技术来检测错配修复状态(dMMR或pMMR)以及微卫星不稳定性(MSI-H或MSS)。PD-L1表达通过IHC法检测22c3的PD-L1抗体(CPS的cutoff值≥10)和SP142的PD-L1抗体(IC的cutoff值≥5%)。TMB以10muts/MB作为cutoff值,≥10定义为TMB-high。
该研究一共分析了538个UTUC样本,其中dMMR/MSI-H占比3.9%,TMB-high占比22.7%。22c3和SP142抗体检测所示的PD-L1阳性表达率分别为33.2%和28.4%。
与MSS肿瘤相比,dMMR/MSI-H肿瘤中TMB-high比例明显更高(100% vs. 19%;p = 0.0003),而且dMMR/MSI-H肿瘤中染色质重塑(chromatin remodeling)相关基因(ASXL 82.4%、CREBBP 60%、SMARCA4 40%、KMT2D 95%、ARIDIA 100%、KMT2A 20%、KMT2C 35.3%、NSD1 20%)、DNA损伤修复基因(FANCG 10%, ATM 45%, ATRX 40%)以及其它生物信号通路基因(RNF43 10%, PTCH1 21.4%, ERBB3 30%, CDKN2A 25%, TSC2 15%, FLNC 15%, HNF1A 20%, CIC 15%, DNMT3A 17.6%)的突变比例也明显更高(p值均 < 0.05),但dMMR/MSI-H和MSS肿瘤中的PD-L1阳性表达率没有差异。研究还检测到3.8%的UTUC样本存在病理性基因融合突变,其中以FGFR3融合突变最为常见(占2.7%)。另外,研究并未发现原发灶和转移灶之间以及男女性之间存在显著的分子差异。
该研究应该是迄今为止针对UTUC的最大一项分子检测研究,从结果看,UTUC的TMB-high比例比较高,这也基本符合之前的UC相关文献结果。该研究主要关注的MSI-H,其占比只有3.9%,似乎并不能给UTUC基于分子表达的治疗提供什么帮助,但还是可以看到,所有MSI-H的UTUC都具有高水平的TMB,结合帕博利珠单抗对于MSI-H的泛瘤种适应症以及上面提到的来自MSKCC的scRNA-seq研究结果,这些都给UTUC接受以PD-1单抗为代表的免疫治疗提供了理论基础。此外,FGFR3融合突变、MSI-H的UTUC含有的这些高突变比例的染色质重塑基因和DNA损伤修复基因等则有可能为今后的靶向药物治疗提供潜在的治疗靶点。
2.晚期UTUC基于分子基础的免疫治疗方兴未艾
基础研究的背景最终还是要在临床实践中得以验证。巧合的是,今年ASCO-GU上另一个团队公布了一个小样本的临床回顾性研究,专门分析了dMMR/MSI的UTUC患者应用ICI的治疗结果。该研究仅纳入了10例不可切除的局部晚期以及转移性UTUC患者,所有患者均经IHC检测为dMMR(7例)或经PCR检测为MSI状态(3例),并接受了ICI治疗(包括帕博利珠单抗、纳武利尤单抗和阿替利珠单抗),其中有一半患者既往接受过系统化疗。在中位随访15.5个月(2个月-43个月)时,所有患者均存活并且维持未进展状态。总缓解率(ORR)为90%(95%CI:55.5%-99.8%),其中包括8例完全缓解(CR)。该研究虽然病例数少且为回顾性研究,但优秀的临床缓解率和生存数据仍让人眼前一亮。针对dMMR/MSI这一特殊患者人群,有必要进行扩大样本量的免疫治疗临床研究。
除去具有特殊分子表达的患者人群,今年还有一项大样本的回顾性研究从总体层面对UTUC与LTUC的ICI疗效进行了分析。该研究纳入了2013-2020年来自美国和欧洲24个中心的746例晚期UC患者接受ICI治疗的数据,其中包含UTUC患者130例(17.4%)、LTUC患者616例(82.6%)。两组患者的中位年龄分别为71岁(40-92岁)和70岁(31-93岁)、男性占比分别为62%和76%、未吸烟比例分别为41%和29%、既往原发灶根治术比例分别为62%和52%、肝转移比例为29%和18%。该研究对比了UTUC和LTUC经ICI治疗后的结局,包括ORR、中位无进展生存时间(PFS)和中位OS,如下图所示:
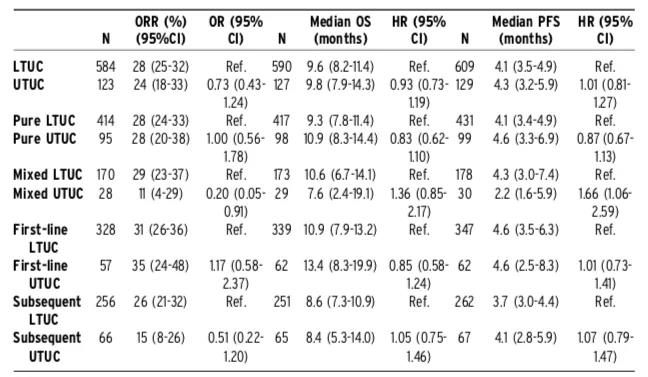
从结果看,UTUC和LTUC在总体ORR(24% vs. 28%)、中位PFS(4.3个月 vs. 4.1个月)和中位OS(9.8个月 vs. 9.6个月)数据方面几乎一致。但是在混杂其他组织学成分的UC亚组中,UTUC的ORR(11% vs. 29%;OR = 0.20 [0.05-0.91])和中位PFS(2.2个月 vs. 4.3个月;HR = 1.66 [1.06-1.13])明显不及LTUC,但在中位OS(10.6个月 vs. 7.6个月;HR = 1.36 [0.85-2.17])上与LTUC无显著差异。无论ICI作为一线治疗还是后续治疗,UTUC和LTUC的疗效并无显著性差异。
该研究表明UTUC患者使用免疫治疗同样有效,但同时也应该看到研究存在的问题。比如,国内我们中心的一项涉及250例UTUC的回顾性研究结果表明6:晚期UTUC患者基线PS状态、LDH水平、转移器官数、既往一线化疗疗效和周期数(均为孤立预后因素)都会影响OS时间。而今年ASCO-GU的这项研究在患者基线特征包括肾功能状态、PS状态、转移器官数以及二线治疗患者既往一线化疗疗效及化疗周期数等方面的资料提供并不全面,对研究结果的判读产生了影响,因此其临床指导意义存在疑义。不过该研究结果还是给UTUC患者临床使用ICI治疗提供了一些依据。而对于混杂其它组织学成分的UTUC,ICI治疗的效果差强人意,可能还是需要根据具体的组织学分化类型选择合适的化疗药物或者进行免疫化疗联合的尝试。
三、小结与展望
从以上研究内容可以看到,在多年前的研究热点集中在分析UTUC与LTUC之间的临床特点差异之后,最近的国外研究已经开始将触角伸至UTUC免疫治疗领域,下一步可能通过相关分子研究来分析免疫联合治疗和精准治疗的可能性,包括疗效预测和免疫治疗潜在获益人群的筛选等。而相比于西方国家UTUC发病率较低的现状,作为UTUC发病率更高的亚洲国家,我们在UTUC基础和临床领域的研究则显得更加任重而道远。
参考文献:
1. Rouprêt M BM, Burger M, et al: EAU Guidelines on Upper Urinary Tract Urothelial Cell Carcinoma. . Uroweb 2019. Available at: https://uroweb.org/wp-content/uploads/EAU-Guidelines-on-Upper-urinary-Tract-Tumours-2019.pdf . Accessed Feburary 2021.
2. Chen XP, Xiong GY, Li XS, et al: Predictive factors for worse pathological outcomes of upper tract urothelial carcinoma: experience from a nationwide high-volume centre in China. BJU Int 112:917-24, 2013
3. Sternberg CN, Skoneczna I, Kerst JM, et al: Immediate versus deferred chemotherapy after radical cystectomy in patients with pT3-pT4 or N+ M0 urothelial carcinoma of the bladder(EORTC 30994): an intergroup, open-label, randomised phase 3 trial. Lancet Oncol 16:76-86, 2015
4. Soria F, Shariat SF, Lerner SP, et al: Epidemiology, diagnosis, preoperative evaluation and prognostic assessment of upper-tract urothelial carcinoma(UTUC). World J Urol 35:379-387, 2017
5. Robinson BD, Vlachostergios PJ, Bhinder B, et al: Upper tract urothelial carcinoma has a luminal-papillary T-cell depleted contexture and activated FGFR3 signaling. Nat Commun 10:2977, 2019
6. Li X, Li S, Chi Z, et al: Clinicopathological characteristics, prognosis, and chemosensitivity in patients with metastatic upper tract urothelial carcinoma. Urol Oncol 39:75 e1-75 e8, 2021