Ⅰb 期/G1 子宫内膜样癌,分子分型能指导术后辅助治疗吗?
目前,多数指南主要根据不同的风险分层,推荐子宫内膜样癌术后的辅助治疗策略。近年来,子宫内膜样癌的分子分型是研究的热点,主要目的是为了更加精准地管理不同生物学行为的患者。
2021 年初正式发表的欧洲妇科肿瘤学会(ESGO)/欧洲放射治疗及肿瘤学会(ESTRO)/欧洲内科肿瘤学会(ESP)子宫内膜癌管理指南,是迄今为止唯一一个阐述子宫内膜癌分子分型如何指导临床实践的指南。
本文主要依据该指南并参考其他权威指南,结合具体病例,介绍中危或中风险(low risk)患者术后管理的相关内容。
病例介绍
患者 58 ,已绝经 6+年,近一个月出现少许阴道出血,鲜红色,无其他不适。孕 3 产 2。否认糖尿病、高血压史。体重 39 Kg。
肿瘤标志物:CA-125,35.85U/mL;人附睾蛋白 4,111.60pmol/L;癌胚抗原,2.32ng/mL。
全腹 CT:提示子宫内膜增厚,注意子宫内膜癌可能,建议进一步检查。
超声:子宫前位,切面大小 5.2×3.8×5.6 cm,形态正常,肌层回声不均匀,右侧壁内见一大小约 2.8×3.3 cm 低回声光团,边界清,呈类圆形,内回声欠均匀;宫内膜厚 1.4 cm。另宫腔内见一大小约 1.0×0.8 cm 稍强回声光团,边界清,内回声欠均匀。双侧附件区未见明显异常回声。
分段诊刮病理:(宫腔刮出物)子宫内膜样腺癌;(颈管刮出物)可见癌。
手术:腹腔镜子宫、双附件切除术加盆腔淋巴结切除术。剖视标本:可见子宫灰白色菜花样病灶,直径约 3 cm 病灶,侵犯浅肌层,双侧附件未见异常。
病理:(腹腔冲洗液)未见癌细胞。子宫内膜样腺癌,Ⅰ级。肿瘤最大径约 3.5 cm;浸润深度约 0.6 cm(大于 1/2 肌层);未见脉管癌栓;双侧宫角可见癌。淋巴结未见癌。
临床问题
下一步该如何处理?有医生建议基因检测,应该做哪些项目?对后续治疗有什么指导意义?
1
本例患者有没有必要进行基因分型呢?
根据 ESGO/ESTRO/ESP 子宫内膜癌管理指南—2021建议,所有子宫内膜癌均提倡分子分型,特别是高级别肿瘤(IV,B,即 IV 级证据,B 级推荐);POLE 突变分析在低风险和中风险低级别组织学的子宫内膜癌中可以省却(IV,C,即 IV 级证据,C 级推荐)。
从传统病理学看,本例属于高分化子宫内膜样癌,浸润深肌层,因此,不见得是一定要做分子分型。
2
中风险的患者术后该怎么办?
大量证据表明,国际妇科病理学会(ISGyP)指南推荐的传统病理特征,如组织病理类型、分级、子宫肌层浸润和淋巴脉管间隙浸润(LVSI),对评估预后很重要。
组织病理分型应依据 WHO 肿瘤分类(第 5 版)进行,在这一版中提出子宫内膜癌整合诊断的概念,即分子分型与传统病理相结合的诊断。
分化程度建议采用国际妇产科学联盟(FIGO)的双级分级,1 级和 2 级癌考虑为低级别,3 级癌为高级别。在评估子宫肌层浸润时,需要考虑波动起伏的内膜-子宫肌层连接处。
局灶性 LVSI 的定义是肿瘤周围存在一个病灶,实质性或大量的 LVSI 为多灶性或弥漫性排列,或肿瘤细胞存在于五个或五个以上的淋巴脉管腔内。
分子分类为常规形态学特征增添另一层信息,应纳入病理报告中。
根据整合分子标志物的预后风险组(prognostic risk group)定义,将术后子宫内膜癌患者分为低风险、中风险、高-中风险、高风险和晚期或转移五个不同的预后风险组类别。而每个类别,再根据分子分型是已知还是未知两种情况进一步细分。
中风险是指:
分子分型未知时的 IB 期低级别(组织学分化 1 或 2 级)以及 LVSI 阴性或局灶性子宫内膜样癌、IA 高级别(组织学分化 3 级)与 LVSI 阴性或局灶性子宫内膜样癌和不伴有肌层浸润的 IA 期非子宫内膜样癌(浆液性、透明细胞、未分化癌、癌肉瘤、混合型);
或者,分子分型已知时的 MMRd/NSMP IB 期低级别(组织学分化 1 或 2 级)以及 LVSI 阴性或局灶性子宫内膜样癌、MMRd/NSMP IA 期高级别(组织学分化 3 级)与 LVSI 阴性或局灶性子宫内膜样癌以及不伴有肌层浸润的 IA 期 p53abn 和/或非子宫内膜样癌(浆液性、透明细胞、未分化癌、癌肉瘤、混合型)。
在这一中风险人群中,大量随机试验,特别是 PORTEC-2 试验和 Swedish 试验显示,辅助近距离放疗带来极好的阴道控制和高生存率,与辅助 EBRT(外照射)之后的患者相似。
研究还表明,只有少数基于广泛性 LVSI、p53abn 或 L1CAM 过度表达的更高风险患者阴道近距离放疗后盆腔复发的风险略高于接受 EBRT 患者。
因此,中风险类别仅包括无或仅有局灶性 LVSI 且无 p53abn 的患者。在丹麦的一项人群研究中证实,在不进行阴道近距离放疗的情况下,局部复发的风险更高(约为 14%),但由于复发得以治疗,总生存率并无差别。
因此,在这一组中,无辅助治疗是选择之一,特别是对于年龄小于 60 岁复发风险较低的患者。
MMRd 以及尤其是 NSMP 癌构成子宫内膜样癌的大部分,预后居中,介于 POLEmut(预后良好)和 p53abn(预后不良)之间。因此,以往关于高-中风险子宫内膜癌的大型随机试验结果主要适用于 MMRd 和 NSMP 子宫内膜样癌的中风险类别。
需要强调的是,局限于息肉或无子宫肌层浸润的 p53abn 癌并未纳入随机试验之中,化疗和 EBRT 的价值尚不确定。
由于上述研究不包括和/或者没有针对无子宫肌层浸润的非子宫内膜样癌(和/或 p53abn),对于无子宫肌层浸润的 IA 期非子宫内膜样癌(浆液性、透明细胞性、未分化癌、癌肉瘤、混合型)的最佳治疗,具体可用数据非常少。
一些病例系列和最近使用美国国家癌症数据库的分析表明辅助化疗(用或不用阴道近距离放疗)可能提高生存率,而其他报告显示仅用阴道近距离放疗效果良好。
因此,这些癌已被划分为中风险类别,在获得更多的前瞻性数据之前,应逐个病例讨论辅助治疗。
因此,
建议可推荐辅助近距离放疗以减少阴道复发(I,A,即 I 级证据,A 级推荐);
可考虑不做辅助近距离放疗(III,C,即 III 级证据,C 级推荐),特别是年龄 <60 岁的患者(II,A,即 II 级证据,A 级推荐);
当已知分子分类时,POLEmut 和 p53abn 伴子宫肌层浸润有具体的建议(分别参见低风险和高风险建议);
对于局限于息肉或无子宫肌层浸润的 p53abn 癌,一般不推荐辅助治疗(III,C,即 III 级证据,C 级推荐)。
3
本例患者的管理建议
假如不做基因检测,做或不做阴道近距离放疗均是可以的。
假如接受基因检测,明确了分子分型,其处理可作如下考量。
诊断为 POLE 突变的 IB 期低级别子宫内膜样癌,处理参照低风险预后组,对于低风险子宫内膜癌患者,不推荐辅助治疗(I,A,即 I 级证据,A 级推荐)。
诊断为 MMRd/NSMP 的 IB 期低级别子宫内膜样癌,辅助近距离放疗(I,A,即 I 级证据,A 级推荐);因年龄不足 60 ,可考虑不做辅助近距离放疗(II,A,即 II 级证据,A 级推荐)。
诊断为 p53abn 的 IB 期低级别子宫内膜样癌,因为是分子分型为 p53abn,属于高风险预后组,其处理建议是推荐 EBRT 同时和辅助化疗(I,A,即 I 级证据,A 级推荐)或交替序贯化疗和放疗(I,B,即 I 级证据,B 级推荐);而单独化疗是另一种选择(I,B,即 I 级证据,B 级推荐)。
笔者以为,有了分子分型,术后如何合理管理更有底气。
NCCN 宫体肿瘤 V1.2021
NCCN 指南,对危险因素的定义,似乎总是在微调之中,最新版的指南潜在的危险因素包括:≥ 60 岁、浸润深度和/或 LVSI。注意不再提及肿瘤大小,肿瘤大于 2 cm 曾一度认为是危险因素。分期手术之后的 FIGO 为 I 期的子宫内膜样癌的辅助治疗指南,是以表格的形式展现的。
自 V2.2020 版开始,又变复杂了。笔者觉得,翻来覆去,改来改去,无非是想避免不足,杜绝过度。
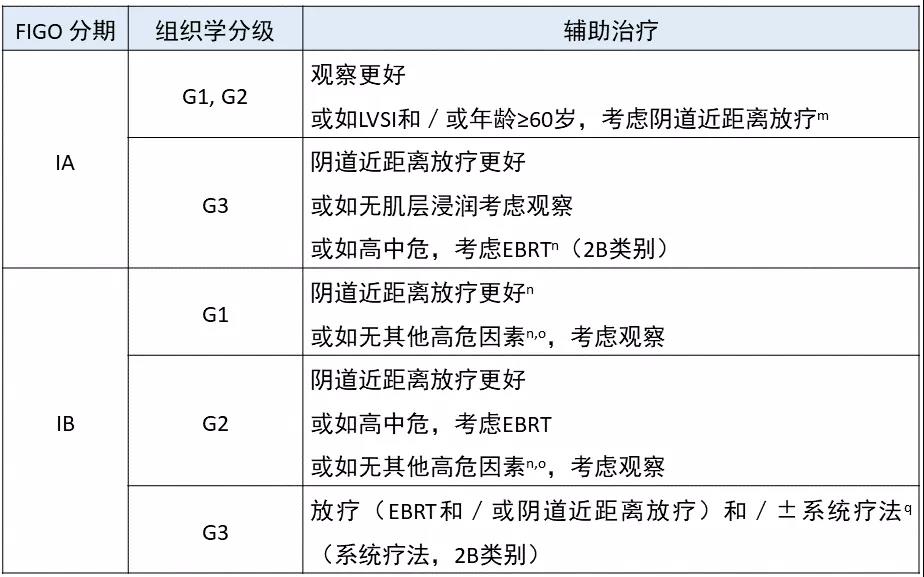
表 NCCN 子宫内膜样癌 I 期辅助治疗
EBRT 指外照射放疗。表格貌似复杂,但如果不是很想刨根问底,本例患者的处理,不是很难找到照本宣科的答案。
对 I 期子宫内膜样癌而言,化疗只是在一种情况下,可能考虑使用,NCCN 专家组成员依然认为大多数情况下化疗并没有可靠的证据。
众所周知,正是因为 NCCN 指南的推荐,大家逐渐熟知,子宫内膜癌的分子分型;正是因为指南列入分子分型诊断算法,分子分型这把火才越烧越旺。然而,迄今为止,NCCN 指南却未曾给出指导临床的任何指引,是为憾。
如参考 NCCN 指南,患者可以考虑接受阴道近距离放疗;因为无其他危险因素,如 LVSI 超龄等,可以观察。
子宫内膜癌手术后放射治疗的作用:美国放射肿瘤学会(ASTRO)循证指南--2014
相比于低危患者,中危子宫内膜癌患者的阴道复发风险更高,更有可能从阴道断端近距离放疗中获益。
采用不同的定义对中危子宫内膜癌进行分类,通常包括伴有以下危险因素的 I 或 II 期患者:深肌层浸润、更高级别、LVSI 和/或年纪大。
子宫内膜癌术后放疗(PORTEC)和妇科肿瘤学组(GOG)的研究纳入了「中危」患者,并对这些患者中复发风险更高的亚组进行定义,称为「高-中危」。
对存在这些危险因素的患者,阴道断端近距离放疗比盆腔放疗更好,尤其是对那些已经接受全面淋巴结评估的患者(证据等级:强烈建议,低质量证据)。
简言之,ASTRO 对本例患者推荐阴道断端近距离放疗。
FIGO 癌症报告 2018--子宫体癌
辅助放疗不推荐使用于低危患者,而有指征用于高危患者。特别是分化 1–2 级且肌层浸润不超过 50% 的患者,或者只有单一危险因素的患者,不推荐辅助放疗。
对于存在高/中危险因素(至少 2 个危险因素:年龄 >60 岁、深肌层浸润、组织学 3 级、浆液性或透明细胞组织学类型、LVSI)的患者,单独阴道近距离放疗优于 EBRT,有极好的阴道控制率,而不影响生活质量。
存在高危因素(分化 3 级和深肌层浸润和/或 LVSI、不良组织学类型、不良分子因素) 的Ⅰ-Ⅱ期患者中,盆腔 EBRT 仍然是标准治疗。
虽然指南的表述比较粗犷,但慢慢琢磨,本例患者是可以观察的。
总之,没有分子分型,本例患者可行阴道近距离放疗,也可以观察。明确了分子分型,预后佳或中等分型者,可观察,阴道近距离放疗亦可;预后差的分子分型,其后续治疗要放疗与化疗相结合,基于 GOG0258 研究也可选择单纯化疗。
笔者认为,倘若化疗,不论是联合,还是单用,不宜用那些来历不明的方案。需要选择经过临床研究验证的药物。
4
为了分子分型的基因检测,应该包括哪些内容呢?
不否认子宫内膜癌分子分型的重要性,不否认为明确分型所实施的相关检测有其特定的作用。注意,相关就不是大包围,就不是花大价钱。
围绕分子分型,基因检测到底该怎么做?
2020 版的 NCCN 指南列了明晰的指引,可不是什么大 panel。细读 ESGO/ESTRO/ESP 子宫内膜癌管理指南—2021,不难发现,人家对检测的谨慎,甚至会让人觉得「抠门」。
可能有人会说,那说明他们没有闯劲。然而,千万别忘了,子宫内膜癌分子分型走到今日,谁会否认是缘起于美国的 TCGA,替代标志物的优化是因为欧洲与加拿大两个机构卓越的工作呢?
此外,该测时,还必须擦亮眼睛看清楚哪家检测稍微靠谱。其实,笔者也闹不清谁家更靠谱。好在用于子宫内膜癌分子分型算法的复杂性远不及 HRD,对否?或许,哪家都比较容易做到靠谱;或许,这只是不谙熟分型算法奥妙的门外汉随口一说罢了。