选择性BCL-2抑制剂S65487/VOB560对野生型和临床突变导致的Venetoclax耐药是否有效?
美国癌症研究协会(American Association for Cancer Research, AACR)2021年年会日前(4月10日~15日)在线上举行。来自世界各地的研究机构和医学界优秀学者们在会议上展示了癌症领域的最新发现及研究成果。BCL-2抑制剂作为癌症治疗的热门药物,其研究进展值得关注。来自法国的Tiran AL团队对一种具有白血病治疗前景的选择性BCL-2抑制剂——S65487/VOB560进行了描述。
背景
凋亡逃逸是肿瘤发生发展的关键。B细胞淋巴瘤2(BCL-2)基因家族编码促凋亡和抗凋亡的蛋白。BCL-2的过表达是导致多种癌症(包括淋巴瘤和白血病)发生和耐药的一个成熟机制。
BCL-2家族蛋白是线粒体凋亡途径的重要调节因子,并根据功能差异分为3组:① 促生存蛋白(BCL-2,BCL-XL,BCL-W和BFL-1);② 多BH结构域-细胞死亡效应蛋白(BAX,BAK,BOK);③ 仅含BH3-凋亡抑制蛋白(如BIM,BAD,NOXA)。
促生存BCL-2成员通过与促凋亡分子的BH3结构域结合以隔离它们从而发挥作用。抑制这一细胞内蛋白间的相互作用成为针对BCL-2家族功能障碍导致的癌细胞生存异常的热门治疗方案[1]。
在不断的新药研发过程中,首个BCL-2抑制剂(也称为BH3类似物)Venetoclax/ABT-199应运而生。Venetoclax是一种口服活性BCL-2选择性抑制剂[2,3],被批准用于高风险的复发或难治性慢性淋巴细胞白血病(CLL)和急性髓系白血病(AML)。
本文介绍了一种新的强效选择性BCL-2抑制剂——S65487/VOB560,并与ABT-199进行了比较。
S65487/VOB560是一种选择性强BCL-2抑制剂
S65487/VOB560(化学结构见图1)是一种通过静脉给药的新型活性BCL-2特异性抑制剂;选择性分析表明,S65487/VOB560与MCL-1、BFL-1缺乏明显的结合,与BCL-XL的亲和力也较差(表1)。
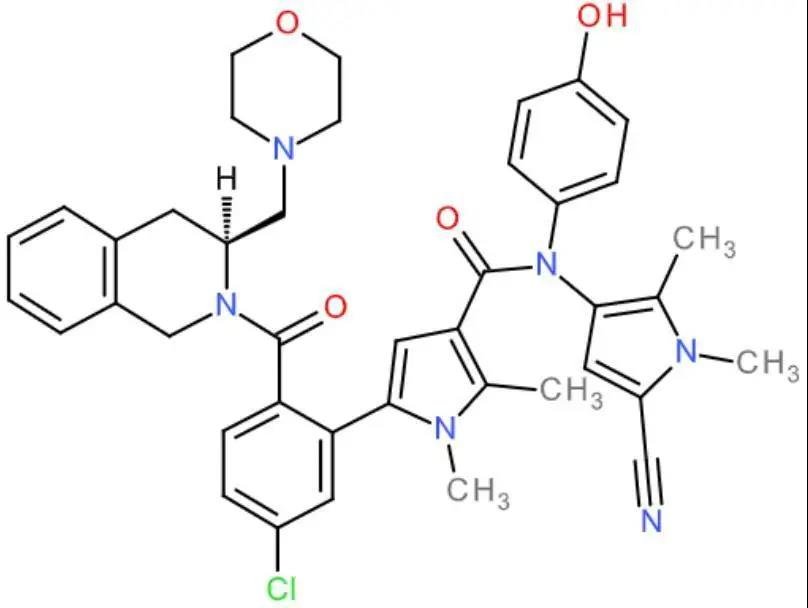
图1.S65487/VOB560的化学结构
表1. S65487/VOB560相关的亲和力及选择性数据
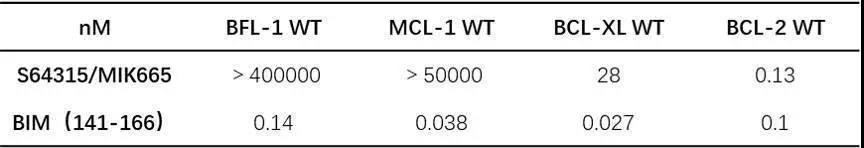
注:cKi通过Quench实验检测
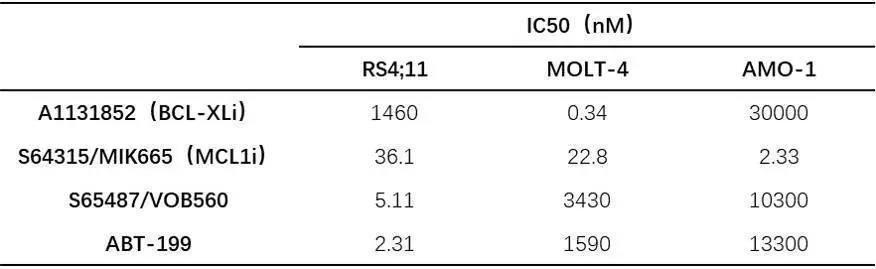
与ABT-199相比,S65487/VOB560具有部分重叠但明显不同的BCL-2疏水性凹槽结合模式,能够在IC50处于较低nM范围时抑制细胞增生(图2和表2);并且表现出BCL-2特异性BH3类似物的所有特点。
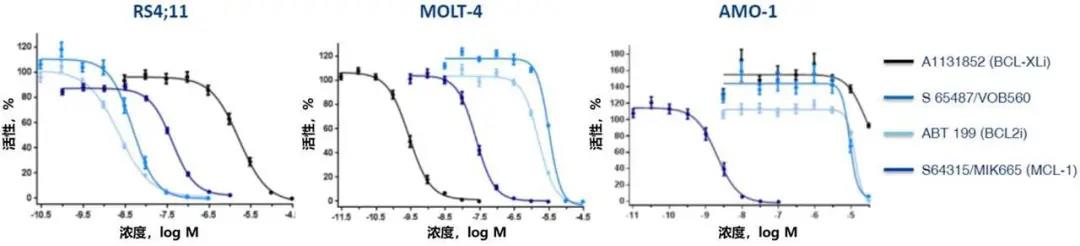
图2. 在细胞系中通过72h细胞活性实验评估S65487的效力和选择性。S64315/MIK665:MCL-1抑制剂[4];A1131852:BCL-XL抑制剂[5]
表2. 不同药物的半抑制浓度
S65487/VOB560的抗血液肿瘤活性
S65487/VOB560以BAX/BAK依赖的方式诱导凋亡
在“BCL-2依赖性RS4;11异种移植肿瘤模型”体内,单次静脉给予S65487/VOB560可诱导完全缓解(图3)。
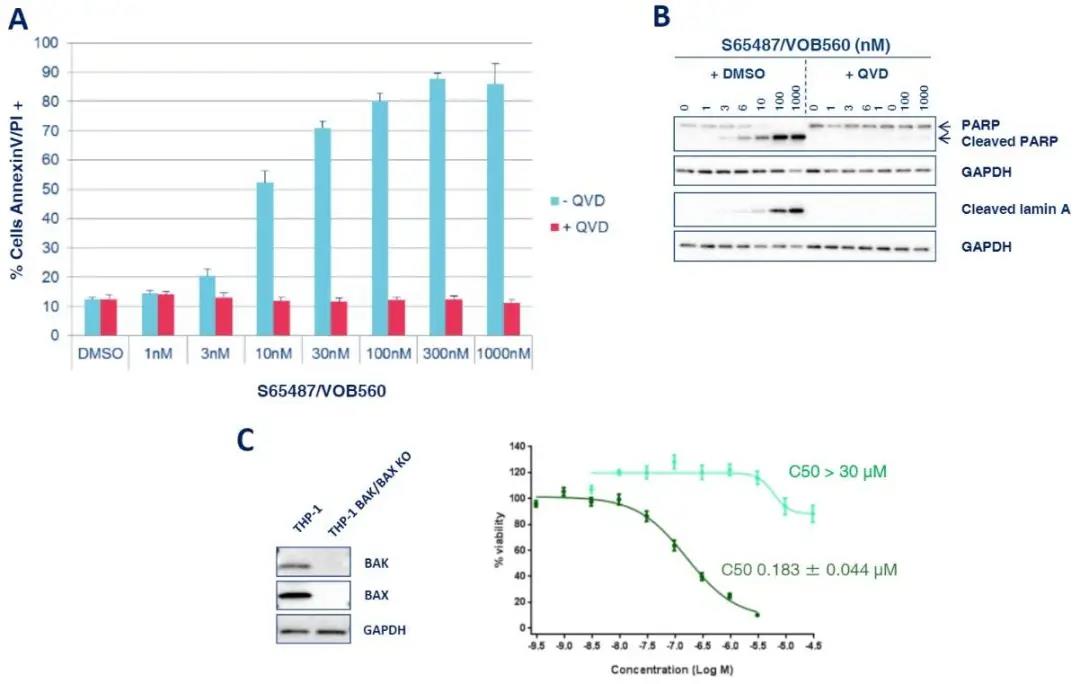
图3. A:指定浓度S65487/VOB560处理RS4;11细胞2h可诱导凋亡;B:指定浓度S65487/VOB560处理RS4;11细胞16h后检测裂解的PARP和核纤层蛋白A;C:在0.1%FBS中用浓度逐渐增加的S65487/VOB560处理THP1 WT或BAX/BAK KO 72h。WT:野生型;KO:基因敲除。
S65487/VOB560对血液恶性肿瘤系列具有活性
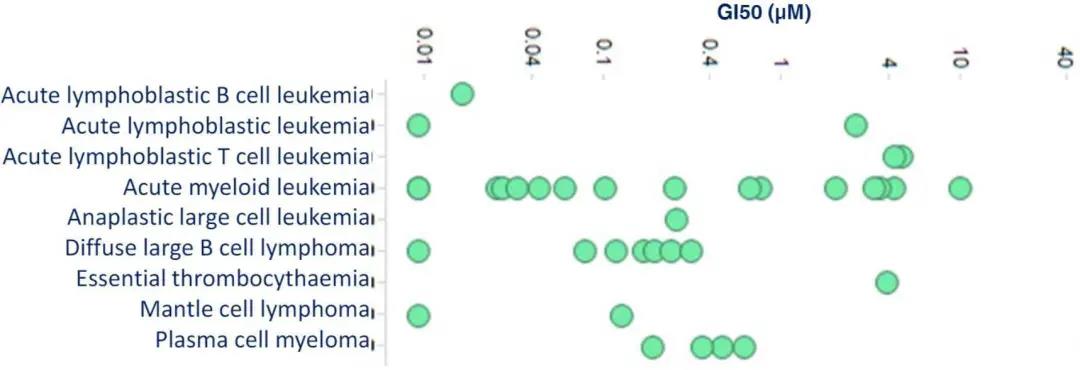
图4. 将细胞种植于1536孔的培养皿中并用浓度逐渐增加的S65487/VOB560孵育3天。通过CTG实验评估细胞存活情况。GI50表示抑制达到50%时曲线对应的x轴浓度。
S65487/VOB560的体内抗肿瘤活性依赖于每周静脉给药
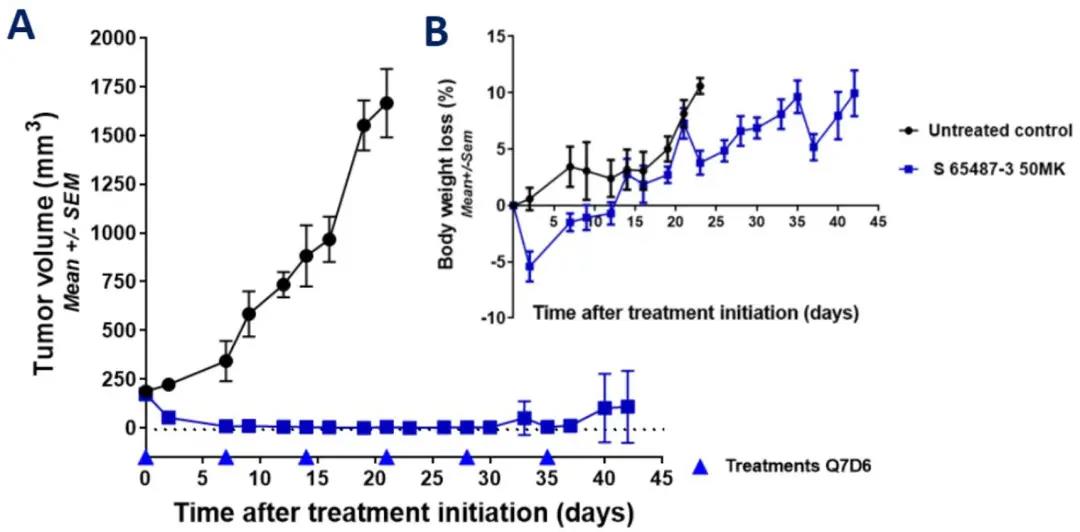
图5. A:每周静脉给予50mg/kg S65487/VOB560处理后,RS4;11移植雌性SCID小鼠(n=6)中肿瘤体积(mm3)的变化。B:每周静脉给予50mg/kg S65487/VOB560处理后,RS4;11移植雌性SCID小鼠(n=6)体重的降低(%)。
S65487/VOB560联合MCL-1抑制剂S64315/MIK665的抗肿瘤活性
在淋巴恶性肿瘤(AML和DLBCL)小鼠及大鼠模型中,每周通过静脉联合给予耐受剂量的S65487/VOB560和MCL-1特异性抑制剂S64315/MIK665,可观察到强烈且持续的肿瘤缓解(图6)。
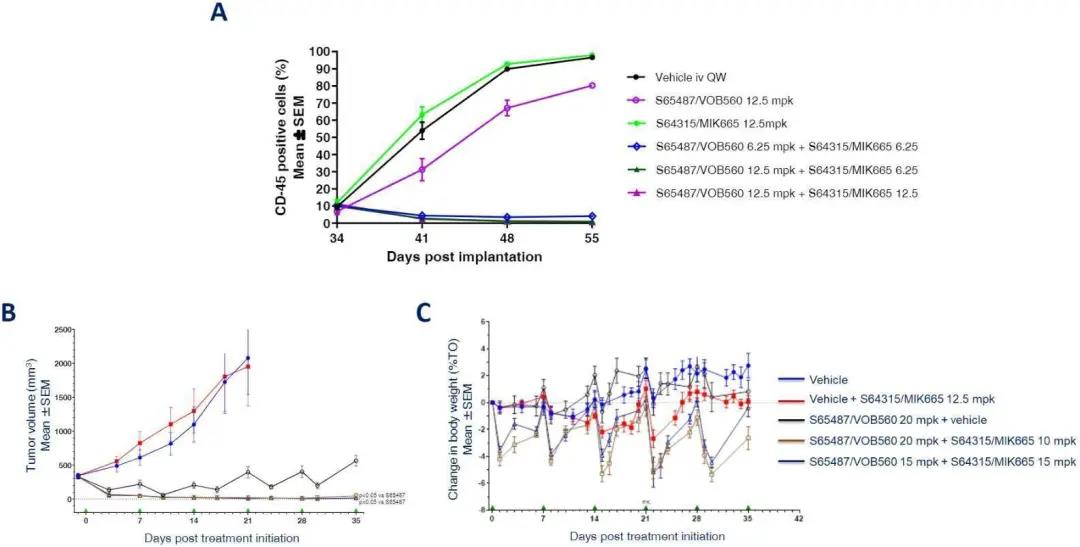
图6. A:雌性NGS小鼠经静脉注射2×106人类AMLX5343(PDX)AML细胞,当白细胞负担(外周血CD45+细胞)达到2.14%~34%时,将小鼠随机分为4个组,分别用载体、S65487/VOB560(IV,12.5mpk,QW)、MIK665(IV,12.5mpk,QW)或两者联合处理3周。结果用平均值±标准误表示。B和C:Toledo DLBCL异种移植的雌性裸鼠中S65487/VOB560的疗效及耐受性。通过皮下接种Toledo细胞(1×107细胞/200μl HBSS/Matrigel 1:1 v/v)构建肿瘤。肿瘤大小适中的动物被随机分配至平均肿瘤体积约330mm3的实验组并按指示进行处理。肿瘤体积变化及体重较处理前的变化用平均值±标准误表示。采用单边ANOVA和事后Tukey’s多组比较检验进行统计学评估。
S65487/VOB560对Venetoclax耐药肿瘤的作用
最近,在Venetoclax耐药的CLL患者中检测到获得性BCL-2突变(如G101V和D103Y)[6,7]。有趣的是,S65487/VOB560对这种BCL-2突变具有活性,且在临床前耐药模型中诱导凋亡(图7)。并且,与ABT-199相比,S65487/VOB560对BCL-2突变更有效(表3、4)。
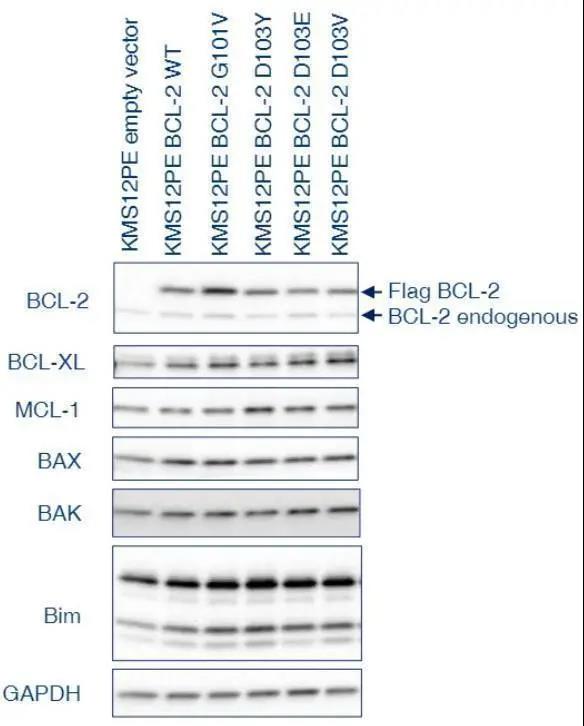
图7. Western blot实验显示了pcLV-Flag-BCL-2-IRES-TagRFP转导的KMS12PE细胞系中BCL-2家族的表达水平。
表3. 相关亲和力及选择性数据
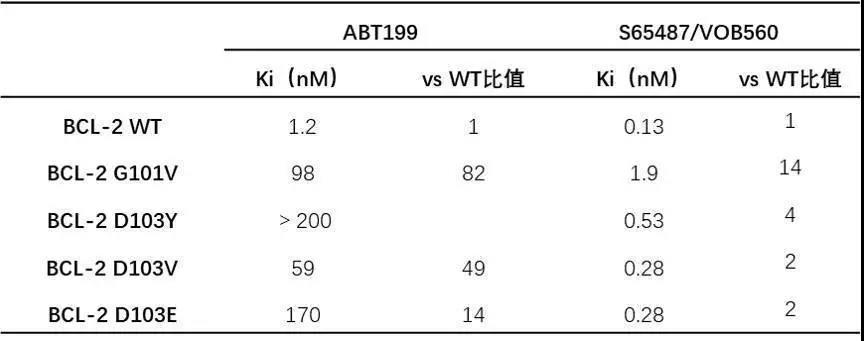
注:cKi采用重组BCL-2野生型(WT)或G101V、D103Y、D103E、D103V突变基因通过Quench实验检测。
表4. S65487/VOB560和ABT-199的效力评估
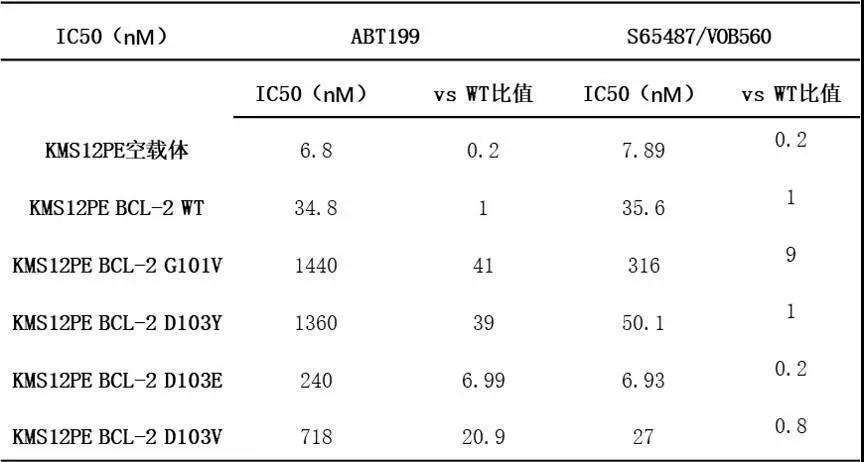
注:在过表达WT BCL-2或携带G101V、D103Y、D103E、D103V突变型BCL-2的KMS12PE细胞中,通过CellTiter-Glo试剂评估细胞系的细胞活性。
结论
综上所述,S65487/VOB560对人类淋巴系和髓系恶性肿瘤以及Venetoclax耐药的白血病患者均具有显著的治疗潜能。探索其单药治疗(NCT03755154)及联合S64315/MIK665(NCT04702425)或阿扎胞苷(NCT04742101)治疗的临床研究目前仍在进行中。
参考文献
[1] Czabotar PE, Lessene G, Strasser A, Adams JM. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy. Nat Rev Mol Cell Biol. 2014 Jan;15(1):49-63. doi: 10.1038/nrm3722.
[2] Souers AJ, Leverson JD, Boghaert ER, et al. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets. Nat Med. 2013 Feb;19(2):202-8. doi: 10.1038/nm.3048.
[3] Ashkenazi A, Fairbrother WJ, Leverson JD, Souers AJ. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors. Nat Rev Drug Discov. 2017 Apr;16(4):273-284. doi: 10.1038/nrd.2016.253.
[4] Szlavik Z, Csekei M, Paczal A, et al. Discovery of S64315, a Potent and Selective Mcl-1 Inhibitor. J Med Chem. 2020 Nov 25;63(22):13762-13795. doi: 10.1021/acs.jmedchem.0c01234.
[5] Leverson JD, Phillips DC, Mitten MJ, et al. Exploiting selective BCL-2 family inhibitors to dissect cell survival dependencies and define improved strategies for cancer therapy. Sci Transl Med. 2015 Mar 18;7(279):279ra40. doi: 10.1126/scitranslmed.aaa4642.
[6] Blombery P, Anderson MA, Gong JN, et al. Acquisition of the Recurrent Gly101Val Mutation in BCL2 Confers Resistance to Venetoclax in Patients with Progressive Chronic Lymphocytic Leukemia. Cancer Discov. 2019 Mar;9(3):342-353. doi: 10.1158/2159-8290.CD-18-1119.
[7] Blombery P, Thompson ER, Nguyen T, et al. Multiple BCL2 mutations cooccurring with Gly101Val emerge in chronic lymphocytic leukemia progression on venetoclax. Blood. 2020 Mar 5;135(10):773-777. doi: 10.1182/blood.2019004205.