克服CD3双特异性抗体治疗实体瘤的挑战
用CD3双特异性抗体免疫治疗癌症是一些血液学恶性肿瘤获批的治疗方案,目前正在对实体瘤进行临床研究。然而,实体瘤的治疗面临着较为明显的障碍,例如如靶向外毒性增加、T细胞浸润稀少、免疫抑制性肿瘤微环境的存在导致T细胞质量受损等,这些都影响了CD3-双特异性抗体治疗的安全性,限制了疗效。
来自荷兰莱顿大学医学中心的科研人员发表了一篇文章《Overcoming Challenges for CD3-Bispecific Antibody Therapy in Solid Tumors》,文章提到:他们提供了CD3-双特异性抗体治疗领域的简要现状更新,并确定了实体癌的内在障碍。此外,他们描述了克服这些挑战的潜在组合方法,以产生选择性和更有效的反应。

以CD3为基础的双特异性抗体(CD3-BsAb)是一类新兴的、有前途的免疫治疗药物,用CD3-BsAb对肿瘤进行免疫治疗是某些血液系统恶性肿瘤的一种已被批准的治疗方法,目前正在对实体癌进行临床研究。然而,实体瘤的治疗面临着更为明显的障碍,如靶向非肿瘤毒性增加、T细胞浸润稀疏以及由于免疫抑制肿瘤微环境的存在而导致T细胞质量受损,这些都影响CD3-BsAb治疗的安全性和有效性。
在过去几年中,许多不同形式CD3-BsAb产生。截至2020年12月,已知超过100种不同CD3-BsAb形式包含两个不同可变结构域的非常小的片段(没有Fc尾)、常规抗体结构(两个Fab臂连接到Fc尾)和具有附加可变结构域连接到常规抗体结构的较大结构。这些不同形式的机构决定如循环抗体半衰期、免疫原性、免疫效应器反应类型以及穿透实体肿瘤能力。Fc尾部通过表达Fc受体(FcR)结合情况,决定BsAb是否能够结合并激活免疫细胞产生炎症反应,导致严重不良事件。
血液恶性肿瘤中的CD3-BsAbs
CD3-BsAbs因其在血液癌中的成功而受到广泛关注。Blinatumomab(一种无Fc尾的CD3xCD19 BsAb)于2014年获得FDA批准,目前已成功用于临床治疗复发或难治性B细胞前体急性淋巴细胞白血病(ALL)患者。
除blinatumomab外,目前还有许多其他的CD3-BsAbs正在进行临床试验,其靶向是成熟的B细胞标志物,如CD19、CD20、CD38和B细胞成熟抗原(BCMA),以及骨髓标志物,如CD33和CD123。例如,在一项I/II期研究中,患有急性髓细胞白血病(AML)的患者接受氟替杜珠单抗(CD3xCD123 BsAb)治疗,并显示出30%的有希望的总体反应率(血细胞完全、部分或不完全恢复的完全反应)。
blinatumomab的临床试验显示,细胞因子释放综合征(CRS)是主要的安全相关AEs之一。CD19+肿瘤细胞和健康的B细胞和T细胞在同一舱室中的存在,使得CD3-BsAb介导的T细胞被急性和同步激活,随后炎性细胞因子如IFN-γ、IL-6和TNF-α过度释放,导致从轻度发热到多器官系统衰竭等症状。
CD3-BsAbs与实体瘤
尽管CD3-BsAbs多以用于血液学肿瘤而著称,但欧洲药品机构(EMA)批准的第一个CD3双特异性抗体是catumaxomab,这是一种CD3xEpCAM BsAb,用于腹膜内治疗上皮细胞粘附分子(EpCAM)阳性恶性腹水。这种抗体实际上是三功能的,因为它的Fc能够结合表达FcR的细胞,并诱导强烈的免疫反应。静脉给药时,由于激活了Kupffer细胞,也观察到了严重的肝脏毒性。卡妥莫单抗最终因商业原因于2017年被撤回,但给该领域上了重要一课,即CD3-BsAbs中存在活性Fc的潜在危险。
截至2020年12月,临床上还没有批准CD3-BsAbs用于治疗实体瘤。然而,临床研究中正在探索许多不同的靶点,其中大部分集中在经典TAAs上,如癌胚抗原(CEA)、表皮生长因子受体(EGFR)、EpCAM、HER2和前列腺特异性膜抗原(PSMA)。其他TAA也在探索中(详细列表见下图)。
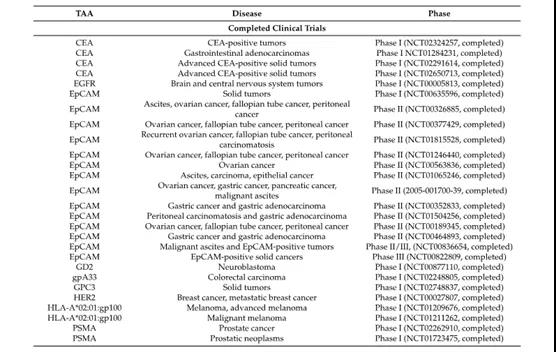

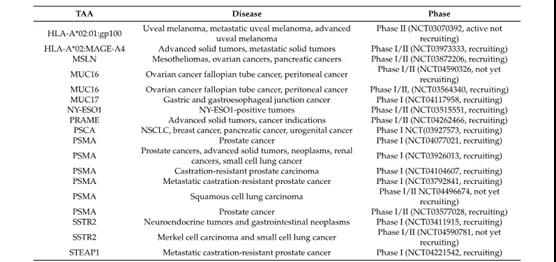
实体瘤CD3-BsAb治疗的三大障碍
CD3-BsAbs在血液学恶性肿瘤中似乎比在实体瘤中更有疗效,这一观察可归因于实体瘤特有的几个挑战。第一个障碍是靶点外毒性,因为与血液学TAAs相比,这些毒性似乎对选择用于实体瘤靶点的TAAs不太友好。在血液癌的情况下,B细胞或骨髓亚群的暂时消耗是可逆的。
第二个障碍是TME中效应细胞的可用性。对于血液学恶性肿瘤,血液中的癌细胞被T细胞包围,使得CD3- BsAb可以从无尽的效应细胞池中汲取,而实体瘤则需要T细胞的浸润才能发挥治疗效果。在此背景下,人们描述了三种免疫观点:
(1) "炎症型 "肿瘤,这种肿瘤被免疫细胞浸润,经常对免疫检查点治疗作出反应;
(2) "免疫荒漠型 "肿瘤,这种肿瘤的免疫原性降低或不存在,导致很少有初选的肿瘤特异性T细胞归巢;
(3) "免疫排除型 "肿瘤,这种肿瘤在基质中显示T细胞浸润,但不在肿瘤巢中显示。
第三个也是最后一个障碍是关于浸润T细胞的质量。TILs可以是功能障碍的,增殖和产生细胞溶解分子的能力受损,包括颗粒酶和穿孔素。TME中的免疫抑制细胞,包括癌相关成纤维细胞(CAFs)、骨髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)会产生TGF-β、IL-10、吲哚胺2,3-二氧酶(IDO)和精氨酸酶等因子,阻碍T细胞的代谢和活化。
解决方案和机遇
一、减轻靶向外肿瘤毒性的影响
为了提高肿瘤的选择性和特异性,减轻靶向外毒性,可以通过生成所谓的2:1 CD3- BsAbs来提高TAA的特异性。这些2:1 CD3-BsAbs含有第二个TAA结合片段,从而产生CD3xTAAxTAA双特异性抗体。研究表明,在体外使用2:1的HER2靶向CD3- BsAb时,对高表达HER2细胞的特异性显著增加。更重要的是,2:1 CD3-BsAb有效地延缓了NSG小鼠高HER2表达肿瘤的生长,而在低HER2表达肿瘤中没有观察到抗肿瘤的功效。相反,1:1的CD3-BsAb能够有效地延缓高和低HER2表达肿瘤(这里用作健康组织的模型)的肿瘤生长。
该领域的一个概念性创新是生成CD3-BsAbs作为原药,在TME中被激活。生理特征的差异,如缺氧相关的低pH值、ECM的过度产生和蛋白溶解的增加,将实体瘤与健康组织区分开来。
二、增加腔内T细胞的数量
免疫排斥的肿瘤周围有T细胞,但穿透肿瘤床受到物理障碍或可溶性因素的阻碍。因此,提高这类肿瘤的治疗效果的努力应集中在清除这些障碍物上。物理障碍主要是由ECM结构形成的,它迫使T细胞沿着刚度增加的区域移动,而不是遵循化学因子梯度,这个过程称为aptotaxis。这种屏障由蛋白多糖和纤维蛋白组成,如胶原蛋白、弹性蛋白和层粘连蛋白,它们主要由CAFs产生,但也由肿瘤细胞和星状细胞产生。可以通过直接破坏ECM来靶向ECM成分,如胶原蛋白和透明质酸(HA),这一过程也是在化疗药物输送到肿瘤的背景下研究的。
此外,TGF-β也被认为是阻碍T细胞浸润的因素。这种免疫抑制性细胞因子由CAFs产生,但也有许多其他细胞,包括Tregs和M2巨噬细胞。与CXCL12信号抑制类似,在乳腺癌和结直肠癌的多个小鼠模型中,阻断TGF-β信号会导致更多的T细胞浸润,增加对检查点抑制治疗的敏感性。TME中分泌因子的翻译后修饰也会影响T细胞的吸引,如对CCL2的报道。TME中活性氮物种(RNS)对CCL2的硝化作用导致T细胞卡在肿瘤细胞周围的基质中。抑制RNS的产生极大地改善了几种小鼠肿瘤模型中T细胞的浸润,从而提高了生存率,作为单药治疗或与收养性细胞转移联合使用。
三、提高T细胞反应的质量
下图是提高T细胞质量的解决方案针对障碍3:TIL质量受损的解决方案:
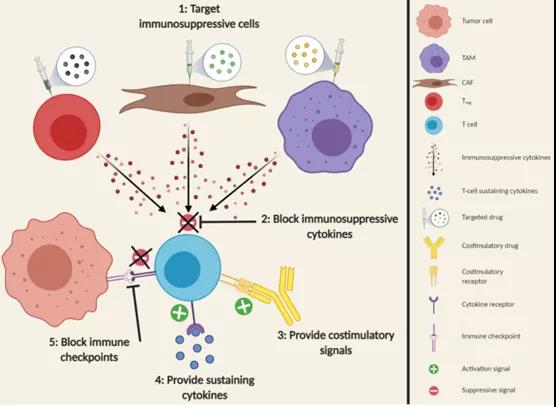
(1)针对CAFs、Tregs和肿瘤相关巨噬细胞(TAMs)等免疫抑制细胞,消耗免疫抑制细胞因子的生产者,从而降低T细胞的抑制信号,改善其效应功能。
(2)直接阻断免疫抑制性细胞因子,而不是针对其细胞生产者,能够达到同样的效果。
(3)增加成本刺激,为T细胞效应器功能和生存提供积极信号。
(4)提供维持性细胞因子也能改善T细胞功能。
(5)阻断免疫检查点可以防止T细胞功能紊乱,使抗肿瘤反应更强。
未来展望
CD3-BsAbs在血液恶性肿瘤中的治疗效果显著,是一类新兴的、有前景的免疫疗法,然而,在实体瘤中突出的抗肿瘤疗效仍需临床验证。尤其是在实体瘤中,存在着一系列的障碍,从靶向外毒性和TME中T细胞浸润的缺失,到敌对和免疫抑制性微环境导致的T细胞功能受阻。由于不断的研究努力,每年都会有更多的肿瘤特异性TAAs成为CD3-BsAb格式使用。结合不断发展的技术,允许BsAbs的条件掩蔽,在不久的将来,靶向外效应应该是可控的。一些有趣的临床前概念已经发表,以增强肿瘤中的T细胞浸润,例如用OV进行预处理,以促进大规模的T细胞浸润,并创建一个炎症TME。OV治疗似乎最有希望,因为炎症TME也有助于提高TILs的质量。在改善TIL质量方面有许多选择,然而,除了检查点阻断或协同刺激外,只有很少的选择与CD3-BsAbs联合测试。尽管如此,基于优雅的临床前研究,我们相信CD3-DsAbs与(肿瘤靶向)协同刺激的组合能够克服实体瘤TME设置的许多障碍。
作者们预计未来会出现这样的情况:即从活检中获得的肿瘤免疫景观指导选择最佳治疗组合。然而,由于这些组合中的许多组合才刚刚开始出现,因此,关注新的临床前研究结果,看看这些结果如何转化为临床,这些都将是令人感兴趣的。最终,基于这些新方法,科研人员预见基于CD3-BsAb的治疗在实体瘤中的光明前景。
