NLRP3炎症小体与相关炎症信号通路在肾缺血-再灌注损伤中的作用
肾缺血-再灌注损伤(IRI)常见于肾移植术中,是引起急性肾衰竭的重要病理生理过程,严重影响受者预后。炎症反应在IRI的发病机制及病理过程中占据着重要地位。活化的NOD样受体蛋白3(NLRP3)炎症小体可通过介导多种促炎因子的成熟与释放,调节机体炎症反应及相关细胞功能。本文对肾IRI中的NLRP3炎症小体及其相关炎症信号通路的作用机制进行了总结,旨在为临床肾IRI的防治提供新思路。
现阶段,全世界有10%的人口患有慢性肾病。随着人口老龄化的加剧以及糖尿病、高血压发病率的增加,慢性肾病的患病率在未来十年很可能会大幅度增长。全球需要肾脏替代治疗的患者在保守模型中约为490.2万,在高估计模型中约为9 701万,终末期肾病的形势仍十分严峻[1]。肾移植是治疗终末期肾病的最佳方法,肾移植受者的长期生存率、生活质量明显高于透析患者。然而肾移植术中常伴随肾缺血-再灌注损伤(ischemia-reperfusion injury,IRI),严重影响受者预后。
IRI是指器官在暂时缺血时,其血液供给暂时减少,再恢复血流灌注后,可引起器官功能障碍甚至结构损伤的一种病理状态[2]。肾脏是IRI过程中易受影响的主要器官之一,其机制可能与炎症反应、氧自由基、细胞内钙超载、细胞凋亡等多种因素有关[3]。肾缺血后可使肾小管上皮细胞和内皮细胞功能受损,从而导致组织内白细胞被激活,最终可加重血管渗漏和间质水肿[4]。机体再受刺激后,可通过激活相关的受体结构如Toll样受体(Toll-like receptor,TLR)、NOD样受体(NOD-like receptor,NLR),发挥相关炎症调节作用。NLR是一个细胞内天然感受器家族,是调节炎症和凋亡反应的细胞质蛋白,其中NLR蛋白(NLR protein,NLRP)3炎症小体得到了研究者的格外关注,NLRP3炎症小体可通过增强免疫细胞的炎症反应以及免疫细胞与肾脏非免疫细胞之间的相互作用参与调节肾IRI的进展。探明NLRP3炎症小体在肾IRI中的相关炎症信号通路可能对肾IRI的防治具有重要意义。
1 NLRP3炎症小体及其结构
人体免疫系统可通过相关的模式识别受体(pattern recognition receptor,PRR)识别各种刺激,从而激活下游信号通路,启动人体的免疫应答。目前已发现4类PRR,包括TLR、NLR、视黄酸诱导基因1样受体和C型凝集素样受体[5]。参与IRI过程的主要是TLR和NLR这两种PRR。炎症小体是由PRR参与组装的多蛋白复合体,能够活化半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,半胱天冬酶)-1并促进白细胞介素(interleukin,IL)-1β等前体分子的成熟与释放[6]。NLR广泛存在于炎症小体中,但依据其中NLR蛋白的不同可分为NLRP1、NLRP3、NLRP6、NLRP7、NLRP12等炎症小体。
在诸多炎症小体中,关于NLRP3炎症小体的研究最多,其特点也最为突出。NLRP3炎症小体在整个进化过程中高度保守,在宿主的免疫防御中发挥着不可或缺的作用。与其他需要特殊刺激的炎症小体不同,它能被多种外源性和内源性化合物同时激活,也使得其成为炎症小体介导炎症反应中的关键点[7]。NLRP3炎症小体在自身免疫性疾病及相关疾病中的重要性已被充分证明,其被广泛的刺激物激活后发挥作用,参与了多种人体自身炎症反应和自身免疫性疾病。因此,NLRP3炎症小体可能是抗炎治疗的新靶点[8]。
NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和前体蛋白pro-半胱天冬酶-1参与了NLRP3炎症小体的组成。当NLRP3炎症小体被激活后,其结构会发生一系列变化,从而发挥相关作用[9]。活化后的NLRP3炎症小体主要通过调节多种促炎因子的功能,参与相关免疫细胞功能的调节及炎症反应。IRI可发生于人体的多种器官及组织,包括脑、心、肝、肺、肾、胃肠道和骨骼肌等[2],在这些器官及组织中NLRP3炎症小体主要通过氧化应激及诱发、加重炎症反应参与IRI过程[10-13]。在肾IRI后,NLRP3炎症小体对于炎症反应的触发和调节起着无法替代的作用。
2 NLRP3炎症小体通过相关炎症信号通路参与肾IRI
2.1 肾IRI中NLRP3炎症小体不同炎症信号通路的激活机制
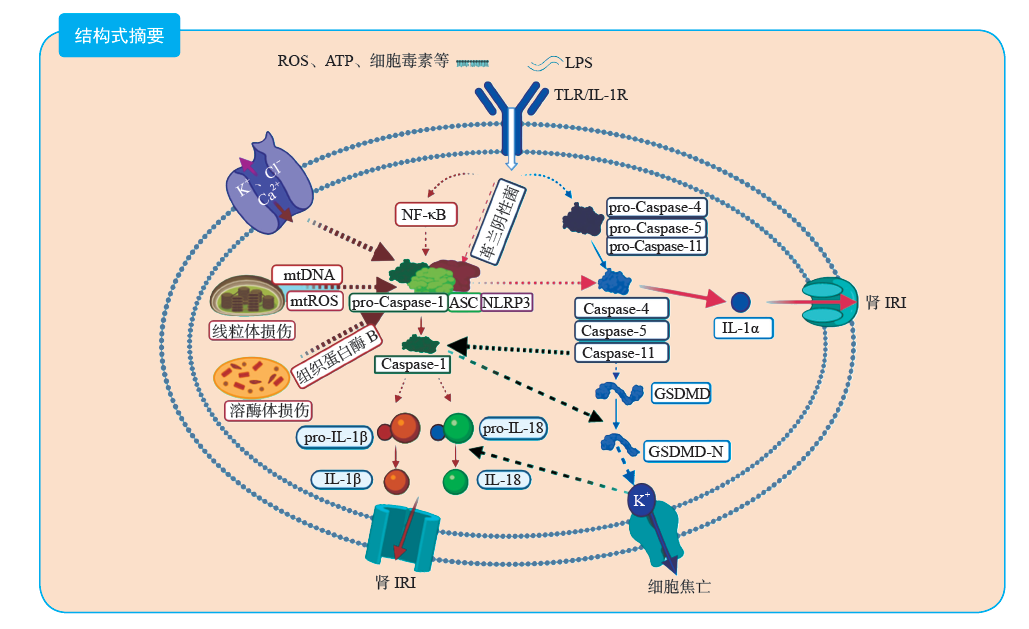
当肾IRI时,NLRP3炎症小体可通过依赖于半胱天冬酶-1发挥促炎作用的经典途径和主要依赖于半胱天冬酶-4、半胱天冬酶-5或半胱天冬酶-11发挥作用的非经典途径参与相关炎症反应。其中,经典途径研究较为广泛,经典途径又包括启动和激活两个步骤。启动主要是促进炎症小体成分的表达,其信号主要包括三磷酸腺苷(adenosine triphosphate,ATP)、细菌毒素、病毒、活性氧簇(reactive oxygen species,ROS)、尿酸盐结晶、胆固醇结晶等微粒或晶体以及β淀粉样蛋白等[14],这些物质通过激活TLR/IL-1受体,触发依赖核因子(nuclear factor,NF)-κB的pro-IL-1β和pro-IL-18发生基因转录。在经过半胱天冬酶-1裂解后,这些促炎因子以pro-IL-1β和pro-IL-18的形式释放到细胞质中,从而参与炎症反应[15]。
2.1.1 经典炎症信号通路中NLRP3炎症小体的激活和组装
激活信号主要参与炎症小体复合物的组装,NLRP3去泛素化后其N端效应结构域与ASC同型结构域相互作用,ASC随后与pro-半胱天冬酶-1结合,形成一个大的多聚蛋白复合物,无活性的pro-半胱天冬酶-1经过近端诱导的多聚化蛋白裂解后转变为活化的半胱天冬酶-1[16]。活化的半胱天冬酶-1是一种特定作用于天冬氨酸的半胱氨酸蛋白酶,可在细胞质中分割促炎因子IL-1β、IL-18的前体,使其转化为成熟的IL-1β、IL-18并释放到胞外,而IL-1β可激活IL-1受体复合体,进一步活化如IL-18、肿瘤坏死因子-α、IL-17等多种炎症因子,IL-1β、IL-18通过其强大的促炎作用在人体感染和损伤等病理过程中调节机体相关免疫反应[17]。
2.1.2 经典炎症信号通路中NLRP3炎症小体的激活机制
NLRP3炎症小体可被多种刺激物激活,但是众多激活剂的下游是如何整合成某种保守统一的信号来激活NLRP3炎症小体尚不清楚。目前已经提出了几种NLRP3炎症小体的激活机制,主要包括离子通道开放、溶酶体损伤、线粒体损伤及功能障碍[18]。
在NLRP3炎症小体激活中发挥作用的离子通道开放形式主要包括K+外流、Ca2+内流以及Cl-外流。除了少数个例,绝大多数的NLRP3炎症小体激活过程都有K+外流参与。P2X7通道在被ATP激活后,其介导的离子通道被打开,引起K+外流,导致Pannexin-1通道蛋白在细胞膜上形成小孔,从而使细胞外微生物分子进入细胞质激活NLRP3炎症小体[19]。Ca2+内流也是激活NLRP3炎症小体的主要机制之一,通过开放质膜通道或释放与内质网相连接的储存库中的Ca2+,可使Ca2+流向细胞浆。Ca2+内流和K+外流往往都是相互伴随的,当血浆Ca2+通道开放或内质网连接的储存库中的Ca2+被释放时,K+外流通常也会一起发生。并且,经常发现Ca2+内流和K+外流在NLRP3炎症小体的激活中可互相协调,例如ATP激活P2X7受体能减少Ca2+内流和协调K+外流[20]。此外,有证据表明,Cl-外流在NLRP3炎症小体的激活中也发挥了重要作用,细胞外低Cl-会促进由ATP介导的IL-1的分泌,而细胞外高Cl-的情况会抑制NLRP3炎症小体的激活[21]。
溶酶体的损伤是NLRP3炎症小体激活的关键因素,这与细胞对微粒的吞噬作用密切相关。无论是自身产生的微粒如尿酸和胆固醇结晶等,还是外来微粒如明矾、二氧化硅和石棉等,都会在被细胞吞噬后导致溶酶体肿胀和损伤并释放组织蛋白酶B,而组织蛋白酶B可通过直接或间接途径来激活NLRP3炎症小体[22]。
线粒体的损伤和功能障碍时,释放的线粒体DNA(mitochondrial DNA,mtDNA)和线粒体来源ROS(mitochondria-derived ROS,mtROS)均参与了NLRP3炎症小体的激活。NLRP3炎症小体激活剂可诱导线粒体损伤并释放ROS,mtROS的产生可以不依赖K+外流和溶酶体破坏两条通路孤立诱导NLRP3炎症小体的激活,它能促进细胞内硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)与硫氧蛋白-1分离,并使TXNIP与NLRP3炎症小体结合从而激活NLRP3炎症小体。mtDNA在被各种NLRP3炎症小体激活剂刺激后迅速释放到细胞质中并被氧化,氧化的mtDNA可与NLRP3炎症小体发生免疫共沉淀,特异性激活NLRP3炎症小体[23]。
2.1.3 非经典炎症信号通路中NLRP3炎症小体的激活机制
当NLRP3炎症小体受到某些革兰阴性菌刺激时,可通过半胱天冬酶-4、半胱天冬酶-5或半胱天冬酶-11介导的非经典炎症信号通路被激活。在这个途径中,半胱天冬酶 -11能孤立地刺激焦亡和IL-1α产生,同时激活半胱天冬酶-1,将pro-IL-1β和pro-IL-18裂解成它们的活性形式[22]。半胱天冬酶-11最初是作为半胱天冬酶-1的相互作用因子被发现的,它能促进半胱天冬酶-1的激活。当细胞外脂多糖激活TLR4时,可通过Ⅰ型干扰素与C3-C3aR补体轴一起上调半胱天冬酶-11的表达。半胱天冬酶-11通过直接识别细胞浆内毒素,触发寡聚,并裂解自身蛋白被激活[19]。随后,Gasdermin D(GSDMD)蛋白被激活的半胱天冬酶-4、半胱天冬酶-5或半胱天冬酶-11切割成GSDMD-N,诱导焦亡的发生,焦亡引起的K+外流激活了半胱天冬酶-1介导的IL-1β、IL-18的分泌[24]。此过程虽然与半胱天冬酶-1有一定的关联,但却并不依赖于ASC和半胱天冬酶-1。
2.2 NLRP3炎症小体通过不同炎症信号通路参与肾IRI
肾脏的血流量极其丰富,在维持体内电解质平衡及排泄代谢废物的过程中发挥了重要作用。为了支持相关功能,肾脏特别是肾小管上皮细胞中线粒体密度较高,因而对缺氧及能量的减少十分敏感。肾移植术中常无法避免肾IRI的发生,在肾IRI过程中,肾脏产生严重的炎症反应,其形态、血流动力学、上皮细胞及内皮细胞等均会受到不同程度的影响。在短时间缺血情况下,内皮细胞、血小板可通过引起凝血功能障碍,促进白细胞活化等细胞生理学过程发挥适当的保护作用,但长期或严重缺血可导致细胞的损伤和死亡[7]。NLR家族与肾脏相关的多种病理生理过程关系密切,在机体受到刺激后,在NLR等受体分子启动的主要先天性免疫信号通路(如NF-κB和炎症小体相关信号通路)中发现肾脏细胞代谢模式以及相关免疫细胞和实质细胞的表型均可发生改变,并且能触发分泌多种炎症因子,导致肾脏发生不可逆的组织损伤和功能障碍[25]。
2.2.1 NLRP3炎症小体通过经典炎症信号通路参与肾IRI
NLRP3炎症小体的形成在IRI中发挥重要作用,它参与了包括组织损伤、炎症反应和纤维化等在内的多种病理生理过程[26]。在探讨坏死损伤在体内转化为炎症的机制中,许多研究发现NLRP3炎症小体主要通过经典炎症信号通路在肾IRI的炎症反应中发挥重要作用。有研究者利用NLRP3炎症小体缺陷型小鼠构建IRI模型,在再灌注后观察到肾小管上皮细胞增殖,肾小管坏死和凋亡减少,随后肾小管上皮细胞重新聚集,表明NLRP3炎症小体不利于IRI后的修复反应[27]。
大量研究表明,NLRP3炎症小体可通过依赖于半胱天冬酶-1参与的经典炎症信号通路介导肾IRI的发生。Wen等[28]研究发现在肾IRI中,NLRP3炎症小体激活水平升高,在模拟IRI的野生型小鼠中NLRP3和ASC表达上调,同时发现IRI促进了半胱天冬酶-1、IL-1β和IL-18的成熟和分泌。而与野生型IRI小鼠相比,NLRP3炎症小体缺陷型IRI小鼠肾脏病理损伤相对较轻,其血清肌酐、血尿素氮和尿中性粒细胞明胶酶相关脂质运载蛋白、炎症小体激活水平均受到抑制。此外,研究还发现激活肾IRI中NLRP3炎症小体的ROS是由受损的线粒体产生的,并且发现ROS是通过TXNIP的直接相互作用来诱导NLRP3炎症小体的激活。Iyer等[29]研究发现NLRP3炎症小体的缺乏可保护动物免受致命性肾缺血损伤,在缺血性急性肾小管坏死过程中,NLRP3炎症小体诱导了过度的急性炎症反应,从而导致了IRI诱导的肾功能障碍和肾小管致死性损伤。通过比较NLRP3炎症小体缺陷型小鼠和野生型小鼠的存活率、血尿素氮和血清肌酐以及中性粒细胞浸润数量等发现,以上指标差异均有统计学意义。此外,Kim等[30]研究发现,与野生型小鼠比较,NLRP3炎症小体缺陷型小鼠的血尿素氮、血清肌酐、急性肾小管坏死评分和细胞凋亡评分均降低,从而证明了NLRP3炎症小体缺乏对小鼠缺血性急性肾损伤也有保护作用。
2.2.2 NLRP3炎症小体通过非经典炎症信号通路参与肾IRI
有研究表明,NLRP3缺乏能够减轻小鼠肾IRI,而ASC缺乏却对小鼠致命性肾缺血损伤的保护作用不那么明显[31]。这表明在肾脏中,NLRP3炎症小体中可能存在其他成分在损伤信号传导中发挥孤立作用。
最近的一项研究发现,NLRP3炎症小体可以在不依赖于半胱天冬酶-1和GSDMD蛋白的情况下诱导细胞焦亡[32]。此外,脂多糖和氧化磷脂可直接结合转化为半胱天冬酶-11、半胱天冬酶-4和半胱天冬酶-5,在没有相关适配蛋白的巨噬细胞中活化炎症小体[33]。Iyer等[29]发现,NLRP3炎症小体缺陷型小鼠在缺血后急性肾小管坏死减少,而NLRP3缺陷型小鼠和ASC缺陷型小鼠在肾缺血损伤后,二者的存活情况和早期肾功能障碍发生情况比较,差异有统计学意义,从而表明NLRP3在炎症反应中可能不依赖于ASC和半胱天冬酶-1孤立发挥作用。Shigeoka等[34]发现NLRP3的缺乏阻碍了IL-1β及IL-18的产生,但阻断IL-1β和IL-18对于细胞损伤均无明显作用,从而表明在肾小管上皮细胞中,NLRP3可以发出不依赖于炎症小体、促炎因子和趋化因子的损伤反应信号。Kim等[35]的研究发现,在缺氧条件下,ASC与NLRP3没有明显的共定位,且NLRP3可在ASC或半胱天冬酶-1缺失的情况下重新定位到肾小管上皮细胞中的线粒体,通过线粒体抗病毒信号蛋白控制缺血缺氧下的线粒体损伤和凋亡,使得NLRP3炎症小体不依赖于ASC或半胱天冬酶-1调节肾IRI。
3 小 结
肾IRI和多种炎症疾病的发生与NLRP3炎症小体的过度激活密切相关,这提示NLRP3炎症小体可能是治疗这些疾病的潜在靶点。然而,目前临床仍缺乏针对NLRP3炎症小体的药物。最近有研究揭示了一些能下调NLRP3表达或抑制NLRP3炎症小体组装的途径,如紫花前胡苷、别嘌呤醇、环氧二十碳三烯酸、激动蛋白C类物质,可直接抑制NLRP3炎症小体的激活[36-39]。抑制Pannexin-1和P2X4等通道或受体的活性也可减少NLRP3炎症小体的激活[40-41]。此外,有研究表示,微小核糖核酸(microRNA,miRNA,miR)可通过直接靶向抑制NLRP3基因来下调NLRP3表达,如miR-223、miR-9和miR-155[42-44]。最近有学者发现,通过利什曼原虫感染巨噬细胞组蛋白H3诱导的微调转录反应也能够抑制NF-κB和NLRP3炎症小体的激活[45],这提示可通过多种途径抑制NLRP3炎症小体来治疗肾IRI,抑制NLRP3炎症小体的过度激活可能是防治肾IRI的一种策略。未来应进一步明确NLRP3炎症小体在人体中导致肾IRI的依赖性信号事件及其具体机制,为临床肾IRI的防治提供更多的思路。
作者单位:
贵州医科大学(袁强、申开文、张瑞波、沈俊);
贵州医科大学附属医院泌尿外科(袁强、申开文、张瑞波、沈俊)
