弥漫浸润型星形细胞瘤中PI3K、PTEN和GSK-3β的表达及临床意义
弥漫浸润型星形细胞瘤中PI3K、PTEN和GSK-3&β;的表达及临床意义
李木子 1,罗克莲2,石 柳2,高 勤1
Expressions of PI3K, PTEN and GSK-3&β; in diffusely infiltrating astro-cytomas and their clinical significance
LI Muzi1, LUO Kelian2, SHI Liu2, GAO Qin1
作者单位
1. 贵州医科大学病理学教研室,贵州 贵阳 550001;2. 贵州医科大学附属医院病理科,贵州 贵阳 550001
基金项目
贵州省科学技术基金项目(编号:黔科合J字[2015]2016号)
AUTHORS FROM
1. Department of Pathology, Guizhou Medical University, Guiyang 550001, Guizhou Province, China; 2. Department of Pathology, Affiliated Hospital of Guizhou Medical University, Guiyang 550001, Guizhou Province, China
GRANT
Guizhou Science and Technology Fund Project(No. J[2015]2016)
[摘要]
目的:探讨磷酸肌醇3-激酶(phosphatidy-linositol 3-kinase,PI3K)、糖原合成酶激酶3&β;(glycogen synthase kinase-3&β;,GSK-3&β;)和第10号染色体缺失的磷酸酶(homologous deletion phosphatasetensin on 染色体 ten,PTEN)在弥漫浸润型星形细胞瘤中的表达及临床意义。
方法:采用免疫组织化学法检测PI3K和GSK-3&β;在132例弥漫浸润型星形细胞瘤中的表达情况。应用荧光原位杂交技术标记PTEN在弥漫浸润型星形细胞瘤中的表达缺失情况。采用Kaplan-Meier生存曲线及COX比例风险回归模型对弥漫浸润型星形细胞瘤患者总生存期和预后因子进行单因素和多因素分析。
结果:随着肿瘤WHO级别的升高,PI3K表达增加,而GSK-3&β;表达降低,差异均有统计学意义(P 值均<0.05),且两者表达呈负相关(r=-0.424,P<0.05)。PTEN基因在弥漫型星形细胞瘤中未发生缺失,在间变型星形细胞瘤和胶质母细胞瘤中的缺失率分别为45%和30%。PI3K和GSK-3&β;的表达与肿瘤WHO分级和术后2年复发明显相关(P 值均<0.05)。PI3K阳性患者的总生存率低于阴性患者,GSK-3&β;阳性患者的总生存率高于阴性患者(P 值均<0.05)。WHO分级、PI3K阳性表达和GSK-3&β;阴性表达与弥漫浸润型星形细胞瘤患者的预后显著相关,其中WHO级别和PI3K阳性表达是影响弥漫浸润型星形细胞瘤患者预后的危险因素(P 值均<0.05)。
结论:弥漫浸润型星形细胞瘤中GSK-3&β;表达随着WHO级别的增高而降低,而PI3K表达随着WHO级别的增高而增高,PTEN在高级别的弥漫浸润型星形细胞瘤中发生缺失。
[关键词]星形细胞肿瘤;PTEN磷酸水解酶;磷酸肌醇3-激酶;糖原合成酶激酶3&β;
[ABSTRACT]
Objective: To investigate the expressions of phosphatidylinositol3-kinase(PI3K), glycogen synthase kinase 3&β;(GSK-3&β;) and homologous deletion phosphatasetensin on 染色体 ten(PTEN) in diffusely infiltrating astrocytomas, and to explore their clinical significance.
Methods: Immunohistochemical method was used to detect the expressions of PI3K and GSK-3&β; in diffusely infiltrating astrocytomas. Fluorescence in situ hybridization was used to label the expression of PTEN in diffuse infiltrating astrocytomas. Kaplan-Meier survival curve and COX proportional hazard regression model were used to univariate and multivarite analysis of overall survival and prognosis.
Results: The expression of PI3K in diffusely infiltrating astrocytomas increased with the increase of WHO grade, while the expression of GSK-3&β; decreased with the increase of WHO grade, and the differences were statistically significant(both P < 0.05). The expression of GSK-3&β; was negatively correlated with the expression of PI3K in diffusely infiltrating astrocytomas. There was no deletion of PTEN gene in diffuse astrocytoma, but the deletion rates of anaplastic astrocytoma and glioblastoma were 45% and 30%, respectively. The expressions of PI3K and GSK-3&β;were correlated with WHO grade and the recurrence two years after operation(all P < 0.05). The results of Kaplan-Meier survival curve showed that the overall survival rate of PI3K positive patients was lower than that of the negative patients, and the overall survival rate of GSK-3&β; positive patients was higher than that of the negative patients. Univariate analysis showed that WHO grade, the positive expression of PI3K and the negative expression of GSK-3&β; were significantly correlated with the prognosis of patients with diffusely infiltrating astrocytomas. Multivariate analysis showed that WHO grade and the positive expression of PI3K were risk factors affecting the prognosis of patients with diffuse invasive astrocytoma(both P < 0.05).
Conclusion: The expression of GSK-3&β; in diffusely infiltrating astrocytomas decreased with the increase of WHO grade, the expression of PI3K increased with the increase of WHO grade, and the expression of PTEN was absent in high grade diffusely infiltrating astrocytomas.
[Key words]Astrocytoma; PTEN phosphohydrolase; Phosphatidylinositol 3-kinase; Glycogen synthase kinase 3&β;
弥漫浸润型星形细胞瘤是一种常见的原发性颅内肿瘤,其生长方式为浸润性,因此目前的放疗、化疗和手术切除治疗效果均不十分理想。弥漫浸润型星形细胞瘤可根据细胞密度、核异型性、核分裂象、微血管增生和/或坏死进行分级,分为WHOⅡ~Ⅳ级。磷酸肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称为AKT)通路在不同类型的肿瘤中参与多种生物学过程,其过度激活将导致细胞周期进程异常、细胞黏附及运动性改变,同时抑制细胞凋亡,诱导肿瘤间质血管生成。研究显示,该信号通路的下游靶基因也参与其中,如糖原合成酶激酶3&β;(glycogen synthase kinase-3&β;,GSK-3&β;),激活的AKT可以使GSK-3&β;发生磷酸化[1]。有证据表明,第10号染色体缺失的磷酸酶(homologous deletion phosphatasetensin on 染色体 ten,PTEN)、PI3K和GSK-3&β;均在星形胶质细胞瘤中发挥重要作用。本研究中首先采用免疫组织化学法检测不同恶性程度的弥漫浸润型星形细胞瘤中GSK-3&β;与PI3K的表达情况,分析二者之间及其与患者预后的相关性;随后进一步采用原位荧光杂交技术检测弥漫浸润型星形细胞瘤中PTEN基因的表达情况,以期探讨弥漫浸润型星形细胞瘤的发生与发展机制,为其靶向治疗提供一定的理论依据。
1 材料与方法
1.1
患者资料
收集132例2010—2019年来自贵州医科大学附属医院病理科并明确病理学诊断的弥漫浸润型星形细胞瘤标本。所有标本均用石蜡包埋后,常温避光保存。临床诊断和病理分类依据WHO标准,根据组织学特征分为弥漫型星形细胞瘤40例、间变型星形细胞瘤40例、胶质母细胞瘤52例;另外取正常脑组织20例(脑出血标本)作为阴性对照。
1.2
主要试剂
鼠抗人PI3K单克隆抗体购自英国Abcam公司,兔抗人GSK-3&β;多克隆抗体购自美国Genetex公司,羊抗小鼠和(或)兔IgG(二抗)[通用二步法试剂框,小鼠和(或)兔增强聚合物法检测系统]购自北京中杉金桥生物技术有限公司,针对PTEN基因的探针购自广州安必平医药科技有限公司。
1.3
免疫组织化学染色法检测PI3K和GSK-3&β;的表达
免疫组织化学染色采用Envision法。所有检测均采用已知阳性切片作为阳性对照,用非肿瘤性脑组织作为阴性对照。所有标本均经过4%的中性甲醛溶液固定,石蜡包埋,2.5 μm厚度连续切片。经脱蜡、水化后,分别加入鼠抗人PI3K单抗体和兔抗人GSK-3&β;多抗体(工作液体积稀释比例均为1∶100),4 ℃孵育过夜;次日加入通用型酶标山羊抗兔IgG,室温孵育30 min,DAB显色,苏木精对比染色,氨水返蓝;脱水,透明,封固,在光学显微镜下观察肿瘤组织中PI3K和GSK-3&β;蛋白的表达水平。
结果判定:GSK-3&β;以细胞质和细胞核出现棕黄色、棕褐色颗粒为阳性标志;PI3K以细胞质中出现棕黄色、棕褐色颗粒为阳性标志。在高倍光学显微镜下随机选取5个视野,根据阳性细胞数和着色强度判断表达结果。其中,根据细胞染色强度评分:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。根据阳性细胞所占百分比评分:<10%为0分,10%~25%为1分,26%~50%为2分,>50%为3分。将2项得分相乘,总分为0~2分判断为阴性表达,总分>3分判断为阳性表达;其中,3~6分为弱阳性表达(+),>6分为强阳性表达(++)。
1.4
原位荧光杂交法检测PTEN表达
所有标本均经过4%中性甲醛溶液固定后,用石蜡包埋,2.5 μm厚度连续切片。通过脱蜡、复水后,用双蒸水煮片3 min,再经洗涤和脱水后,将胃蛋白酶工作液覆盖于组织上进行消化。然后滴加PTEN探针10 μL覆盖于组织上,85 ℃变性5 min,37 ℃杂交仪中反应过夜;次日洗涤后,滴加DAPI染液覆盖于组织上;400倍光学显微镜下观察组织染色情况,1 000倍视野下进一步观察PTEN基因荧光缺失状况。
结果判定:正常的间期细胞内CSP PTEN探针表现为2个红色荧光信号;CSP10探针表现为2个绿色荧光信号。在高倍荧光显微镜视野下观察100个细胞内红色荧光信号与绿色荧光信号的数量。当红色只有1个信号点时,判定为杂合子缺失;无红色信号点时,判定为纯合子缺失。计算2种缺失的比值,当杂合子缺失所占比值>20%,或纯合子缺失>30%时,判定为PTEN信号缺失阳性。
1.5
随访
查阅患者病历,对所有患者或其家属进行电话随访,最终获得98例随访资料。随访截止时间为2020年1月,所有患者随访时间为12~24个月。
1.6
统计学方法
采用SPSS 17.0软件对数据进行统计学分析。计数资料以率来表示,采用χ2检验。PI3K和GSK-3&β;表达之间的相关性采用Pearson相关分析。采用Kaplan-Meier生存曲线及COX比例风险回归模型对总生存期和预后因子的单-多因素进行分析。以P<0.05为差异有统计学意义。
2 结 果
2.1
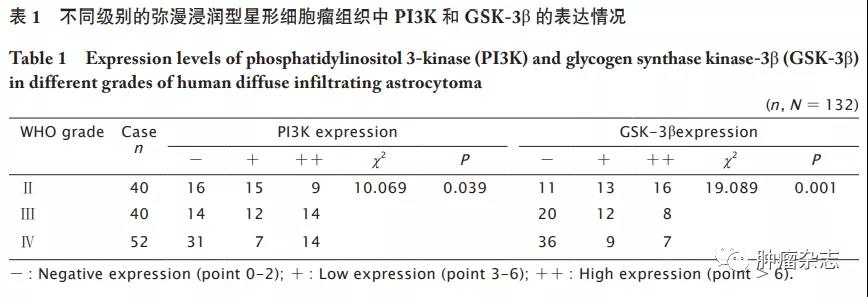
不同级别的弥漫浸润型星形细胞瘤中PI3K和GSK-3&β;的表达情况
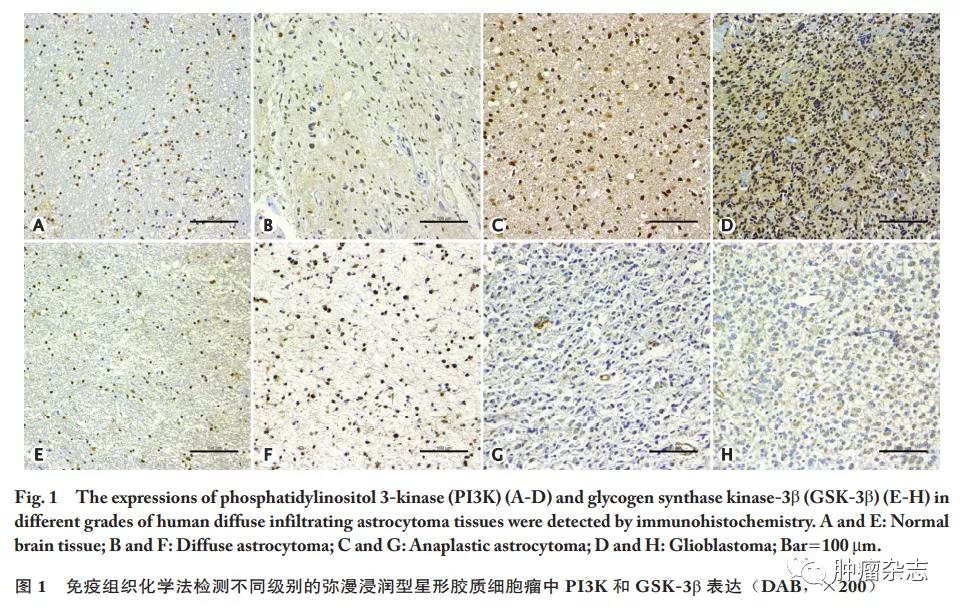
免疫组织化学检测结果显示:PI3K在正常脑组织中呈弱阳性表达(图1A),在弥漫型星形细胞瘤中的阳性表达率为60.0%(24/40)(图1B),在间变型星形细胞瘤中的阳性表达率为65.0%(26/40)(图1C),在胶质母细胞瘤中的阳性表达率为40.4%(21/52)(图1D);即随着WHO肿瘤级别的增高,PI3K的阳性表达率明显增高,差异具有统计学意义(P<0.05,表1)。相反地,GSK-3&β;在正常脑组织中呈强阳性表达(图1E),在弥漫型星形细胞瘤中的阳性表达率为72.5%(29/40)(图1F),在间变型星形细胞瘤中的阳性表达率为50.0%(20/40)(图1G),在成胶质细胞瘤中的阳性表达率为30.7%(16/52)(图1H);即随着WHO级别的增高,GSK-3&β;阳性表达率明显降低,差异有统计学意义(P<0.05,表1)。
2.2
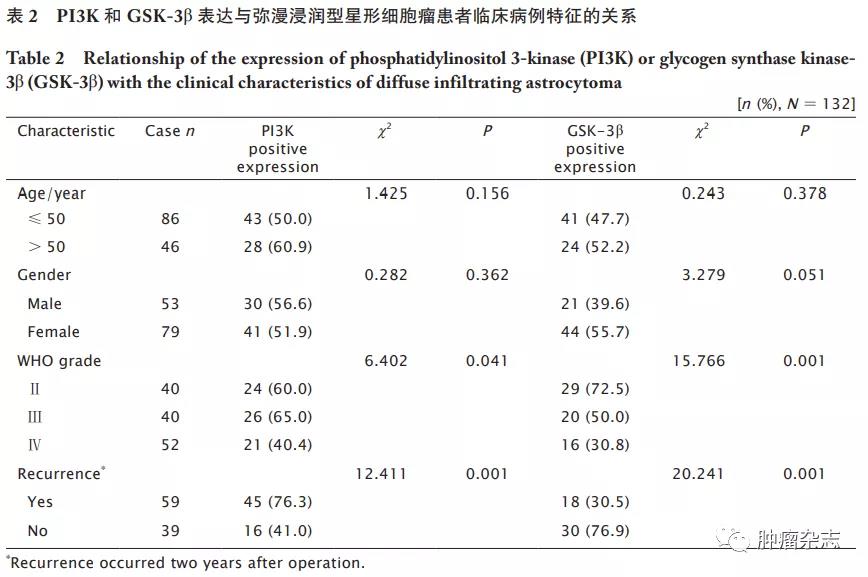
PI3K和GSK-3β与弥漫浸润型星形细胞瘤患者临床病理特征的关系
PI3K表达与肿瘤WHO分级和术后2年复发有明显相关性(P 值均<0.05,表2),而与患者年龄和性别无明显相关性(P 值均>0.05)。同样地,GSK-3β表达与肿瘤组织分级和术后2年复发有关(P 值均<0.05,表2),而与患者年龄和性别无明显相关(P 值均>0.05)。
2.3
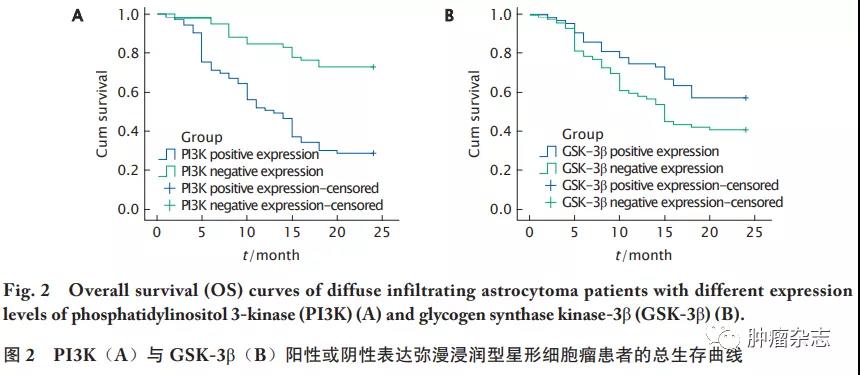
PI3K和GSK-3β的表达与弥漫浸润型星形细胞瘤患者预后的关系
Kaplan-Meier生存曲线分析结果表明,PI3K阳性的患者总生存率明显低于阴性患者(P<0.05,图2A),而GSK-3β阳性患者的总生存率明显高于阴性患者(P<0.05,图2B)。单因素分析结果显示,WHO分级、PI3K阳性表达和GSK-3β阴性表达与弥漫浸润型星形细胞瘤患者的预后显著相关(P 值均<0.05)。多因素分析结果显示,组织分级和PI3K阳性表达是影响弥漫浸润型星形细胞瘤患者预后的危险因素(P 值均<0.05,表3)。
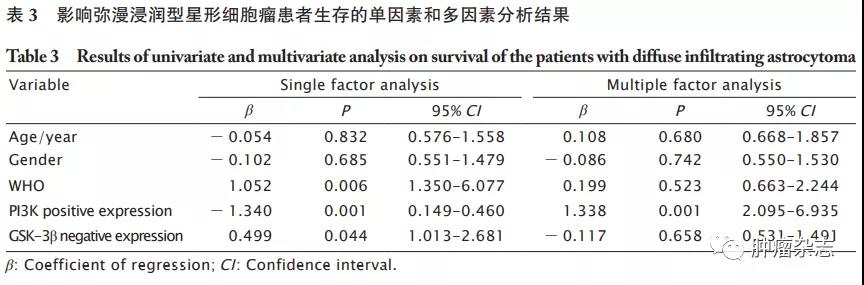
2.4
弥漫浸润型星形细胞瘤中PI3K和GSK-3β表达的相关性
Pearson相关性分析结果(表4)显示,弥漫浸润型星形细胞瘤中PI3K和GSK-3β表达呈负相关(r=-0.424,P<0.05)。

2.5
PTEN在弥漫浸润型星形细胞瘤中的表达
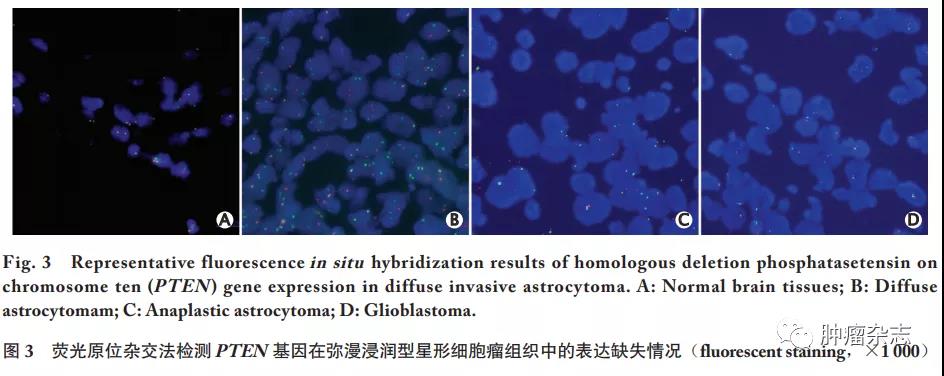
原位荧光杂交实验结果显示,正常对照脑组织中未见PTEN缺失(图3A),弥漫型星形细胞瘤中PTEN基因呈阴性(图3B),间变型星形细胞瘤中PTEN基因缺失率为45.0%(9/20)(图3C),胶质细胞瘤中PTEN基因缺失率为30.0%(6/20)(图3D)。
3 讨 论
弥漫浸润型星形细胞瘤是常见的颅内原发性肿瘤,占恶性脑肿瘤的81%。胶质母细胞瘤是最常见的弥漫浸润型星形细胞瘤(占弥漫浸润型星形细胞瘤的45%),患者5年相对生存率为5%[1]。目前治疗弥漫浸润型星形细胞瘤的方法主要有手术、放疗和化疗。近年来,尽管治疗方法有所进步,但治疗效果欠佳。弥漫浸润型星形细胞瘤呈高度浸润性生长,可浸润周围组织,手术很难完全切除肿瘤,因此寻找有效的标志物和干预靶点势在必行。GSK-3β可通过控制糖原代谢和调节糖原的合成,影响线粒体的通透性和细胞色素C的释放,从而调节细胞凋亡[2-3]。有研究证明,GSK-3β是一种位于许多信号通路交叉路口的激酶,这些信号通路在多种恶性肿瘤中都有涉及[4-5]。有研究表明,PI3K/AKT/GSK-3β信号通路在调节细胞凋亡、细胞增殖、血管生成、转移、上皮-间质转化等多种细胞生物学功能中发挥重要作用[6]。
相关研究发现,PI3K和GSK-3β与多种肿瘤的发生和发展有着密切联系。本研究采用免疫组织化学法检测了132例弥漫浸润型星形细胞瘤中PI3K和GSK-3β的表达情况,结果显示PI3K表达随着WHO级别的增高而增高,而GSK-3β表达随着WHO级别的增高而降低,表明PI3K和GSK-3β的异常表达参与了弥漫浸润型星形细胞瘤的发生和发展。本研究结果还表明,PI3K和GSK-3β不同表达状态的患者在组织分级和术后2年复发情况方面,差异均具有统计学意义(P 值均<0.05)。PI3K阳性表达和GSK-3β阴性表达的患者多出现在WHOⅢ级和WHOⅣ级中,且术后2年复发情况更高,这些均可能是影响弥漫浸润型星形细胞瘤患者预后的危险因素;而PI3K和GSK-3β表达状态与患者的年龄和性别无明显相关性。
另外,本研究结果显示,PI3K阳性表达和GSK-3β阴性表达患者的生存期比PI3K阴性表达和GSK-3β阳性表达患者的生存期更短。以往有研究表明,PI3K信号通路是由生长因子或细胞因子配体如表皮生长因子或胰岛素结合后,细胞质膜受体酪氨酸激酶激活启动[7-8],配体结合诱导受体细胞质区酪氨酸残基的自磷酸化,然后作为PI3K的结合位点,导致PI3K的激活,而PI3K激活最终导致AKT的磷酸化和活化。AKT可以磷酸化多种蛋白,包括GSK-3β抑制区域的氨基末端丝氨酸残基,该位点的磷酸化导致GSK-3β活性的抑制。正常情况下,GSK-3β的作用是维持关键细胞周期调节因子的非活性状态,如细胞周期蛋白D(cyclin D)和c-Myc[9]。因此,AKT介导的GSK-3β磷酸化可以被激活,以此来控制肿瘤细胞增殖和凋亡。与此同时,本研究中单因素和多因素回归分析结果表明,PI3K和GSK-3β的不同表达均是影响患者预后的因素,且PI3K和GSK-3β表达呈负相关性,提示两者共同在弥漫浸润型星形细胞肿瘤的发生和发展过程中发挥作用。因此,两者可以成为治疗弥漫浸润型星形细胞肿瘤的新靶点。另外,也可以通过检测PI3K和GSK-3β在弥漫浸润型星形细胞肿瘤中的表达来检测疾病预后。
荧光原位杂交实验检测结果显示,WHOⅢ级和WHOⅣ级的弥漫浸润型星形细胞肿瘤中会出现PTEN基因信号缺失,但在WHOⅡ级的弥漫浸润型星形细胞肿瘤患者和正常脑组织中没有发现PTEN基因的缺失情况,说明PTEN基因缺失情况是随着弥漫浸润型星形细胞肿瘤级别的增高而更为明显。PTEN作为一种常见的抑癌基因和脂质磷酸酶,将PI3K磷酸化产生的泌乳素诱导蛋白3(prolactin inducible protein 3,PIP)转化为PIP2,直接拮抗PI3K信号通路的激活[10-11]。PTEN缺失会使PIP3水平缺乏调节,促进PI3K通路的过度激活,从而导致细胞转化和肿瘤发生;而且在胶质母细胞瘤中发现的PTEN频繁突变,为发现肿瘤抑制因子提供了关键数据,功能缺失的PTEN表达往往导致干细胞生态位维持和增殖的改变[12]。已有研究表明,PTEN缺失的功能后果是细胞自我更新能力增强、G0~G1细胞周期进展,以及神经干细胞/祖细胞生长因子依赖性降低;PTEN基因缺失还能导致具有自我更新能力的神经功能库增加,并促进细胞增殖。因此,PTEN缺失会导致肿瘤细胞增殖,促进肿瘤生长[13-14]。
综上所述,PI3K、GSK-3β和PTEN的异常表达都参与了弥漫浸润型星形细胞肿瘤的发生与发展,其中PI3K和GSK-3β与患者预后有一定关系,这为临床预后的评估提供了一定的线索。
更多《肿瘤》杂志文章,请访问以下网址:
https://navi.cnki.net/knavi/JournalDetail?pcode=CJFD&pykm=ZZLL
参考文献
[1]Shuang D, Yan Y, Xu ZJ, et al. SCD1 confers temozolomide resistance to human glioma cells via the Akt/GSK3β/β-Catenin signaling axis[J]. Front Pharmacol, 2018, 8:960-972.
[2]JING W, LI L, TANG H, et al. Human herpesvirus 6 U94 suppresses tumor cell proliferation and invasion by inhibiting Akt/GSK3β signaling in glioma[J]. Transl Cancer Res, 2018, 7(6):1694-1702.
[3]MARTIN SA, SOUDER DC, MILLER KN, et al. GSK3β regulates brain energy metabolism[J]. Cell Rep, 2018, 23(7):1922-1931.
[4]DAI S, YAN Y, XU ZJ, et al. Corrigendum: SCD1 confers temozolomide resistance to human glioma cells via the Akt/GSK3β/β-catenin signaling axis[J]. Front Pharmacol, 2019, 10:1358.
[5]赵 婧, 李 强, 何 玲. PI3K/Akt/GSK-3β通路在体外培养神经元缺氧缺血损伤中的作用[J]. 重庆医学, 2019, 48(1):24-28.
[6]WANG Y, PAN P, WANG Z, et al. β-catenin-mediated YAP signaling promotes human glioma growth[J]. J Exp Clin Cancer Res, 2017, 36(1):136-147.
[7]LIU C, WU H, LI Y, et al. SALL4 suppresses PTEN expression to promote glioma cell proliferation via PI3K/AKT signaling pathway[J]. J Neurooncol, 2017, 135(1):263-272.
[8]ZHAO K, ZHANG C,YUE B, et al. Antiglioma effects of cytarabine on leptomeningeal metastasis of high-grade glioma by targeting the PI3K/Akt/mTOR pathway[J]. Drug Des Devel Ther, 2017, 11:1905-1915.
[9]TIAN X, ZHOU D, CHEN L, et al. Polo-like kinase 4 mediates epithelial–mesenchymal transition in neuroblastoma via PI3K/Akt signaling pathway[J]. Cell Death Dis, 2018, 9(2):54-68.
[10]李 磊, 罗 韬, 葛 佳, 等. 胶质瘤1p/19q共缺失FISH检测的关键技术[J]. 临床与实验病理学杂志, 2019, 35(4):107-109.
[11]PAN Y, BUSH EC, TOONEN JA, et al. Whole tumor RNA-sequencing and deconvolution reveal a clinically-prognostic PTEN/PI3K-regulated glioma transcriptional signature[J]. Oncotarget, 2017, 8(32):52474-52487.
[12]KOSCHMANN C, Farooqui Z, KASAIAN K, et al. Multi-focal sequencing of a diffuse intrinsic pontine glioma establishes PTEN loss as an early event[J]. NPJ Precisi Oncol, 2017, 1(1):32-36.
[13]MA J, BENITEZ JA, LI J, et al. Inhibition of nuclear PTEN tyrosine phosphorylation enhances glioma radiation sensitivity through attenuated DNA repair[J]. Cancer Cell, 2019, 35(5):816-855.
[14]STILES B, GROSZER M, WANG S, et al. PTENless means more [J]. Dev Biol, 2004, 273(2):175-184.