SARS-CoV-2 S蛋白糖基化如何影响疫苗和药物研发
由SARS-CoV-2引起的COVID-19大流行已感染全球超过1.6亿人。研究人员将SARS-CoV-2结构蛋白作为研究目标,以更好地对抗大流行。新冠病毒包含四种结构蛋白:刺突(S)、膜(M)、包膜(E)和核衣壳(N)蛋白,其中S、M和E蛋白是糖基化蛋白,而N蛋白是磷酸化蛋白。S蛋白的糖基化研究已被多个研究小组报道,这些知识有助于制药行业开发疫苗和药物。在美国,目前有三种获得批准的COVID-19疫苗。所有疫苗都使用S蛋白来诱导宿主细胞做出免疫反应。除疫苗外,研究人员还在开发抗病毒药物和免疫抑制剂的治疗方法。根据COVID-19感染的严重程度,需要不同的治疗方法。目前可用的治疗方案并非源自对SARS-CoV-2糖基化的了解。然而,对蛋白糖基化及其如何影响SARS-CoV-2和宿主细胞结合的研究可能会使我们发现新的、更有效的治疗方法。在此,我们简述了目前可供公众使用以及仍在开发中的COVID-19疫苗和治疗方法。

介绍
各个制药企业在疫苗和治疗方法的开发中发挥着关键作用,在2019年底SARS-CoV-2出现并迅速引起全球大流行之后,这一点变得更加重要。SARS-CoV-2感染导致COVID-19,这是一种呼吸道疾病,可导致严重疾病和死亡。COVID-19大流行要求将药物研发工作迅速转向疫苗和药物的开发。此外,科学界付出了巨大努力来研究有关病毒和COVID-19的数据,以便在这场全球公共卫生危机中加快疫苗或药物的上市时间。
为了对抗病毒,科学家们研究了SARS-CoV-2的结构蛋白和有助于病毒进入宿主细胞的宿主细胞受体。SARS-CoV-2有四种关键结构蛋白:刺突(S)、膜(M)、包膜(E)和核衣壳(N)蛋白(如下图1)。S蛋白高度糖基化,具有22个潜在的糖基化位点。计算机模拟实验与之前有关人类冠状病毒糖基化的研究结果是吻合的,M和E蛋白都可能是带有N糖基化的。M蛋白有8个N-糖基化位点,其中6个与SARS-CoV-1的M蛋白相同。M蛋白用于逃避宿主细胞免疫反应,对冠状病毒的感染过程很重要。E蛋白有两个可能的N-糖基化位点。E蛋白诱导S蛋白的表达,并且E和M蛋白都能够调节S蛋白在细胞内转移和加工。 N蛋白位于病毒的核衣壳中,不像其他结构蛋白那样进入分泌途径。因此,已发现天然N蛋白被磷酸化但未被糖基化。在功能上,N蛋白有助于病毒进入宿主细胞,与病毒RNA基因组结合并形成核蛋白的核心。
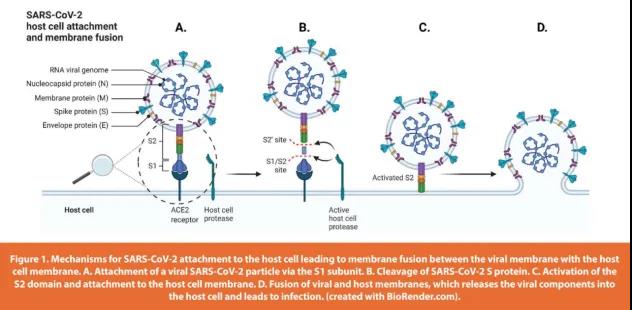
鉴于S蛋白的关键作用,科学家已经对病毒S蛋白进行了非常详细的研究。它与宿主细胞受体结合,并被宿主蛋白酶激活,导致病毒融合和内吞作用。S蛋白高度糖基化,并附着在人血管紧张素转化酶2(hACE2)和细胞表面糖胺聚糖(GAG) 上,这是一个相对孤立的过程,二者结合起来促进病毒附着到宿主细胞表面(如上图1)。所有四种结构蛋白都可以表达,以有效生成病毒样颗粒(VLP)。VLP是类似于病毒结构的纳米结构,是研究疫苗的有效工具。
由于处理病毒需要更多的预防措施,例如高成本设备和在更高生物安全水平的设施中工作,因此在大流行开始时很难研究这些数据。因此,大多数研究都是针对重组SARS-CoV-2蛋白及其糖基化进行的。许多研究人员都对S蛋白糖基化进行了研究,但是这些研究结果却显示出差异。这种差异是由于所有研究小组都使用了不同的重组S蛋白。重组S蛋白的供应商可能会替换所使用的氨基酸序列来有效地稳定表达重组蛋白,这可能会导致不同的N-糖基化。此外,全长S蛋白与其亚基的表达也会导致糖基化差异。最近的一项研究表明了野生型病毒S蛋白和重组S蛋白之间的糖基化差异。因此,在开发针对SARS-CoV-2糖基化结构或在宿主中的结合靶标的疫苗和药物时,应考虑糖基化的差异。
COVID-19疫苗
为了抗击大流行,各国政府采取了相应的防疫措施。药物干预也是科学家研究的重要选择,有两类医疗干预对于传染病防治很重要:疫苗和药物治疗,前者是一种保护措施或免疫过程,为了防止特定疾病的发生或发展,再就是药物治疗,以清除病毒传染病,从而恢复健康。
迄今为止,针对COVID-19开发的疫苗是预防性的,可供广大人群使用,并触发免疫反应以产生针对SARS-CoV-2上存在的抗原抗体。用于SARS-CoV-2疫苗的抗原靶标是前面提到的结构蛋白——主要是S蛋白。
在美国,目前有三种COVID-19疫苗具有FDA)的紧急使用授权(EUA)。它们已被授权针对COVID-19进行主动免疫,以降低感染的可能性并在发生SARS-CoV-2感染时预防严重的疾病。这些批准的疫苗使用信使RNA(mRNA)或病毒载体。
mRNA是蛋白质生成的模板,就mRNACOVID-19疫苗而言,它们教会细胞如何复制SARS-CoV-2 S蛋白。优点是人体细胞会产生S蛋白并将其糖基化,这与实际感染期间发生的情况完全相同。这会触发免疫反应,产生抗体以保护个人在以后接触病毒时不会被感染(如下图2)。
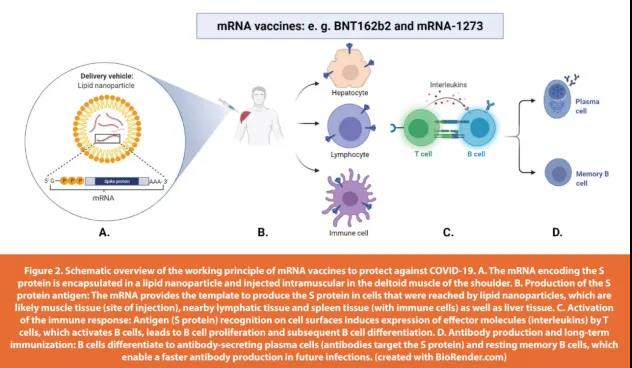
BNT162b2,更广为人知的名称是辉瑞-BioNTechCOVID-19疫苗,是一种基于mRNA的疫苗,可全长编码SARS-CoV-2 S蛋白,并通过两个脯氨酸突变进行修饰,从而将S蛋白在与宿主细胞融合之前,锁定在正确的构象中。在美国授权紧急使用的另一种mRNA疫苗是mRNA-1273,更为人所知的是Moderna疫苗。与BNT162b2类似,它通过两个脯氨酸改变以稳定融合前S蛋白的构象。Pfizer-BioNTech和Moderna疫苗都需要接种两剂,在接种两剂后的有效性为(有效性:BNT162b2 95%,mRNA 1273 94.1%)。目前mRNA疫苗的临床试验基于接受两种疫苗剂量的患者。在初始剂量后,在最初几周内有微弱的免疫反应。在接种第二剂疫苗后,观察到更强的免疫反应。仅接受第一剂的负面影响是部分免疫后,可能导致SARS-CoV-2疫苗抗性变体的出现,类似于抗生素的耐药性。此外,没有结果表明仅使用初始剂量即可对COVID-19感染产生长期免疫力。
病毒载体疫苗利用已建立的病毒系统(也称为载体)向细胞传递指令。载体不是SARS-CoV-2病毒,而是一种不同的、无害的病毒,它通过去除致病基因进行了修饰。然后在载体中编码用于产生SARS-CoV-2病毒S蛋白的遗传指令。一旦这些载体进入宿主细胞,遗传物质就会被宿主细胞机制转化,导致宿主细胞在其表面表达S蛋白。这允许免疫系统识别S蛋白并触发免疫反应和抗体产生。载体疫苗,如mRNA疫苗,不会导致COVID-19感染(如下图3)。
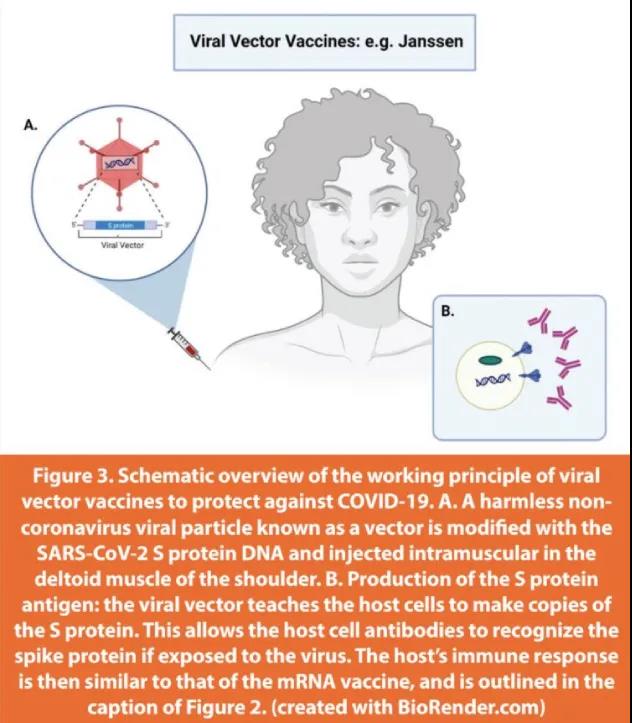
在美国获得EUA授权的第三种COVID-19疫苗是JNJ-78436735,由强生公司的Janssen制造。它属于病毒载体疫苗类别,只需注射一次。据报道,预防COVID-19的功效为66.3%,但它表明,预防需要住院治疗的COVID-19严重病程的功效甚至更高——估计在93.1%至100%之间。
除了mRNA和病毒载体疫苗,其他疫苗类型目前正在临床试验中或在其他国家获得批准。与病毒载体疫苗不同,减毒疫苗是病毒的弱化版本,能够在体内复制,从而导致机体产生免疫反应。
另一种选择是基于化学灭活病毒的疫苗。在这种情况下,免疫反应将针对多种SARS-CoV-2抗原,而不仅仅是S蛋白。另一种疫苗类型基于SARS-CoV-2蛋白的子单元疫苗,特别是S蛋白。这些疫苗使用S蛋白或其片段和佐剂来引发免疫反应。基于DNA的疫苗通常用于兽医,目前未用于人类。然而,这种疫苗类型也正在被研究作为人类SARS-CoV-2疫苗开发的潜在策略。基于DNA的疫苗进入宿主细胞并诱导细胞产生目标蛋白,这模拟了抗体的产生。
COVID-19治疗
虽然理想情况下,大部分风险都可以进行预防,但从统计上讲,由于病情严重,一小部分患有COVID-19的患者需要额外的治疗。在COVID-19的早期阶段,该疾病是由SARS-CoV-2复制驱动的。在后期阶段,机体的失调和增强的炎症反应会导致组织损伤。因此,抗病毒疗法被认为在疾病的早期阶段具有最大的效果,而具有免疫抑制特征的药物干预在疾病的后期阶段应具有最大的效果。因此,COVID-19患者的症状越严重,可用的治疗方案就越具体,我们将在下面概述。
口服抗病毒药物具有预防和治疗的双重特性。理想情况下,抗病毒药物的目标是由病原体而非宿主呈现的特性,例如冠状病毒S蛋白。这些药物在怀疑或确认接触病毒后给药,以防止疾病发作或最大限度地减少病毒载量。正在开发与人类抗体结合的可溶性hACE2,以预防SARS-CoV-2感染。可溶性ACE2作为预防急性肺损伤的一种手段是在第一次SARS-CoV-1流行期间首次设想的。冠状病毒已经进化为利用细胞ACE2进行S蛋白结合和由此产生的感染。引入可溶性ACE2导致SARS-CoV-2 S蛋白与可溶性ACE2结合,然后可以阻止SARS-CoV-2与细胞ACE2结合。此外,研究表明宿主细胞表面肝素(Hp)和硫酸乙酰肝素(HS)对S蛋白结合至关重要。Hp和HS是一类具有抗血栓形成特性的GAG。GAG是线性多糖,共价结合到细胞表面和细胞外基质中的蛋白质骨架上。在测试各种GAG和GAG样结构时,肝素、硫酸乙酰肝素和岩藻依聚糖样结构能够与细胞表面GAG竞争SARS-CoV-2,其中岩藻依聚糖样结构最有效。Hp/HS是高度硫酸化的异质多糖,具有抗凝特性。目前,Hp被用于治疗由COVID-19引起的血栓形成。褐藻糖胶还具有抗血栓形成的特性,与Hp/HS一样,是硫酸化的。与线性GAG不同,岩藻依聚糖可以是支化的。岩藻依聚糖样结构的有效性可能是由于这些分支,这将导致比线性结构更多的多价相互作用可能性。这些发现仍然需要在临床环境中进行测试。
治疗COVID-19的另一种选择是施用中和抗体(nAb)。它们可以阻断病毒与宿主细胞受体之间的相互作用并支持病毒的清除,类似于抗病毒药物。然而,nAb仅在疾病严重程度增加时使用,因此仅适用于少数患者。FDA已发布EUA用于几种单克隆抗体治疗,适用于患严重COVID-19的风险较高的患者。单克隆抗体(mAb)是实验室制造的,对病毒的反应更有效(如下图4)。mAb具有高度特异性和选择性,并且通常在片段Fc区域进行糖基化。糖基化调节病毒与mAb的Fc区的结合。了解目标病毒的糖基化模式对于开发有效的抗体治疗方法至关重要。
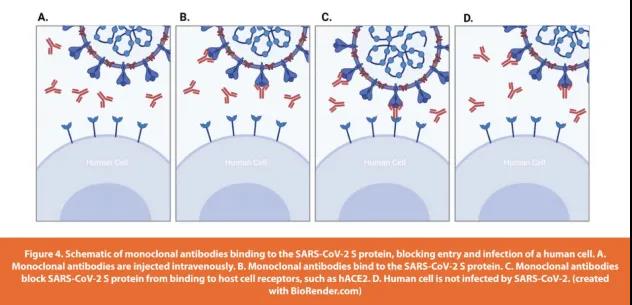
如果患者出现更严重的COVID-19症状并需要住院治疗,则下一级别的治疗选择包括静脉注射抗病毒药物。考虑到疾病的严重性、对有执照的人员静脉给药的要求以及更显着的不良反应的可能性,接受这种治疗的患者较少。目前,只有一种静脉内抗病毒药物被FDA批准用于COVID-19治疗;Remdesivir是一种RNA依赖性RNA聚合酶抑制剂,已知对SARS-CoV-1和中东呼吸综合征(MERS-CoV)具有抑制活性。与未接受治疗的患者相比,瑞德西韦治疗导致COVID-19患者的康复时间更短(分别为10天和15天)。与未接受治疗的患者相比,接受瑞德西韦治疗的患者的死亡率也有所降低(第15天分别为6.7%和11.9%)。
在下一阶段的药物干预中,免疫系统反应过度(也称为“细胞因子风暴”)的住院患者可以使用免疫调节药物进行治疗。因为只有一小部分COVID-19患者会发生这种免疫反应,所以只有极少数患者接受这种治疗。
由于最严重的COVID-19病例中的全身炎症与细胞因子升高有关,例如白细胞介素(IL;如上图2C),IL水平的药理学调节被认为是减少COVID-19持续时间和严重程度的有希望的途径。 FDA已批准使用单克隆抗体进行治疗,这些抗体要么结合IL本身,如白细胞介素6(IL-6),要么结合IL受体,从而阻断相互作用。目前的治疗指南建议将靶向IL-6受体的单克隆抗体与地塞米松联合使用。地塞米松是一种皮质类固醇,可降低免疫系统对疾病的反应,从而减轻症状。使用地塞米松治疗接受通气的住院COVID-19患者时,死亡率降低;然而,在不使用呼吸机的情况下则不会出现这种情况。这表明地塞米松对需要呼吸支持的具有严重COVID-19症状的患者有益,但该药物对未接受呼吸支持的患者没有益处。
展望
自COVID-19大流行开始以来,研究人员一直在努力尽可能多地了解SARS-CoV-2和由此产生的COVID-19疾病,以制定预防和治疗方案。疫苗是首选的工具,因为它们可以预防人群感染。SARS-CoV-2的S蛋白是大多数开发疫苗的重点,因为它在宿主细胞的SARS-CoV-2感染中起着至关重要的作用。目前在美国批准的疫苗利用S蛋白的模板来临时教导宿主细胞如何产生蛋白质,以便在发生感染时为宿主的免疫系统做好准备。虽然目前可用的疫苗是在没有考虑糖基化更深层次作用的情况下开发的。
除了预防措施外,还需要治疗方案来帮助那些无法接种疫苗或在接种疫苗后仍感染COVID-19的人。对于早发性COVID-19病例,抗病毒药物治疗有效,而对于重症和危重COVID-19病例,免疫抑制剂更有效。糖基化的ACE2通过与病毒S蛋白结合促进SARS-CoV-2病毒进入。S蛋白还与细胞表面GAG结合,进一步促进病毒进入宿主细胞。用可溶性ACE2治疗可以减少病毒感染,防止S蛋白与细胞ACE2结合。同样,用Hp/HS或类似岩藻多糖的结构处理可以作为竞争性结合剂,防止S蛋白与细胞表面GAG结合。大多数SARS-CoV-2和COVID-19疗法不需要SARS-CoV-2糖基化的背景知识。然而,了解SARS-CoV-2结构蛋白和宿主细胞受体的糖基化可能会找到更有效的治疗方法。
参考:
1、Ge HP, Wang XF, Yuan XN, et al. The epidemiology and clinical information about COVID-19. Eur J Clin Microbiol. 2020;39(6):1011-1019.
2、Gibson PG, Qin L, Puah SH. COVID-19 acute respiratory distress syndrome(ARDS): clinical features and differences from typical pre-COVID-19 ARDS. Med J Aust. 2020;213(2):54-56 e1.
3、Duart G, García-Murria MJ, Grau B, et al. SARS-CoV-2 envelope protein topology in eukaryotic membranes. Open biology. 2020;10(9):200209.
4、Thomas S. The structure of the membrane protein of SARS-CoV-2 resembles the sugar transporter semiSWEET. Pathog Dis. 2020;5(1):342.
5、Dawood AA. Glycosylation, ligand binding sites and antigenic variations between membrane glycoprotein of COVID-19 and related coronaviruses. Vacunas. 2021;22(1):1-9.
6、De Haan CA, De Wit M, Kuo L, et al. The glycosylation status of the murine hepatitis coronavirus M protein affects the interferogenic capacity of the virus in vitro and its ability to replicate in the liver but not the brain. 2003;312(2):395-406.
7、Locker JK, Griffiths G, Horzinek M, Rottier PJJoBC. O-glycosylation of the coronavirus M protein. Differential localization of sialyltransferases in N-and O-linked glycosylation. 1992;267(20):14094-14101.
8、Oostra M, De Haan C, De Groot R, Rottier PJJov. Glycosylation of the severe acute respiratory syndrome coronavirus triple-spanning membrane proteins 3a and M. 2006;80(5):2326-2336.
9、Yokomori K, La Monica N, Makino S, Shieh C-K, Lai MMC. Biosynthesis, structure, and biological activities of envelope protein gp65 of murine coronavirus. Virology. 1989;173(2):683-691.
10、Fu Y-Z, Wang S-Y, Zheng Z-Q, et al. SARS-CoV-2 membrane glycoprotein M antagonizes the MAVS-mediated innate antiviral response. Cellular & Molecular Immunology. 2021;18(3):613-620.
11、Boson B, Legros V, Zhou B, et al. The SARS-CoV-2 envelope and membrane proteins modulate maturation and retention of the spike protein, allowing assembly of virus-like particles. J Biol Chem. 2021;296:100111.
12、Supekar NT, Shajahan A, Gleinich AS, et al. Variable post-转录 modifications of SARS-CoV-2 nucleocapsid protein. Glycobiology. 2021;In press
13、Rahman MS, Islam MR, Alam ASMRU, et al. Evolutionary dynamics of SARS-CoV-2 nucleocapsid protein and its consequences. https://doi.org/10.1002/jmv.26626. J Med Virol. 2021;93(4):2177-2195.
14、Zeng W, Liu G, Ma H, et al. Biochemical characterization of SARS-CoV-2 nucleocapsid protein. Biochem Biophys Res Commun. 2020;527(3):618-623.
15、Morse JS, Lalonde T, Xu S, Liu WR. Learning from the Past: Possible Urgent Prevention and Treatment Options for Severe Acute Respiratory Infections Caused by 2019-nCoV. ChemBioChem. 2020;21(5):730-738.
16、Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020;579(7798):270-273.
17、Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181(2):271-280 e8.
18、Shajahan A, Supekar NT, Gleinich AS, Azadi P. Deducing the N- and O-glycosylation profile of the spike protein of novel coronavirus SARS-CoV-2. Glycobiology. 2020;30(12):981-988.
19、Watanabe Y, Berndsen ZT, Raghwani J, et al. Vulnerabilities in coronavirus glycan shields despite extensive glycosylation. Nat Commun. 2020;11(1):2688.
20、Walls AC, Park YJ, Tortorici MA, et al. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020;183(6):1735-1735.
21、Watanabe Y, Allen JD, Wrapp D, McLellan JS, Crispin M. Site-specific glycan analysis of the SARS-CoV-2 spike. Science. 2020;369(6501):330-+.
22、Clausen TM, Sandoval DR, Spliid CB, et al. SARS-CoV-2 Infection Depends on Cellular Heparan Sulfate and ACE2. Cell. 2020;183(4):1043-1057.e15.
23、Kwon PS, Oh H, Kwon S-J, et al. Sulfated polysaccharides effectively inhibit SARS-CoV-2 in vitro. Cell Discov. 2020;6(1):1-4.
24、Kim SY, Jin W, Sood A, et al. Characterization of heparin and severe acute respiratory syndrome-related coronavirus 2(SARS-CoV-2) spike glycoprotein binding interactions. Antivir Res. 2020;181:104873.
25、Shajahan A, Archer-Hartmann S, Supekar NT, et al. Comprehensive characterization of N- and O-glycosylation of SARS-CoV-2 human receptor angiotensin converting enzyme 2.Glycobiology. 2021;31(4)
26、Zhang Y, Zhao W, Mao Y, et al. Site-specific N-glycosylation characterization of recombinant SARS-CoV-2 spike proteins. Molecular & Cellular Proteomics. 2021;20:100058.
27、Pritchard LK, Vasiljevic S, Ozorowski G, et al. Structural constraints determine the glycosylation of HIV-1 envelope trimers. Cell reports. 2015;11(10):1604-1613.
