hCG 人绒毛膜促性腺激素
一、人绒毛膜促性腺激素的基本性状
hCG由α和β二聚体的糖蛋白组成。分子量为36700的糖蛋白激素,α亚基与垂体分泌的FSH(卵泡刺激素)、LH(黄体生成素)和TSH(促甲状腺激素)等基本相似,故相互间能发生交叉反应,而β亚基的结构各不相似。CAS号:9002-61-3 MDL号:MFCD00130797 EINECS号:232-660-2 RTECS号:MD6953000 溶解度 H2O: soluble1ML/vial 溶解性 易溶于水,不溶于乙醇、乙醚等有机溶剂。
正常值:hCG<50mU/ml;&β;-hCG<20mU/ml。
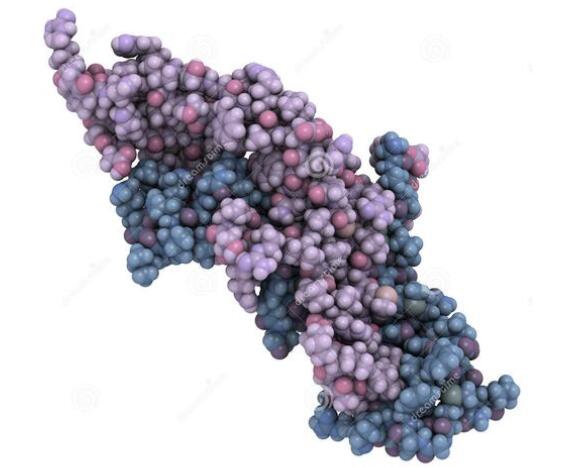
二、人绒毛膜促性腺激素的分子结构
hCG(人绒毛膜促性腺激素) 是由胎盘滋养层细胞分泌的糖蛋白类激素, 其分子量38KD, 碳水化合物约占其分子量的30%, 由一条α链和一条β链以非共价健结合在一起形成二聚体结构, 其中α链含92个氨基酸残基, β链含145个氨基酸残基, α链与其他糖蛋白激素, 如FSH(卵泡刺激素) 、TSH(促甲状腺素) 和LH(黄体生成素) 中的α链相同, β链具有特异性, 决定了hCG的生物学活性和免疫学特性。合子形成后1周内, 滋养层细胞即产生hCG取代LH的作用, 刺激黄体产生大量的孕酮, 这对维持妊娠是至关重要的。中和hCG的生物学活性能使黄体退化, 孕激素下降, 子宫内膜脱落、出血, 妊娠以月经来潮的方式被终止。20世纪70年代WHO(世界卫生组织) 生育控制疫苗组即着手研制hCG避孕疫苗, 以全β链为免疫原的避孕疫苗已完成二期临床试验, 尚未解决的问题是抗体反应个体差别大, 无免疫后副反应的长期观察效果, 尤其是抗体与hLH的交叉反应仍未最后解决;以β-hCG-CTP(人绒毛膜促性腺激素β子单元C-未端肽109-145) 为免疫原的避孕疫苗正在瑞典进行二期临床试验, 它不与LH发生交叉反应, 但仍存在免疫原性较弱这一缺陷, 不能立即应用于临床。因此, 对hCG的结构和免疫原性的深入的认识, 有利于开发研制一个合适的避孕疫苗, 本文就hCG的结构和免疫原性研究进展综述如下。
2.1 hCG的初级结构
2.1.1 hCG α子单元的一级结构
Ala-Pro-Asp-Val-Gln-Asp-Cys-Pro-Glu-Cys-Thr-Leu-Gln-Glu-Asp-Pro-Phe-Phe-Ser-Gln-Pro-Gly-Ala-Pro-Ile-Leu-Gln-Cys-Met-Gly-Cys-Cys-Phe-Ser-Arg-Ala-Tyr-Pro-Thr-Pro-Leu-Arg-Ser-Lys-Lys-Thr-Met-Leu-Val-Gln-Lys-Asn-Val-Thr-Ser-Glu-Ser-Thr-Cys-Cys-Val-Ala-Lys-Ser-Tyr-Asn-Arg-Val-Thr-Val-Met-Gly-Gly-Phe-Lys-Val-Glu-Asn-His-Thr-Ala-Cys-His-Cys-Ser-Thr-Cys-Tyr-Tyr-His-Lys-Ser-COOH, α链中共有两个糖基结合位点:52Asn和78Asn;都是N-联糖。
2.1.2 hCG β子单元的一级结构
Ser-Lys-Glu-Pro-Leu-Arg-Pro-Arg-Cys-Arg-Pro-Ile-Asn-Ala-Thr-Leu-Ala-Val-Glu-Lys-Glu-Gly-Cys-Pro-Val-Cys-Ile-Thr-Val-Asn-Thr-Thr-Ile-Cys-Ala-Gly-Tyr-Cys-Pro-Thr-Met-Thr-Arg-Val-Leu-Gln-Gly-Val-Leu-Pro-Ala-Leu-Pro-Gln-Val-Val-Cys-Asn-Tyr-Arg-Asp-Val-Arg-Phe-Glu-Ser-Ile-Arg-Leu-Pro-Gly-Cys-Pro-Arg-Gly-Val-Asn-Pro-Val-Val-Ser-Tyr-Ala-Val-Ala-Leu-Ser-Cys-Gln-Cys-Ala-Leu-Cys-Arg-Arg-Ser-Thr-Thr-Asp-Cys-Gly-Gly-Pro-Lys-Asp-His-Pro-Leu-Thr-Cys-Asp-Asp-Pro-Arg-Phe-Gln-Asp-Ser-Ser-Ser-Ser-Lys-Ala-Pro-Pro-Pro-Ser-Leu-Pro-Ser-Pro-Ser-Arg-Leu-Pro-Gly-Pro-Ser-Asp-Thr-Pro-Ile-Leu-Pro-Gln-COOH, β链中既有N-联糖又有O-联糖, 共有6个糖基结合位点:13Asn和30Asn(N-联糖) , 121Ser、127Ser、132Ser和138Ser(O-联糖) 。
2.2 hCG的高级结构
α链是中含有10个Cys残基, 形成5个链内二硫键(7-31、10-60、28-82、32-84、59-87) ;β链中含有12个Cys残基, 形成6个链内二硫键(93-100、26-110、23-72、9-57、34-88、38-90) , 这些二硫键的存在决定了hCG的二级结构。α和β具有相似的构型, 表现在它们均具有特殊的半胱氨酸结(cystine-knot motif) 。hCG分子结构中螺旋结构很少, 仅α子单元的40-50序列中出现, 较多见的是β折迭和无规卷曲。具有特征性的结构是半胱氨酸结, 它由3条二硫键组成:2条反向平行的肽链借2条二硫键相连成一环状结构, 第3条二硫键从环中穿过。结的一侧是双股环状的β-折迭样结构(长环) , 另一侧是两个β-发夹样结构, β链中这些发夹样结构由23-72位二硫键相连, 每条链的C-端相邻位置上都有一对突出的β折迭(α62-65、β59-62、α79-82、β85-88) , β链中的β折迭突起有典型的氢键, 而在α链中则较简单。α链中的35-59、52-56形成β-折迭, 两段序列反向平行, 形成长环, 若将其打开至100°左右的角度, 可产生40-46序列的2个转角、3个螺旋, 52位的Asn也从α和β链的界面指向该残基上的N-联糖。而β链相应的长环张得很开, 两股主链间没有氢键相连, 该环的稳定靠侧链-主链间的氢键维持(Arg43-Pro50、Leu52、Gln54、Met41) , 环的一侧38-45肽序列因与α链相连得到支持。α和β具有相同的核心结构-半胱氨酸结, 所不同的是β链的发夹样结构展得较开, 而α链中的长环较大。α链的核心结构包含α17Phe、α18Phe、α25Ile、α68Val、α70Val、α71Met、α74Phe、α76Val, 3个苯丙氨酸聚集成团, 部分露出表面。β链的核心结构包含β16Leu、β18Val、β27Ile、β29Val、β67Ile、β69Leu、β80Val、β82Tyr, 它部分覆盖了23-72位的二硫键。α链中的两个发夹样结构基本一致, 不同的是在α15Asn位上侧链与主链17-18位上的-NH相连, 形成带状结构, 导致α16Pro、α17Phe和α18Phe突出肽链的表面形成奇特的“安全带”样结构, 而这对杂合二聚体的形成是必不可少的。
完整的hCG由大约双层折迭的肽链轴相连, 形成β-折迭的肽序列相互靠拢形成β-折迭桶β-barrel) , 桶壁由7条肽段组成, 分别是α33-38、α52-57、β30-37、β9-15、β84-90、β56-63、β97-102、β34-36肽序列位于杂聚体的中心, 对杂聚体的形成有很大的影响, 其四周有大量的氢键。反向平行的β折迭的短序列肽β44-46和α75-77帮助β链的长环连接于α链的发夹结构上。另外起作用的还有β44Val和β45Leu位上的硫水基团和α17、α18、α74位的苯丙氨酸三聚体。α和β的整体联系覆盖了两链间的4525A2的面积:其中α链覆盖了2134A2, β链2241A2, α子单元糖链部分占150A2尤以52位的Asn为著) 。β链的β90Cys-β110Cys借二硫键形成一环状结构, 该环包绕在α子单元周围, 同时借β9-90、β26-110的二硫键与β子单元以共价键相连, 呈现安全带样结构。带的内侧面相互平行的β折迭短序列肽段(β99-101、α53-57) 与α子单元紧密相连, 而α53-57肽序列是中心β-折迭桶的一部分。α单位的四肽侧链与安全带中侧链或主链上的原子互相作用, 侧链α35Arg与主链β106His, α56Glu与主链β104Lys之间分别有氢键相连。另外α37Tyr、β107Pro和β108Leu间, α54Tyr和β99Asp之间有分子间范德华力的交互作用, 二硫键β26-110只有在形成杂聚体时才形成。
糖链部分对hCG的结构影响不大, 用无水氢氟酸处理hCG使其脱去碳水化合物, 其园二色性等光学性质与完整的hCG分子相同, 它们具有相同的晶体结构。α链中糖链位于分子的末端, α52Asn位于双股肽链长环的末端, α78Asn位β-发夹的末端, 糖链部分与肽链间为数不多的几个氢键相连。β链中两个N-联糖暴露于两个相邻的β折迭肽链的表面, 相距不超过7A。唯一既与α单位相连又与β子单元相连的是α52Asn上的N-联糖, 它与β子单元中的β59Tyr、β62Val、β64Phe、β83Ala、β97Tyr相互接触。
借助化学修饰、点突变技术以及人工合成肽的竞争性抑制研究, 现已发现大量的氨基酸残基对hCG的生物功能的发挥起着重要的作用。β93-100对生物活性起决定作用, Cys93或Cys100的点突变可导致β子单元不能与α子单元相连;β38-57序列在结合hCG受体中起关键作用, 人工合成的该段肽序列能刺激小鼠甾体物质的产生, 强烈抑制受体与完整hCG的结合;α88-92也在结合受体方面发挥作用, 不含88-92肽序列的α子单元, 虽然能与β子单元结合, 产生具有生物活性的hCG二聚体, 但该杂聚体与受体的结合能力以及产生甾体物质的能力均较低。
2.3 hCG的抗原表位
20世纪70年代始进行hCG的人类避孕疫苗的研制, 促进了对hCG的免疫原性的研究。进入90年代该工作取得了很大的进展。1990年Berger等利用单抗技术发现hCG共有13个抗原表位, 其中α子单元上具有6个(α1-6) , β子单元上有7个(β1-7) , 其中α5、α6、α7为糖蛋白α链所特有, 它决定了α链的免疫特性。α6、β6和β7仅在游离的子单元上出现, 在完整的hCG分子中则不表达, 仅β1和β7是hCG所特有的抗原表位;1991年Schwarz等发现hCG分子中共有14个抗原表位, 其中α链上有5个(α1-5) 、β链上有5个(β1-5) , 其余4个(αβ1-4) 则仅在形成杂聚体时才表达。hCG的糖链部分不影响其免疫原性, 但对抗原抗体间的亲和力有一定的影响, 当hCG与受体结合后, 大部分抗原表位被受体分子(具有341个氨基酸残基) 所遮盖, 仅表达β3和β5两个表位。Dirnhofer于1993年和1994年进一步阐明了hCG分子的抗原表位情况:α、β肽链骨架共有16个抗原表位, β链上具有9个抗原表位(β1-9) , 其中β1-7表位位于核心片段(2-92, βhCG-CF:corefragment of β-子单元 of human chorionic gonadotropin) 上, 其余两个(β8和β9) 位于C-末端肽链上(βhCG-CTP:COOH-terminalpeptide of human chorionic gonadotropin) , 进一步对其一级结构的研究发现:α2、α4、α6、α7表位的氨基酸序列分别为11-18、17-22、33-42、87-92, β5、β8和β9表位的肽段氨基酸序列分别是45-52、137-144和113-116, 其余的9个表位(α1、α3、α5、β1、β2、β3、β4、β6、β7) 的氨基酸序列目前仍不甚明了目前认为, hCG分子中共有约20个抗原表位, 其中α链上7个(α1-α7) , β链上9个(β1-β9) , hCG二聚体上4个(C1-C4) , 大致可分为如下6类:①βhCG-CTP区(β8、β9) ;②βhCG、βhCG-CF以及hCG中共有, 免疫原性较高的表位(β1、β2、β3、β4、β5) , ③hCG二聚体表位(C1、C2、C3、C4) 。④βhCG、βhCG-CF共有而hCG二聚体中没有(β6、β7) ;⑤αhCG和hCG共有的表位(α1、α2、α3、α4、α5) ;⑥αhCG中具有而不存在hCG异聚体中的表位(α6、α7) 。当α、β链游离时, 表现α1-α7、β1-β916个表位, 两者结合形成二聚体时, α6、α7β6、β7表位消失, 而出现四个构象表位:C1-C4, 其中C1-C3与α1、α2、α4 6个表位融合在一起。对hCG分子抗原表位和结构的深入研究有助于开发一个合适的免疫原以作为避孕疫苗的靶抗原, 进一步推动hCG避孕疫苗的研制。
2.4 hCG的变体
2.4.1 规则分子的hCG
规则分子的hCG由α、β两个亚基组成,以非共价键结合的方式组成,它们有大约10%的氨基酸排列顺序相同并且有近似的交叉结构。α亚基和β亚基分别有5-6个二硫化合物网桥。两个亚基相互结合,但仍能显示出其具有的孤立性。β亚基是145个氨基酸残基组成的糖肽,其结构独特,决定了hCG与其它糖蛋白激素不同的生物学特性。α糖肽的氨基酸残基上有天冬酰胺酸链半糖基链相连,在β糖肽碳末端上有丝氨酸半糖基链相连,糖基总量占其分子量的35%,这些糖基使hCG成为一个特殊的糖蛋白,具有8个寡聚糖基侧链致使hCG分子有很大的异质性。规则分子的hCG具有生物学活性,即使用免疫学方法测出也用生物活性有关的每升国际单位(IU/L)表示,而下述的和hCG相关分子由于不存在生物活性多用重量(ng/ml)表示。规则分子的hCG具有以下生物学活性:
- 孕早期类似于LH(代替LH)促黄体功能。使其合成雌、孕激素直至孕 12周左右胎盘开始合成雌、孕激素;
- 促排卵;
- 1/400的TSH活性;
- 调节胎儿肾上腺产生硫酸脱氢表雄酮;
- 调节胎盘类固醇激素的合成,胎盘合体滋养细胞有hCG特异调节的腺苷酸环化酶;
- 促使睾丸间质细胞分化、肥大、增加雄激素的分泌(对无精症则无促生精作用);
- 非特异性的免疫抑制功能;
- 抑制垂体分泌LH、FSH。
在某种情况下,hCG的两个亚基也会以游离或非结合形式存在。
2.4.2 游离α-hCG
α亚基呈游离状态。α亚基的基因编码区位于第6号染色体的长臂,表达产物含92个氨基酸残基,分子量14.5Kda,由腺垂体和胎盘组织共同表达,与其他一些垂体激素LH、FSH、TSH的α亚基高度同源,氨基酸序列几乎完全相同。hCG游离α亚基在血、尿中多以两种形式存在:一是规则游离α亚基,是规则hCG的组成部分;二是大分子游离α亚基,这是一个高糖基化的α亚基,其连接的N联糖基结构比规则α亚基更大、更为复杂。这种α亚基不能与β亚基组成规则hCG,可能是其复杂的糖基结构阻碍了与β亚基的结合。
2.4.3 游离β-hCG
β亚基呈游离状态。hCG的β亚基的基因编码区位于第19号染色体的长臂,其表达产物含145个氨基酸残基。hCG的β亚基决定了hCG的特异性,它是决定整个hCG分子具有生物活性和免疫反应特异性的关键。尽管hCG的β亚基与LH的β亚基结构非常相似(在121个氨基酸分子中,有97个两者是完全相同的),但是β- hCG的特异性表现在它有丰富的丝氨酸,延伸成为具有羧基化末端(C-terminal)的缩氨酸(24个氨基酸)。这些羧基化末端的交叉结构能被特异性的抗体识别,进行免疫反应,而这种结构在LH分子中就很少,甚至一点也没有。末端抗体用于检测hCG就显示出其独特的重要性。
2.4.4 缺刻hCG等
其它能够用于识别的hCG的结构不多(低于20%),而且缺少生物学活性。残缺hCG,有α、β两个链,但是链中的氨基酸残基缺少。如在β亚基的47和48号氨基酸的位置上,有一个断开部,氨基酸缺损。最常见的断开部位为β链的47/48,有时也在43/44或44/45断裂。由于hCG特异的抗原决定簇位于β链羧基末端的最后30个氨基酸,所以缺刻hCG仍有hCG的免疫反应活性,用免疫方法难以分辨出。
2.4.5 缺刻游离βhCG
hCG游离β亚基在促性腺激素β亚基缺刻酶的作用下,也有规则与缺刻之分。规则游离β亚基与组成规则hCG的β亚基相同;缺刻游离β亚基在β47-48位(少数在 43-44、44-45位)发生断裂。对缺刻游离β亚基还有另一种范围更广的定义,即包括全部或部分羧基末端(CTP)丢失的β亚基及β核心片段。其中全部CTP丢失指β93-145片段的缺失,而部分CTP丢失一般指β123-145片段的缺失。
2.4.6 游离β-hCG核心片段
2.4.7 高糖基化hCG
高糖基化hCG与规则hCG的蛋白质骨架结构基本相同,只是高糖基化hCG在表达分泌过程中,亚基上修饰的糖基比例显著增多,且修饰的糖基分子质量更大,结构更为复杂。
2.4.8 异构体及杂质研究方法
r-hCG丰富的糖基化修饰导致其具备多种亚型和电荷异构体, 毛细管技术是分析这两种成分的主要方法。毛细管等电聚焦分析亚型, 毛细管区带电泳分析电荷异构体。r-hCG的杂质主要包括产品相关杂质和工艺相关杂质。其中工艺相关杂质如宿主DNA、宿主蛋白、内毒素等具有对应的试剂框进行检测。产品相关杂质包括氧化杂质和寡聚体, 可根据其与活性成分之间极性和分子大小差别, 分别通过反相色谱和分子排阻色谱进行分析。
质量的其他检项主要是生物活性, 中国药典规定u-hCG可通过小鼠子宫增重法获得效价, 该方法同样可用于r-hCG。由于r-hCG质量与其生物活性之间的线性关系, r-hCG可直接以质量作为装量标准。250μg的r-hCG约相当于6 750 IU的u-hCG。
规则hCGα亚基在天冬酰氨Asn52和Asn78上连接单向和双向结构的两个N-联寡糖;β亚基在Asn13,Asn30上也连接两个N-联寡糖,两个N-联寡糖可能都是双向结构;β亚基上还有4个O-联寡糖单位(多为3糖)连接在特有的富含脯氨酸和丝氨酸的羧基末端(CTP)区域(β122~145)。高糖基化hCG的寡糖侧链其结构和糖基种类与规则hCG均不同,突出的是β亚基末端连接的O-联寡糖结构。规则hCG的O-联寡糖结构只含少量6糖(<20%),而高糖基化hCG的O-联寡糖结构主要是6糖(48%~100%)。此外,高糖基化hCG连接的N-联寡糖与规则hCG也有不同,N-联寡糖在原有的糖基基础上,还添加大分子质量的岩藻糖;而且规则hCGα、β亚基的N-联寡糖含6.8%和14%左右的三维结构,高糖基化hCGα、β亚基的N-联寡糖含9.8%和51%左右的三维结构。近来又发现高糖基化hCG连接的寡糖末端的唾液酸含量相对规则hCG常明显减低。
临床研究表明r-hCG和u-hCG在用于辅助生殖中的有效性无明显差异, 但r-hCG耐受性更好。由于u-hCG原料是孕妇尿液, 从生产上来说无法对原料质量进行具体规定, 其来源也难以追踪, 同时, 随着社会的发展, 尿液的收集变得更加困难, 其产量无法保证。而r-hCG通过工程化CHO细胞表达获取, 来源可认为是不受限的。由于r-hCG注射部位反应明显减少, 使皮下注射方式给药成为可能。r-hCG的载药注射器于2011年上市, Nakagawa等的临床研究中患者使用该注射器进行自注射, 对患者来说是一个更方便的给药方式。随着重组蛋白药物生产技术的进步, r-hCG获取成本会进一步降低, r-hCG成为这片市场的主导是一个不可避免的发展趋势。
三、人绒毛膜促性腺激素在体内的存在形式
hCG两个不同的亚基α、β以非共价键连接组成。在激素的产生、分泌、代谢等过程中, hCG分子会发生断裂、离解等多种变化, 从而在血、尿中以多种分子形式存在。
规则hCG由α、β两个亚基连接而成。α亚基是非特异的, 与其他垂体激素, 如促甲状腺素、促滤泡素释放素、促黄体素等的α亚基结构基本相同, 由92个氨基酸组成, 含5个二硫键, 在天冬酰氨Asn52和Asn78上连接单向和双向结构的两个N联寡糖。β亚基是特异的, 由145个氨基酸组成, 含6个二硫键, 在天冬酰氨Asn13、Asn30上也连接两个N联寡糖。除此以外, 在富含脯氨酸和丝氨酸的羧基末端(carboxyl-terminal peptide, CTP) 区域(122~145位氨基酸) 还连接4个O联寡糖, 多为三糖, 少量为四糖。
规则hCG在β47~48处易断裂形成缺口hCG。一种促性腺激素β亚基缺口酶作用于β亚基的一定作用位点, 造成缺口。该作用位点一般在β47~48位, 有时也在β43~44或β44~45位。缺口hCG除发生肽链断裂外, 肽链结构与糖基修饰基本上与规则hCG无异。
hCG游离α亚基则多以两种形式存在:一是规则游离α亚基, 是规则hCG的组成部分;二是大分子游离α亚基, 这是一个高糖基化的α亚基, 其连接的N联糖基结构比规则α亚基更大、更为复杂。这种α亚基不能与β亚基组成规则hCG, 可能是其复杂的糖基结构阻碍了与β亚基的结合。
hCG游离β亚基在促性腺激素β亚基缺口酶的作用下, 也有规则与缺口之分。规则游离β亚基与组成规则hCG的β亚基相同;缺口游离β亚基在β47~48位(少数在 43~44、44~45位) 发生断裂。对缺口游离β亚基还有另一种范围更广的定义, 即包括全部或部分羧基末端(CTP) 丢失的β亚基及β核心片段。其中全部CTP丢失指β93~145片段的缺失, 而部分CTP丢失一般指β123~145片段的缺失。
β核心片段是β亚基的核心结构。由两个肽段组成, 分别是β6~40和β55~92, 两者通过二硫键连接形成。β核心片段在糖基结构上与β亚基存在不同, 这个片段在Asn13和Asn30上同样连接两个双向结构的N联寡糖, 但是其添加的唾液酸缺乏, 半乳糖的数量也减少(研究显示:在β核心片段约为2.3Gal/分子, 而在规则β亚基是7~8 Gal/分子) ;连接半乳糖的糖苷键与规则β亚基也可能不同, β核心片段可能是β1, 3或α1, 3糖苷键, 而规则β亚基是β1, 4糖苷键。
除以上hCG相关分子外, 还有一种hCG相关变体——高糖基化hCG, 又称侵袭性抗原。高糖基化hCG与规则hCG的肽链结构基本相同, 但在亚基的糖基修饰上有很大差异。高糖基化hCG亚基上连接的N联寡糖在原有的糖基基础上, 添加了大分子结构的岩藻糖;且β亚基的O-联寡糖上所连接的三糖转为六糖(或四糖) 。除此, 连接在高糖基化hCG上的寡糖末端的唾液酸含量相对于规则hCG常明显减低。
3.1 hCG及相关分子的产生、分布、代谢
hCG主要由胎盘绒毛滋养层细胞分泌。绒毛滋养层分两层:内层为单个核细胞滋养层, 是未分化的干细胞;外层为多核合体细胞滋养层, 是成熟分化的细胞层。妊娠早期(4~5w) 主要由细胞滋养层分泌产生hCG, 妊娠6w后主要由合体细胞滋养层分泌产生。细胞滋养层分泌的hCG与合体细胞滋养层分泌的hCG有所不同:细胞滋养层分泌的hCG主要是高糖基化hCG, 即侵袭性抗原, 这是妊娠早期hCG的主要分子形式;合体细胞滋养层分泌的hCG主要是规则hCG, 是具有生物活性的hCG分子。另外, 在滋养层疾病、恶性肿瘤中也存在一些hCG分子的异位表达。
合体细胞滋养层产生hCG及相关分子并降解代谢的过程一般如下:胎盘绒毛组织表达合成规则hCG、大分子游离α亚基、规则游离β亚基, 部分规则hCG在β47~48处断裂(或β43~44、β44~45) 形成缺口hCG。分子分泌到血液中, 缺口hCG不稳定, 分泌时或分泌到血液后, 一部分离解形成规则游离α亚基、缺口游离β亚基;而规则游离β亚基在血液中也部分断裂形成缺口游离β亚基。这些分子有一定量经由尿液排泄, 其中缺口游离β亚基经肾脏排泄时, 大部分降解成β核心片段。β核心片段只在尿液中存在而不在血液中存在的证据, 证实β核心片段在肾中降解产生, 且缺口游离β亚基是β核心片段生成的底物。
如上所述, 规则hCG、规则游离β亚基和大分子游离α亚基可以由胎盘滋养层细胞直接分泌产生, 而缺口hCG、缺口游离β亚基和β核心片段不能由滋养层细胞直接分泌产生。缺口hCG和缺口游离β亚基极不稳定, 它们是hCG代谢降解的一种过渡形式, 总结hCG的降解途径为:hCG→缺口hCG→缺口游离hCGβ亚基→β核心片段。
高糖基化hCG的降解途径与规则hCG基本相同, 但两者的缺口位点数目有所不同, 高糖基化hCG一般有三个缺口位点, 而规则hCG只有一个缺口位点, 故高糖基化hCG可能比规则hCG代谢要快。
3.2 hCG及相关分子的检测
随着免疫分析技术的发展, hCG检测技术也渐趋成熟。传统检测技术主要是检测β亚基的放射免疫分析(radioimmunoassay, RIA) , 采用hCGβ亚基多克隆抗体测定含β亚基的各种hCG相关分子(包括规则和缺口的hCG、游离β亚基、β核心片段) 。随着技术的发展, 自动和手动夹心免疫分析(或称二位相免疫分析) 逐渐替代了传统RIA分析, 采用单克隆抗体的混合物检测相应的各种相关分子, 利用荧光免疫、发光免疫、酶免疫、金免疫等检测技术通过精密光谱仪快速检测。这些方法具有高特异性、高灵敏性、高效性。
过去, 同一标本出现不同hCG测定结果多是因为方法的特异性差, 受其他垂体激素的干扰。现今随着抗体特异性、免疫测定水平的提高和hCG标准品的高度纯化, 已很少或不受垂体激素的影响。然而, 对于同一标本的hCG检测仍存在差异, 因为各实验室使用的检测抗体所针对的抗原位点常有不同。比较实验室常用的多种抗体, 发现hCG和其亚基一般有如下一些抗体结合位点:规则hCG有6个(α1、β1、β2、β3、β4、αβ) , 缺口hCG 5个(α1、β1、β2、β3、β4) , 游离β亚基3个(β1、β2、β4) , 游离α亚基只有1个(α1) , β核心片段则有2个(β1、β2) 。测定时如使用针对αβ、β1两个位点的夹心法, 则只检测规则hCG;若使用针对α1、β1两个位点的夹心法, 则能检测规则hCG和缺口hCG。如此, 对其他一些成分的检测, 若选用抗体不同, 检测结果往往存在差异。
针对这些情况, 应根据临床诊断采用相应的检测抗体, 以检测有意义的hCG分子。例如, 规则hCG有生物活性, 而其他hCG相关分子一般没有活性或活性很低, 要观察激素的生物活性, 最好检测规则hCG;又如游离hCGβ亚基在肿瘤疾病常显著升高、β核心片段是早期妊娠尿标本的重要成分等等。
四、人绒毛膜促性腺激素的临床应用
在激素的产生、分泌、代谢等过程中, hCG分子会发生断裂、解离等多种变化, 从而在血、尿中以多种分子形式存在。hCG的药理作用主要与促黄体生成素相似, 而促卵泡成熟样作用甚微, 对雌性能促使卵泡成熟及排卵, 并使破裂卵泡转变为黄体, 促使其分泌孕激素。对雄性则具有促间质细胞激素的作用, 特别是睾丸间质细胞的活动, 使其产生雄激素, 促使性器官和副性征发育及成熟, 并促进精子生成。皮下或肌内注射, 消除相t1/2为5.6 h。测定血清中hCG浓度通常指的是β-hCG浓度的测定, hCG相关分子的测定在临床上有广泛应用。
4.1 对健康妊娠的评估
由于正常情况下hCG由胎盘(或它的前体) 细胞合成分泌的, 所以健康的未怀孕的人体内的浓度应低至可能检测不到。此时血清中β-hCG浓度应小于5 mIU/ml。
在怀孕早期, 母体血清中hCG浓度迅速升高, β-hCG浓度介于5~25 mIU/ml之间可以判断为怀孕早期。
通常hCG在怀孕前3个月达到峰值, 之后的整个孕期内缓慢下降。血清hCG浓度的迅速下降或跳跃可能表示异常的妊娠, 可能需要进一步的临床评估和追踪。健康妊娠期间β-hCG的浓度范围:最后一次月经后的3~4周约9~130 mIU/ml, 4~5周约75~2 600 mIU/ml, 5~6周约850~20 500 mIU/ml, 6~7周约4 000~100 200 mIU/ml, 7~12周约11 500~289 000 mIU/ml, 12~16周约18 300~137 000 mIU/ml, 16~29周约1 400~53 000 mIU/ml, 29~41周约940~60 000 mIU/ml。对于多胎妊娠, hCG将高于同期单胎妊娠组。
4.2 预测异位妊娠
在健康妊娠的最初3个月, 血清β-hCG值平均2.2 d约增加1倍。据此, 总结出这样的公式来诊断异位妊娠:
R=(1/t) log(C2/C1)
R:β-hCG的指数增长率(day-1) ;t:2次抽血时间隔(day) ;C1、C2第1、第2次的血清β-hCG浓度(mIU/ml) 。
第1、第2次血清β-hCG 6~1 200 mIU/ml时, R的判断低限为0.137 d-1;第1、第2次血清β-hCG 1 200~6 000 mIU/ml时, R的判断低限为0.116 d-1;第1次血清β-hCG 600~6 000 mIU/ml, 第2次血清β-hCG 6 000~18 000 mIU/ml时, R的判断低限为0.086 d-1;第1、第2次血清β-hCG 6 000~30 000 mIU/ml时, R的判断低限为0.068 d-1。
用于诊断时, hCG检测结果应与其他数据(如症状) 、其他检测结果、临床印象等联合使用。其中超声检查是十分重要的联合使用手段。
对异位妊娠, 常伴有腹腔血和盆腔血的发生。异位妊娠者腹腔血或盆腔血hCG含量高于同期静脉血含量。腹腔血或盆腔血hCG更能真实反映异位妊娠滋养细胞的活动状态, 对异位妊娠的诊断具有特殊意义。
血清hCG浓度的高低是影响异位妊娠保守治疗结果的重要因素, 且为预测治疗效果的有效指标。血清β-hCG水平超过10 000 mIU/ml时药物治疗不易成功。
对于异位妊娠成功的手术治疗, 患者血清hCG应在治疗后3周恢复至正常水平, 若术后48 h hCG浓度不下降及术后3周hCG仍为阳性应考虑手术彻底性。对于异位妊娠成功的保守治疗, hCG亦应下降。林坦和陈瑞华研究表明, 保守治疗后每周血清β-hCG是否成对数下降, 可作为观察治疗效果及预后判断的指标, 对于治疗后血清hCG下降不顺利的可加用其他治疗以提高保守治疗成功率。
4.3 预测妊娠高血压综合征
妊娠高血压综合征(以下简称妊高征) 是妇产科常见且对母婴具有极大危害的高危妊娠, 居我国孕产妇死因第2位。妊高征与多基因有关, 这种多基因的遗传背景使妊高征的易感性增加。宋淑本指出, 妊高征病人在孕中晚期的β-hCG值明显高于同孕期的正常孕妇, 妊高征的严重程度与β-hCG值呈正相关。在孕4~10周每个胎盘合体滋养层细胞可分泌0.04 IU的hCG。在胎盘病理上, 孕中晚期妊高征病人的子宫中合体滋养层细胞数比正常妊娠病人约多20倍, 导致β-hCG值比同孕期的正常孕妇的值高。
夏俊霞对95例妊高征病人的研究发现, 孕妇血清β-hCG水平可作为筛查、诊断妊高征的客观指标及判断病情严重程度的参照指标;而血清游离雌三醇不具备此价值。吴曼祯等对218例妊娠16~20周的孕妇抽血测定血β-hCG、血钙等项目, 结果发现妊高征孕妇(32例) 的β-hCG明显高于正常妊娠者。禇红女等采用单克隆放射免疫法检测66例妊高征病人血清发现, 游离α-hCG均值明显高于30例正常妊娠妇女, 差异有极显著性(P<0.001) , 且游离α-hCG随妊高征严重程度及脏器损伤的加重而递增。
血中尿酸值和β-hCG值作为孕妇血清标记物, 是产科检查的重要项目。郭丽检测80例妊高征和180例正常中、晚期妊娠妇女血清尿酸与β-hCG值发现, 妊高征孕妇血清尿酸与β-hCG值明显升高, 与正常孕中、晚期妇女相比, 差异显著(P<0.01) , 且随病情加重其数值呈进行性升高。可见监测中、晚期孕妇血清尿酸值和β-hCG值可作为预测妊高征的发生及判断病情轻重的指标。
研究发现, 对PIH和妊娠糖尿病的孕妇, 在妊娠早期, 其hCG水平会降低(在妊娠10~14周测定时显著降低) ;在妊娠中晚期, hCG水平会升高。在妊娠中晚期, 母血β-hCG水平升高(>2.0 MoM) 与母血β-hCG水平降低(<2.0 MoM) 相比, 前者发展为PIH及先兆子痫的更多, 而在PIH合并蛋白尿及重度PIH者, 血hCG水平升高更明显。孕中期hCG水平升高可支持PIH之胎盘缺血学说, 是因为滋养细胞缺血缺氧可使hCG分泌量增加, 且hCG升高水平与PIH病情严重程度相关。国内左建新和张陵娜报道孕中期β-hCG均值水平为:妊高征组(3 018.31±253.37) mIU/ml, 健康对照组(1 431.81±301.29) mIU/ml。
4.4 诊断和监测异位妊娠
异位妊娠是妇产科一种常见病和多发病, 近年发病率升高。异位妊娠一旦孕卵破裂和流产, 若未能及时诊断并积极抢救, 容易出现大出血而危及生命。所以早期诊断异位妊娠并予以积极的治疗具有重要意义。测定血中β-hCG水平, 有助于及早确诊异位妊娠, 并可作为判定异位妊娠保守治疗成功与否的良好标志物。
奚宝珊等的研究结果表明, β-hCG首次测定浓度过高或在药物保守治疗过程中β-hCG浓度仍持续升高, 结合临床症状与体征应及时手术治疗。β-hCG值<2000 U/L时可考虑保守治疗。该研究中10例异位妊娠者经保守治疗后, β-hCG含量逐渐下降, 最终保持在正常水平, 从而避免了手术。与其他报道相同, 保守治疗中除观察症状、体征变化外, β-hCG是选择治疗方法、观察病情变化、判断治疗成功与否的一个比较准确和敏感的客观指标。有文献报道, hCG值<100 U/L的异位妊娠很少发生破裂, 接近8000 U/L时则有高度破裂的危险, 须及时手术;对血清hCG值>5000 U/L、1000~5000 U/L、>1000 U/L的病人保守治疗的成功率分别为38%、80%和98%。
由于快速、敏捷、准确的β-hCG放射免疫技术的开展, 高分辨阴道超声的应用, 大部分异位妊娠在未破裂之前即可确诊, 通过动态观察血β-hCG水平, 为临床治疗创造了条件。当血hCG水平呈异常上升或低于正常, 应高度警惕异位妊娠的可能。其治疗包括手术、药物及期待治疗, 而hCG水平是选择治疗方案和疗效监测的重要指标之一。
4.5 唐氏综合征的产前筛查
唐氏综合征(Down’s syndrome, DS) 是造成儿童智力低下的主要原因之一, 具有多部位发育异常的特征。该病是由21号染色体异常引起的疾病, 也称21-三体综合征。DS的发病率有上升趋势, 约占受孕人数的1%。目前世界上仍无治疗该病的有效方法。因此, 人们一直试图利用先进的医疗技术阻止该类患儿的出生。
DS的产前筛查一般包括母体血清甲胎蛋白(AFP) 、hCG、雌三醇和一些妊娠蛋白的浓度检测, 结合孕妇预产期年龄、采血时的孕周, 计算怀“唐氏儿”的危险系数, 通过这些检测约可查出80%的“唐氏儿”。怀有“唐氏儿”的母体血清hCG水平常比同期正常孕妇高。
我国自20世纪90年代早期开展了这方面的研究, 随后也在国内推广应用。梅瑾等对孕14~20周妇女进行AFP和hCG检测, 结合母亲年龄、孕周、体重等因素, 经过软件计算风险率, 对高风险孕妇进行羊水细胞染色体检查及B超确诊。每例受检孕妇追踪到胎儿出生。在2776例孕妇中, 发现DS 1例, 18-三体综合征2例, 其他胎儿异常12例。可见孕中期血清AFP、游离β-hCG两项血清标志物联合检测作为筛查胎儿先天缺陷可行, 能降低先天缺陷患儿出生率5.40‰。
宋淑本等用全自动时间荧光免疫分辨仪对1198例孕9~20周的孕妇进行血清妊娠相关血浆蛋白A、AFP、游离β-hCG检测。结果, 风险率1∶250以上的孕妇122例, 其中44例抽羊水或脐血进行染色体检测, 有2例确诊为阳性, 而暂无1例假阴性。结果表明, 血清血浆蛋白A、AFP、游离β-hCG的检测可作为DS筛查的优选生化项目, 其血清水平以及母亲年龄、孕周、体重等是影响其风险值的主要因素。进行风险分析时, 孕周是一个重要的因素, 不同的孕周其生化值不同, 该文把孕妇的末次月经结合抽血日期输进电脑计算孕周, 如果月经不调者必须用B超定孕周。由于AFP、游离β-hCG值随孕妇体重的增加而降低, 在分析风险时, 孕妇的体重、是否吸烟、多胎妊娠、糖尿病、是否曾怀过唐氏儿等因素都必须考虑。
有报道, 以AFP<0.7 multiplier, β-hCG>2.3 MoM定为唐氏综合征筛查阳性界值;AFP>2.5 MoM定为开放性神经管畸形筛查的阳性界值。
4.6 滋养层细胞疾病的诊断及疗效检测
多年来hCG一直是滋养层细胞肿瘤、胚胎性肿瘤的生物学标志物, 目前发现几乎所有组织, 尤其是肿瘤包括肺癌、乳腺癌、子宫颈癌、卵巢癌、膀胱癌等均可产生异位hCG, 并且发现其对免疫系统及肿瘤的发生、发展、浸润转移、分化程度等都有重要作用。正常成人组织细胞表达的hCG量极少, 而恶性肿瘤细胞的异位hCG表达则明显增加。恶性肿瘤细胞表达的异位hCG是其转化过程中胚胎基因激活所表达的产物, 既有分泌型也有膜结合型, 异位hCG与恶性肿瘤生长的自我调控能力、肿瘤的形成发展和转移特性, 以及与肿瘤微环境和免疫耐受的形成都有一定的关系, 而探讨这种相关性将进一步了解肿瘤的形成机制, 同时对如何控制肿瘤的发展与转移、研究肿瘤的生物治疗等提供了新的思路。正常hCG水平对保护早期胚胎免遭母体免疫攻击是十分重要的, 因此胎儿与母体组织之间存在的滋养层细胞及其分泌的高浓度hCG集聚参与了胎盘屏障的构建, 并能抑制母体免疫细胞对妊娠产物的排斥并诱导免疫耐受。而肿瘤细胞表面的膜结合型hCG, 特别是高度糖基化的hCG β链的过度表达, 使得肿瘤细胞呈强阴电荷, 从而抑制自然杀伤细胞(NK) 、T细胞、巨噬细胞等免疫细胞的活化, 导致免疫细胞的活性降低甚至无能, 造成肿瘤的免疫耐受。
妊娠滋养层细胞疾病是一组来源于胎盘绒毛滋养层细胞的疾病, 包括葡萄胎、绒毛膜癌和一类少见的胎盘部位滋养细胞肿瘤。常用来指示的hCG相关分子是游离β-hCG。在正常妊娠的血清中, 游离β-hCG所占比例非常低(<1%) , 但在绝大多数滋养层细胞疾病中发现高浓度的游离β-hCG, 且游离β-hCG与总hCG的比值在葡萄胎时最低, 绒毛膜癌时最高, 可能是游离β-hCG的增多与未成熟的滋养层细胞有关。该类病人游离β-hCG除在血清中升高外, 在尿中浓度也显著升高。此外, 尿中另一个hCG分子即该类病人β核心片段的值也明显升高, 也可作为诊断和监测滋养层细胞疾病的一项有意义的指标。
hCG还用于监测非滋养层细胞恶性肿瘤。在一些非滋养层细胞恶性肿瘤, 如睾丸癌、卵巢癌、子宫内膜癌可分泌异位hCG, 病人的血清或尿液标本中能检测到升高的hCG值, 且hCG同样不均一存在。但是, 由于hCG主要由胎盘滋养层细胞表达分泌, 诊断和监测非滋养层细胞恶性肿瘤的特异性与灵敏度受限制, 一般应与其他肿瘤标记物联合检测用于诊断。
4.7 治疗先兆流产和习惯性流产
先兆流产及习惯性流产病因复杂, 在这类病人中, 黄体功能不全者高达23%~67%。有报道hCG对胚胎发育及早孕维持起决定性作用, hCG是一种有效的黄体功能刺激剂, 可增加孕酮合成及延长黄体功能。当疑有黄体功能不全者, 可于排卵后立即给予hCG的治疗, 以促进黄体发育。若能及早检测hCG, 早期发现hCG不足并及时补充足够剂量的hCG制剂, 流产就可以得到预防。
鹿敏等报道在门诊应用hCG治疗习惯性流产50例取得良好效果, 治疗组痊愈43例, 对照组(15例) 痊愈6例。孙玉香等收治黄体功能不全所致反复性早期流产病人50例, 确定妊娠后即开始肌内注射hCG, 每次2000 U, 隔日1次, 1周后改为每周2次, 第3周改为每周1次, 维持至怀孕后3个月。同时根据情况配合应用叶酸片、维生素E胶囊等保胎辅助用药, 治疗组40例中38例有效。此外, hCG对于其他妊娠有关的具有免疫抑制作用的蛋白质的产生具有间接的促进作用, 宫外孕, 先兆流产的病人早期hCG血清水平较正常妊娠者低。因此, 对于由于自身抗体免疫因素而引起的习惯性流产, 应用hCG治疗可以获得较好的疗效。
4.8 治疗小儿隐睾症及不孕不育症
隐睾症是小儿常见的一种先天性泌尿生殖系统发育畸形, 其发病率在1%左右, 其中早产儿出现的几率比足月儿高。有研究认为, 注射hCG对于部分隐睾症病人有效, 尤其是对于腹股沟周围的隐睾。刘振勇等对283例6 d至14岁的患儿中的128例146侧的隐睾运用hCG治疗, 其中64侧出现下降, 成功率达43.8%, 年龄>1岁的成功率较高。故对于1岁以内有隐睾下降趋势及低位的患儿使用hCG为首选的隐睾症治疗方案, 1岁以上者考虑采用手术治疗。郭临等报道采用hCG治疗隐睾症患儿32例, 肌注, 1000~1500 U, 每周3次, 总量1.35×104 U为一疗程, 必要时可追加第2个疗程, 17例隐睾症患儿的睾丸降入阴囊底部(17/32) 。故该作者提出隐睾患儿可先行激素治疗, 不仅使部分患儿免受手术之苦, 而且又可提高睾丸内生殖细胞。
hCG在男科治疗中也有应用。黄慧霞等采用hCG治疗精索静脉曲张术后不育40 例后发现, hCG可改善精子的各项指标, 有助于加快恢复和提高受孕率, 40例中, 9例于治疗后6个月内配偶受孕。俞建军等选择男性不育症30例, 以hCG治疗12周, 治疗前后分别做电镜观察。结果治疗前后的精子环状沟的清晰度呈一直线, 状况明显改善;顶体膜、质膜变得完整、光滑;胞浆小滴占比增加。
陈素娥等对女性排卵异常或黄体不全者用hCG肌内注射, 结合其他药物进行综合治疗, 取得了满意效果。张翠红等应用人绝经期促性腺激素(HMG) 和hCG超促排卵治疗卵巢性不孕症40例, 排卵36例, 妊娠10例。
hCG作为一项常用的实验室检测指标, 在检测技术方面已经有了较大的发展。但是, 由于hCG分子在血、尿中存在多样性, 目前各医院检测hCG的形式和方法各不相同, 结果的比较存在差异。凡瞿明等收集104例病人血清同时用微粒子酶免化学发光法和免疫胶体金试纸法检测血浆中β-hCG, 并对结果进行分析比较, 结果前种方法测β-hCG灵敏度高、更精确、更具有临床应用价值。血清中各hCG相关分子之间的联系, 它们在一些妊娠相关疾病及肿瘤中表现的浓度是否代表了疾病的一定变化, 以及它们的存在是否直接参与了疾病的产生、发展或是控制等, 都需要进一步探讨。
五、人绒毛膜促性腺激素检测
hCG的检测主要是用免疫学方法, 特别是标志免疫的方法, 从早期的动物试验到目前不断发展的标志免疫学分析, 随免疫学的进展, 特别是标志免疫分析的进展而日新月异。下面就标志免疫分析对hCG的检测进展作一叙述。
5.1 酶联免疫吸附分析(ELISA)
ELISA定量检测的灵敏度、特异性、稳定性目前受到很大挑战。ELISA检测hCG采用的双抗体夹心法, 高剂量HOOK效应是值得关注的问题。在孕峰值和滋养细胞疾病患者未治疗时的血清中, hCG有极高的浓度, 尤其值得注意, 如检测时发生HOOK效应, 使检测值偏低甚至为阴性。还有, 若人体接触过鼠抗原(经常接触老鼠或接受过鼠克隆抗体治疗) , 检测样品中有人抗鼠抗体(human anti-小鼠 antibodies, HAMA) , 可能产生HAMA效应导致假阴性或假阳性。在所有免疫学方法测hCG时都应关注这些问题。
5.2 放射免疫分析(RIA)
RIA是一种传统方法, 具良好灵敏度、特异性, 但有放射污染, 操作烦琐, 趋于淘汰。RIA是运用hCG的β链羧基端特有的氨基片段, 制备成高特异的hCG β链的抗体, 用I125标志的β-hCG与血清中hCG竞争结合不足量的抗体, 但标志的抗原与血清中不同组分hCG存在不平等的竞争。而且, RIA法所测β-hCG主要是从hCG分子上脱落下来的β亚基, 而很难识别完整hCG分子中的β亚基, 这是由其均相免疫分析的特点所决定的。如前所述, 健康妊娠、异位妊娠和滋养层细胞疾病者血清中完整的hCG和hCG β亚基比例有差别, 应用RIA法检测β-hCG应注意这个问题。
5.3 金标免疫分析(GIA)
有免疫渗滤分析和免疫层析分析两种方式。目前GIA主要用于尿液β-hCG定性检测, 对于早早孕试验已有普及应用。其优点是简便、快捷、特异, 有一定灵敏度, 还适合床旁使用, 但不适用于定量检测, 且灵敏度有限。
5.4 磁分离酶免疫分析
是瑞士Serouo诊断中心研发的Serozyme酶联免疫双抗体夹心检测系统, 用抗异氢酸荧光素抗体偶联的磁性微珠分离结合及游离碱性磷酸酶(AKP) 标志的抗体, 用单磷酸酚肽作底物, 加KOH终止反应, 用三波长(492 nm/550 nm/630 nm) 比色。它采用液相分离方法明显优于ELISA的固相分离方法。有报道, 检测hCG与ELISA、RIA有良好相关性, 且灵敏度达1 mIU/ml。
5.5 微粒子酶免疫分析
为Abbott公司的AxSYM和IMx全自动免疫发光仪上的方法之一, 亦是采用双抗体夹心法, 检测的是总β-hCG, 包括前述所有的β亚基。其以特殊微粒子包被抗体于液相中, AKP标志第二抗体, 4-甲基磷酸伞形酮作发光底物, 通过测定荧光速率值建立标准曲线, 检测hCG。检测hCG灵敏度1 mIU/ml以下, 线性范围为0~1 000 mIU/ml。
5.6 化学发光免疫分析
如Bayer公司ACS-180全自动化学发光仪, 检测hCG亦是采用的双抗体夹心模式。它是以丫啶酯作为发光底物, 在有过氧化氢的弱碱溶液中即可迅速发光, 具特异性、灵敏度高, 无污染, 药框效期长, 比RIA更高准确度与精密度的优点。检测hCG灵敏度1 mIU/ml以下, 线性范围为0~10 000 mIU/ml。
5.7 电化学发光免疫分析
是由德国BM公司(现被瑞士Roche公司收购) 最近推出的标志免疫检测方法。它利用稀土元素钌进行标志, 利用磁性颗粒作B/F分离, 利用电极上的氧化还原反应来进行分析。检测hCG灵敏度达0.5 mIU/ml, 线性范围为0~10 000 mIU/ml。
5.8 时间分辨免疫分析
是以抗原抗体反应结合荧光物质发光和时间分辨技术的近代光谱技术。利用镧系元素铕螯合物被激活后产生的特异荧光比一般荧光长的时间分辨特性建立的极高灵敏度的发光分析技术。
六、hCG在早期妊娠中的生物学功能
在早期妊娠阶段,人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)是调节子宫内膜容受性、维持妊娠的重要胚胎源信号。hCG与其受体结合后,可促进子宫血管生成、维持子宫肌层的相对静止态,参与母胎界面的免疫调节,以及滋养层细胞的入侵,有利于胚胎的成功植入。
一般情况下,目前大多数研究中主要使用的外源性hCG是重组或尿纯化hCG,它们与体内分泌的hCG并不完全相同。重组hCG中hCG-H亚型含量不足,因为由细胞系诱导产生的重组蛋白不进行糖基化或糖基化水平很低,而尿纯化的hCG中也仅含有很低水平的hCG-H。
6.1 hCG在早期妊娠中的生物学功能
hCG在早期妊娠阶段从多个方面调控胚胎的植入和妊娠的维持,包括对子宫内膜容受性调控、对胚胎植入的调控以及免疫调节作用。
6.1.1 hCG对子宫内膜容受性的调控作用
hCG在胚胎4细胞期即开始转录,之后作为胚胎信号能直接影响内膜的功能。hCG和LH在细胞表面有共同的受体即hCG/LH受体,属于G蛋白偶联受体家族,这些受体在男女生殖系统的各种组织中均可高表达。子宫内膜hCG/LH受体的表达在分泌期明显高于增殖期,表明在种植期子宫内膜进行了hCG/LH受体的储备,以准备好对胚胎源信号的响应。
6.1.1.1 hCG对子宫内膜细胞因子的调控
子宫内膜产生白血病抑制因子(leukemia inhibitory factor,LIF)和白介素6(interleukin 6 ,IL-6) 等细胞因子,可在种植窗期调控hCG的生物合成。另一方面,hCG也可调节LIF、胎盘蛋白和胰岛素样生长因子结合蛋白-1(insulin-like growth factor binding protein-1,IGFBP-1)等细胞因子和趋化因子的产生,进而调控子宫内膜容受性。已经发现在人类子宫内膜基质细胞(human endometrial stromal cells,HESCs)中,hCG可直接或间接调控与细胞信号转导、增殖、凋亡、免疫调节、组织重建和血管生成等相关的细胞因子基因的表达。Srivastava等研究证实,体外添加hCG会使上皮细胞、基质细胞以及两者混合细胞中细胞因子的分泌模式出现明显的不同。但是,这些体外研究尚不能完全反应体内实际发生的变化,hCG对子宫内膜细胞因子表达谱的生理作用需进一步的体内研究进行探索。
6.1.1.2 hCG对子宫内膜相关黏附因子的调控
在胚胎着床过程中,子宫内膜会产生并释放大量黏附相关的调控因子,包括整合素、黏蛋白、骨桥蛋白、L-选择素等。在妊娠早期,hCG可刺激这些黏附因子的表达,从而导致胚胎和子宫内膜发生改变,有利于胚胎的种植过程。在小鼠模型研究中发现,注射促性腺激素和hCG后,整合素β3在妊娠第5天的子宫内膜中表达,且丰度显著高于对照组。在体外胚胎植入模型研究中证实,hCG能显著增强骨桥蛋白编码基因的表达,进而促进滋养层对上皮细胞的附着。在乳腺癌细胞系的研究中也发现,hCG可显著提高黏附因子钙黏素E的表达。目前关于hCG对子宫内膜黏附分子调控的相关研究较少,且主要限于体外实验或动物模型研究中。
6.1.1.3 hCG对子宫血管生成的调控
hCG通过对人子宫内膜中多种血管生成因子的调控而起到促进血管生成的作用。在体内外实验的研究中均证实hCG可引起子宫促血管生成因子-血管内皮生长因子(vascular endothelial growth factor, VEGF)和胰岛素样生长因子Ⅱ(insulin growth factor‐II,IGF-Ⅱ)水平的显著增高,表明hCG通过诱导VEGF和IGF-Ⅱ的产生参与子宫内膜血管的生成,而这对于早期胎盘的形成至关重要。在3D血管生成模型中,hCG可通过与子宫血管内皮细胞上的hCG/LH受体和TGF-βⅡ型受体(TGF-β-RⅡ)两种途径促进新生血管的形成。另一方面,hCG能增强内皮细胞和HESCs对IL-1的反应性,从而促进血管生成。
6.1.1.4 hCG对子宫内膜蜕膜化的调控
hCG能抑制HESCs的凋亡,保障HESCs的有效蜕膜化,这对于妊娠的建立具有重要意义。hCG可通过调控凋亡相关基因、蛋白以及增强抗氧化酶的表达等作用来保护蜕膜HESCs不被凋亡。此外,尿hCG可通过诱导cAMP的形成促进HESCs的形态分化和功能,hCG还可通过激活Epac-Erk1/2信号通路上调孕激素受体的表达,从而促进子宫内膜蜕膜化。
6.1.2 hCG对胚胎植入的调控作用
hCG和hCG/LH受体结合后激活腺苷酸环化酶、磷脂酶C和离子通道,调控细胞内cAMP、肌醇磷脂、Ca2+水平以及其它第二信使的活性。蛋白激酶A(protein kinase A,PKA)通过激活cAMP来促进细胞滋养层的融合和微绒毛的形成,这两个过程是形成合体滋养层所必须的环节。一些体外实验中将内膜上皮细胞和重组hCG进行共培养,证实hCG可上调一些种植促进因子,如前动力蛋白1、VEGF、IL-11、CX3CL1、CCL14、LIF和CCL4。在妊娠的前11周,侵入的绒毛外滋养层(invasive extravillous trophoblasts,iEVTs)分泌的hCG主要为hCG-H。因此,随着蜕膜滋养层细胞的入侵,母体血液中所测得的hCG-H在妊娠的前3个月上升,而之后开始逐渐下降。
hCG在促进滋养层细胞入侵中也具有重要作用。研究显示,hCG-H能促进胎盘和恶性肿瘤生殖细胞的生长和入侵,这一过程是通过TGF-β信号通路进行。在妊娠早期,hCG可上调基质金属蛋白酶(matrix metalloproteinases,MMPs),降低MMPs组织抑制剂的水平,从而降低滋养层的调亡,促进EVT的侵入。
此外,有研究证实由iEVTs分泌的hCG-H能通过胰岛素样生长因子轴促进EVT细胞系HTR-8 SVneo cells的迁移。也有报道指出,hCG可促进人内膜基质细胞HTR-8/SVneo细胞的侵入。这些研究表明,在滋养层侵入过程中,hCG可通过内膜基质细胞和局部免疫细胞的旁分泌来发挥作用。
6.1.3 hCG的免疫调节作用
免疫细胞是功能子宫内膜的重要组成部分,子宫内膜中免疫效应因子的适当比例和功能是子宫内膜容受性、胚胎植入和胎盘发育所必需的。hCG通过多种免疫细胞参与胚胎植入和胎盘的形成过程。子宫自然杀伤(uterine natural 致命物,uNK)细胞是子宫内膜中的主要白细胞,在胚胎种植过程中发挥促进血管生成、细胞侵袭、螺旋动脉转化和蜕膜分化等多种作用。在着床前期,uNK细胞显著增加,甚至高达子宫内膜白细胞的70%。uNK细胞占比过低或过高都会对子宫内膜容受性和胚胎着床产生不利影响。有研究提示,高剂量(10000 IU)的尿纯化hCG可通过甘露糖受体CD206途径调控 uNK细胞的增殖,uNK细胞并不表达LH/hCG受体,因此这一过程并不依赖于LH/hCG受体途径。此外,该研究进一步证实了能调控uNK细胞增殖的主要为hCG-H,这也为在免疫调节过程中hCG的作用提供了全新的见解。
表型为CD4+/CD25+/Foxp3+的调节性T细胞(regulatory T cells,Tregs)的早期增殖是正常妊娠的重要特征,这在调节胎儿耐受性中起到重要作用。妊娠时hCG水平的上升会激发Tregs相关的多种响应,包括:(1)Tregs数目的增多;(2)增加局部和系统免疫抑制功能;(3)将血液Tregs吸引至蜕膜;(4)增加抑制性细胞因子的分泌。研究表明,hCG可吸引并增强滋养层细胞周围Treg的募集,同时增强了其免疫抑制功能,以有利于妊娠期胎儿的免疫耐受。hCG诱导Treg数量增加的可能机制是hCG直接诱导CD4+FOXP3-细胞向CD4+FOXP3+Treg细胞的分化。研究显示,与健康对照相比,反复种植失败女性中子宫内膜Foxp3+Tregs和外周血CCR4+Foxp3+Tregs的百分比显著降低,表明子宫内膜Tregs的缺乏可能不利于子宫内膜的接受性和胚胎的植入。同时该研究也发现,与不添加hCG组相比,用hCG刺激CD4+T细胞后,CCR4+Foxp3+Tregs的百分比显著增加。
hCG可能参与子宫内膜树突状细胞(dendritic cells,DCs)的调控。DCs是胚胎种植和妊娠维持过程中非常重要的免疫细胞,可能调节组织重建和血管生成。子宫内膜活检显示子宫内膜DCs的增加有利于内膜的容受性和胚胎植入。在体内外研究中均发现,尿纯化和重组hCG均可阻碍骨髓DCs(bone marrow-derived DCs,BMDCs)的成熟。在胚胎植入前通过静脉注射hCG处理的BMDCs,有维持妊娠的作用,并伴有Treg的增加、蜕膜IL-10以及TGF-β的表达。这些结果表明,hCG可能通过调控BMDCs成熟、增加Tregs的数量、预防流产等作用来维持母胎免疫耐受状态。此外,蜕膜DCs也是分泌免疫抑制因子IL-10和色氨酸代谢酶吲哚胺2,3-二加氧酶(indoleamine 2,3‐dioxygenase ,IDO)的主要来源之一。研究发现,hCG可刺激人类外周血DC中IL-10的分泌和小鼠BMDC中IL-10/IDO的产生。hCG对这两种免疫抑制剂的上调一方面有利于维持DC的耐受状态,另一方面可使Tregs处于诱导状态。这些结果表明hCG对于DCs在胚胎着床中的作用具有重要的调控价值。
七、hCG在ART中应用进展
7.1 用于IVF/ICSI超促排卵周期前预处理
在IVF/ICSI超促排卵周期中, 去氧孕烯炔雌醇片(商品名:妈富隆) 、孕激素及雌激素等用于预处理的报道甚多, 近年也有应用hCG做周期前预处理的报道。但各报道存在一定差异, 其作用机制尚不明了。
Beretsos等在黄体中期长方案中, 将正常反应的患者随机分成2组, 预处理组患者在促性腺激素(Gn) 启动日前1周开始至降调日每日肌注200 IU hCG做预处理, 对照组在同日启动, 不做任何预处理。所有患者均行ICSI。结果预处理组与对照组获卵数差异无统计学意义, 成熟卵子与总获卵数的比例较对照组增高;预处理组的优良胚胎率及临床妊娠率均高于对照组。移植日行子宫内膜形态学超声检查发现, 预处理组内膜厚度大于8 mm患者比例比对照组高。故认为hCG预处理后可增加卵泡对FSH的敏感性, 改善子宫内膜的容受性。
Lossl等研究发现, 在拮抗剂周期中使用芳香化酶抑制剂及hCG预处理能提高卵子和胚胎的质量。随后进行随机对照试验, 于月经第2天给予hCG1 250 IU和Gn RH拮抗剂(Gn RHA) 类药物西曲肽3 mg, 并在月经周期第2, 3, 4天给予芳香化酶抑制剂阿那曲唑1 mg做预处理, 月经第5天启动Gn;对照组于同日启动而不予任何预处理;发现预处理组胚胎质量显著优于对照组, 但2组临床妊娠率及活产率差异无统计学意义, 推测可能是hCG促进卵泡膜细胞合成雄激素, 提高了卵泡募集的数量和质量。
7.2 在晚卵泡期的应用
在晚卵泡期(卵泡径线10~12 mm以上) 的生长中, 需要一定水平的LH。在IVF/ICSI临床超促排卵周期中, 使用Gn RHa或Gn RHA时, 由于用药剂量及个体间差异较大, 出现许多LH水平过度抑制的现象。许多研究认为, 晚卵泡期添加LH有利于改善临床妊娠结局, 建议在超促排卵周期的晚卵泡期添加一定量的LH。
在COH过程中, 长方案降调节往往在前一周期的黄体中期开始用药, 而下一周期卵泡的募集开始于前一周期的黄体晚期。因此, 整个IVF-ET卵巢募集过程中内源性LH均处在较低的水平, 使FSH/LH的比例失衡, 导致卵泡质量、受精率、妊娠率下降。就此, Beretsos等及Drakakis等分别在长方案及拮抗剂方案中, 先用hCG 200 IU/d及重组hCG 250μg进行预处理, 再用FSH促排卵, 结果发现2项试验中hCG组均得到较高的种植率及妊娠率。故可以认为COH前预使用hCG可以改善胚胎质量、IVF-ET胚胎种植率及妊娠率。
由于hCG较LH在体内有更长的半衰期及更强的受体结合能力。有学者在晚卵泡期应用低剂量的hCG促卵泡生长。Filicori等在一项前瞻性随机对照试验中, 对正常反应的ICSI周期患者采用黄体中期长方案, 发现在晚卵泡期单独应用200 IUhCG替代FSH或人绝经期促性腺激素(h MG) 促排卵可降低FSH/h MG的总使用量, 减少不成熟卵泡的数目, 而妊娠结局与应用FSH/h MG组差异无统计学意义, 也并未出现提前黄素化;并且hCG的使用与卵泡液内高雌激素水平相关, 而卵泡液内高雌激素水平有助于获得更多成熟的卵子。Cavagna等在超排卵周期的晚卵泡期添加低剂量的重组hCG(7.7μg, 相当于200 IU hCG) , 发现添加组与不添加组获卵数、受精率及临床妊娠率等差异均无统计学意义。Koichi等研究发现, 在拮抗剂周期中, 晚卵泡期使用hCG(每日200 IU) 组临床妊娠率显著高于常规拮抗剂周期组。2009年一项Meta分析也发现, 在拮抗剂周期的晚卵泡期, 单独应用低剂量的hCG(50~275IU) 或添加低剂量hCG, 能替代FSH或LH及h MG完成IVF/ICSI周期, 并显著提高周期妊娠率, 降低OHSS的发生, 同时也可减少FSH的用量及周期治疗费用, 并认为这可能与胰岛素样生长因子1(IGF-1) 、血管内皮细胞生长因子(VEGF) 通路增加了子宫内膜血管的形成和改善了子宫内膜的容受性相关。Grondahl等发现, 在长方案超促排卵周期中, 添加h MG(含hCG) 组颗粒细胞中LH/hCG受体基因及孕酮代谢相关基因表达水平较重组卵泡刺激素(r FSH) 组降低, 同时抗凋亡相关基因表达水平上升, 获得了较多的优质胚胎及更高的临床妊娠率。Berkkanoglu等的前瞻性随机对照试验将145例正常反应患者随机分为FSH组、FSH+LH组及FSH+hCG组, 采用早卵泡期Gn RHa短方案, 发现3组获卵数、周期取消率、移植胚胎数和临床妊娠率等差异均无统计学意义。
有文献报道, 在早卵泡期就开始添加低剂量hCG。Drakakis等进行了一项前瞻性对照试验, 在Gn启动日开始分别添加200 IU hCG或200 IU r LH, 发现添加hCG组卵泡数、成熟卵子数及临床妊娠率高于r LH组, 并发现添加hCG组LH/hCG受体c DNA的表达明显高于r LH组(每微升c DNA 25.3拷贝数vs.6.8拷贝数) 。并认为LH/hCG受体c DNA的表达水平能在一定程度上, 尤其是对既往有周期治疗失败史患者的妊娠结局有一定预测意义。
不可否认, hCG用于促排卵治疗, 在有效性、安全性及使用方法等方面尚存在较大争议, 尚需进行多中心大样本的随机对照研究获得更多的临床应用依据。
7.3 hCG与胚胎种植
胚泡植入子宫内膜是一个错综复杂的过程, 需满足4个条件:透明带的消失;滋养细胞分化出合体滋养细胞;妊娠妇女体内有足够数量的孕酮;子宫内膜与胚泡必须发育同步且功能协调。至此胚胎才有可能侵入子宫内膜并获得母体的血液供应。胚胎植入第一步是母胎界面胚胎与可接受性子宫内膜间的亲密对话, 由相关激素及各种细胞因子介导完成, 与此同时, 胚胎滋养层细胞黏附于子宫内膜上皮细胞。子宫内膜上皮细胞的表面形成微细突起称为胞饮突的结构在此过程中起至关重要的作用。最后是侵入过程, 包括胚泡穿透子宫内膜上皮细胞, 锚定于子宫内膜的基底层及细胞外基质中, 从而与母体建立血液关系。因此, 胚胎植入的成功依靠子宫内膜容受性、胚胎的正常发育和两者的发育同步性及功能的协调性。研究发现hCG可调控子宫内膜容受性及以旁分泌和自分泌的方式参与胚胎的植入过程。
1998年Licht等研究了宫腔内灌注500 IU/m L的hCG后子宫内膜的变化, 发现白血病抑制因子(LIF) 、VGEF、基质金属蛋白酶9(MMP-9) 等有利于妊娠的因子在灌注hCG后含量均增加, 而胰岛素样生长因子结合蛋白Ⅰ(IGF-BP-Ⅰ) 和巨噬细胞集落刺激因子(M-CSF) 等不利于胚胎着床的因子受到明显抑制。2011年Mansour等研究了ET前宫腔内灌注hCG对胚胎种植率及临床妊娠率的影响, 他们根据给予hCG浓度的不同把研究对象分为对照组(0IU) 、100 IU组、200 IU组、500 IU组, 将hCG在胚胎移入子宫前5 min分别注入上述4组女性宫腔内。结果发现, 100 IU组及200 IU组的胚胎种植率及临床妊娠率与对照组比较差异无统计学意义, 而500 IU组与对照组比较, 胚胎种植率及临床妊娠率明显升高, 差异有统计学意义。
hCG可促进子宫内膜合成分泌子宫内膜营养蛋白, 使胚胎植入过程更加顺利。Sugihara等的研究可以证明“子宫内膜营养蛋白的分泌是在hCG出现后开始的”这一点。另外, Banerjee等通过建立非人类灵长类动物(狒狒) 模型, 发现hCG可通过分裂原活化蛋白激酶(MAPK) 路径诱导子宫内膜产生更多的PGE2, 提高胚胎的种植率。hCG能上调LIF的表达, 提高绒毛外滋养细胞的黏附能力, 促进胚胎的植入。Mansour等发现hCG可与子宫平滑肌细胞表面的LH/hCG受体结合, 抑制平滑肌细胞增殖, 降低其收缩能力, 减少子宫内膜的波动性, 为胚胎的植入提供相对稳定的环境。不仅如此, hCG还可延迟子宫内膜的蜕膜化过程, 延长种植窗口期, 为胚胎成功植入提供更多时间, 从而有利于提高胚胎种植率及临床妊娠率。
7.4 hCG介导免疫产生的效应
近年有研究发现, hCG可能介导了一些免疫反应, 导致血循环及局部的免疫因子发生变化, 从而在胚胎着床及妊娠维持中发挥重要作用。
从免疫学角度来说, 妊娠是一种半同种移植过程。胚胎植入过程中, 必然会牵涉到免疫排斥与免疫耐受两种机制的抗衡。如前者占优势将可能导致滋养细胞及子宫内膜受损、细胞功能发生紊乱, 使胚胎植入失败或导致妊娠终止。而hCG可调节子宫内膜的免疫耐受, 促进胚胎植入及妊娠维持。
Schumacher等比较了人工流产、自然流产及异位妊娠人工流产术后胎盘组织中hCG信使RNA表达的差异, 发现其在自然流产胎儿中表达明显降低, 而且妊娠早期hCG能吸引调控T细胞到胚胎母体的交界面上。认为hCG在维持妊娠中有极其重要的作用, 推测在IVF临床中使用hCG做黄体支持优于使用黄体酮。
Nakayama等在动物实验中发现, 提取自妊娠早期妇女外周血的单核细胞可促进大鼠胚胎的植入, 而hCG可增强其作用, 但是在单核细胞的表面并未检测到LH/hCG受体。因此推测hCG可能通过非LH/hCG受体途径发挥作用。在之后的研究中发现, 重组hCG可以通过高浓度的单核细胞诱导白细胞介素8(IL-8) 的产物增加, 并且这种作用可受高浓度外源性糖的抑制。因此推断hCG可能通过糖链受体发挥作用, 从而促使免疫细胞产生细胞趋化因子。hCG可能通过以上机制增加了化学黏附因子的产物, 活化了外周血单核细胞在胚胎植入中的作用。Yoshioka等和Fujiwara等先进行了对照试验研究, 后在随后的综述中对hCG可能的机制做了进一步探讨。首先, 将反复IVF失败的患者随机分为2组, 治疗组于取卵日抽取提纯患者外周血单核细胞并与hCG共培养48 h, 2 d后再次抽取患者外周血单核细胞, 当天与共培养的外周血单核细胞一并移植入宫腔, 第5天行囊胚移植;对照组取卵后第5天行囊胚移植, 不予其他处理。发现治疗组临床妊娠率、胚胎种植率及活产率高于对照组(治疗组临床妊娠率、胚胎种植率及活产率分别为41.2%、23.4%和35.3%, 对照组分别为11.1%、4.1%和5.5%) 。随后的研究发现, hCG通过外周血单核细胞与凝集素聚糖之间的相互作用增加趋化因子的表达, 并借此增加自体外周血单核细胞数量以增强母体-胚胎间的免疫对话, 提高胚胎种植率及临床妊娠率。如果该研究结果得到确认, 将为反复IVF-ET失败的患者提供新的治疗手段。Tsampalas等认为, hCG通过调节细胞凋亡系统影响局部免疫耐受, hCG调整辅助T淋巴细胞1(Th1) 与Th2之间的平衡并作用于C3补体与C4A/B因子, 从而调节蜕膜局部的免疫, 加强胎儿母体间的联系。而且hCG可通过其对子宫内膜及子宫内膜受体的作用, 增加子宫内膜着床点局部的血管生成以促进胚胎成功着床。
Th1/Th2平衡是妊娠免疫的重要内容, 一直以来备受学者们的关注。Th1及Th2属于表达CD4+CD8+的T细胞亚群。Th1主细胞免疫, 可分泌肿瘤坏死因子α(TNF-α) 、白细胞介素2(IL-2) 等不利于妊娠的细胞因子;Th2主体液免疫, 分泌IL-4、IL-5、IL-10等细胞因子, 有利于妊娠的维持。早在1998年就提出了一定剂量的hCG可抑制Th1、Th2的表达, 减弱多种类型免疫应答。最近研究发现hCG能调节Th1/Th2细胞之间的平衡, 使其向有利于妊娠的方向发展。
有研究发现调节性T细胞(Treg) 是免疫抑制机制中的关键成分, 其在妊娠免疫耐受机制中可能扮演重要角色。CD4+CD25+Treg是一类具有免疫调节功能的T细胞亚群, 其具有免疫应答低下及免疫抑制两大特点, 可抑制免疫系统对自身及外来免疫抗原的应答, 维持机体免疫耐受及免疫应答的稳态。2001年Stephens等在人的胸腺中发现了CD4+CD25+Treg细胞。2005年Aluvihare等研究发现, 怀孕小鼠CD4+CD25+Treg细胞显著增加, 并可抑制母鼠对胎鼠的免疫排斥反应, 如果清除该群细胞将导致妊娠失败, 说明该细胞与妊娠期间的免疫调节密切相关。Foxp3是叉状头转录因子家族中的一个成员, 被认为是Treg细胞的标志性分子, 其在调节机体免疫自稳中起关键作用。CD4+CD25+Foxp3+Treg可增强母体免疫耐受的能力, 而hCG可增加妊娠期间Treg细胞的数量。据报道, Treg细胞被吸引到胚胎界面的相关机制中涉及胚泡和滋养细胞高hCG水平的表达。hCG还可调节子宫内膜自然杀伤细胞(u NK) 、树突状细胞及巨噬细胞等。hCG可通过上调子宫内膜胚胎着床部位VEGF的表达, 促进该部位毛细血管的生成而利于胚胎着床。
7.5 注射hCG日血清P水平对胚胎发育及IVF结局的影响
各组的年龄、Gn使用时间(d) 、Gn用量、hCG日LH值及移植胚胎数经方差分析, 差异无显著性(P>0.05) ;而获卵数随P值的增加有逐渐增多的趋势, 将获卵数与P水平进行Pearson相关分析, 获卵数与P水平呈正相关(r=0.293) , 其中A组与其他3组比较, 差异均有显著性(P<0.05) 。
| 组别 | hCG日P值(nmol/L) | 周期数(个) | 年龄(岁) | Gn时间(d) | Gn用量(支) | hCG日LH值(IU/L) | 获卵数(个) | 受精率(%) | 卵裂率(%) | 优质胚胎率(%) | 移植胚胎数(个) | 妊娠率(%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A | 2.14±0.56 | 113 | 31±3 | 12±2 | 42±14 | 0.87±0.63 | 11±5* | 69.41 | 93.06 | 86.13* | 2.3±0.6 | 62/113(54.9) * |
| B | 4.31±0.93 | 251 | 31±3 | 12±2 | 39±12 | 1.00±0.61 | 15±7 | 69.61 | 93.53 | 78.43 | 2.4±0.5 | 105/251(41.8) |
| C | 7.27±0.74 | 53 | 30±3 | 12±2 | 39±13 | 1.51±1.00 | 19±9 | 65.98 | 95.66 | 81.28 | 2.2±0.5 | 22/53(41.5) |
| D | 13.18±4.41 | 12 | 32±4 | 11±3 | 35±11 | 1.18±0.89 | 17±8 | 65.56 | 81.37* | 70.94 | 2.5±1.0 | 4/12(33.3) |
注:Gn使用量以COH时使用的Gonal-F和HMG的总支数计算, 75 U/支;与其他组比较差异有显著性, *P<0.05
八、hCG对黄体的支持
IVF-ET周期中降调节后的垂体约需要10 d才能正常分泌LH, 这段时间如果没有足够的黄体支持, 雌激素、孕激素将急剧下降导致妊娠失败。而黄体期添加外源性hCG填补因LH分泌不足导致的体内激素环境紊乱, 刺激黄体分泌合适比例的雌激素、孕激素, 使妊娠得以继续。耿琳琳等将接受IVF治疗的172个周期的患者随机分为hCG注射组(A组) 、hCG+黄体酮注射组(B组) 、口服黄体酮胶囊组(C组) , 并设正常妊娠对照组, 发现B组较A组和C组有更高的周期妊娠率, 且B组与正常妊娠对照组E2/孕酮比值及变化趋势最相近。尽管如此, 有学者认为hCG可VEGF及PGE2的分泌致血管生成及通透性增加, 可导致中重度OHSS的发生, 不适合用于ART中的黄体支持。Daya等比较了IVF/胞浆内单精子注射(ICSI) 长方案移植后应用hCG进行黄体支持与应用孕激素进行黄体补充, 发现应用hCG进行黄体支持组并未明显增加临床妊娠率及减少流产率, 但是发生OHSS的风险却增高了近20倍。Fatemi等研究后建议, 当hCG日E2>2 500 ng/L, 不适宜应用hCG行黄体支持治疗。所以, 在常规应用hCG激发排卵的周期中hCG仅用于卵巢反应差患者的黄体期及雌激素下降过快时的补救。但最近几年由于Gn RHa促卵泡成熟的应用, 学者们发现该方案黄体期添加低剂量的hCG行黄体支持仍是一个可行的方法。Garcia-Velasco等将192例OHSS高风险接受Gn RHa触发排卵方案的患者分为3组, 分别给予1 000, 500, 250 IU的hCG行黄体支持, 观察对妊娠结局及OHSS发生率的影响, 结果表明Gn RHa触发排卵方案黄体期添加低剂量hCG在不增加OHSS风险的情况下可以确保正常的妊娠结局。
8.1 超促排卵与黄体功能不全
最早由Edwards和Steptoe提出超促排卵会引起黄体功能不全, 导致体外受精-胚胎移植(IVF-ET) 失败。其后的研究也证实在IVF周期中存在黄体功能缺陷, 其原因可能为:(1) 卵巢刺激引起多个卵泡生长, 使得排卵后即黄体早期的血清雌激素浓度异常升高, 孕酮浓度提前升高, 子宫内膜由增生期提前转为分泌期, “种植窗”提前开放和关闭, 子宫内膜发育和胚胎发育不同步, 子宫内膜容受性降低, 胚胎不能种植。有研究表明, 子宫内膜提前发育3 d, 则无妊娠发生(2) 黄体早期的雌激素和/或孕酮的异常升高, 通过负反馈影响垂体黄体生成激素(LH) 分泌, 导致LH减少, 溶黄体提早发生, 黄体发育不良(3) 大剂量外源性人绒毛膜促性腺激素(hCG) 诱发排卵, 可能通过负反馈降低黄体期LH浓度, 导致黄体功能不全(4) 在人类黄体发现存在雌激素α和β受体, 故推测雌激素可直接作用于黄体而影响其功能(5) 卵母细胞吸出时部分颗粒细胞丢失, 导致黄体期产生激素的细胞减少。
8.2 促性腺激素释放激素激动剂(Gn RHa) 与黄体功能不全
Gn RHa能抑制内源性LH峰, 避免卵泡的过早黄素化, 防止卵泡提前成熟, 可降低ART周期取消率, 促进卵泡发育的同步化, 改善卵细胞质量, 提高妊娠率。1992年的meta分析表明, 对外源性促性腺激素反应正常的妇女, 在IVF周期中使用Gn RHa能提高妊娠率80%~127%。但是另一方面, Gn RHa对垂体的抑制作用会导致内源性LH不足, 从而使黄体期孕酮水平低下。有报道, 垂体功能在停止使用Gn RHa(Decapeptyl 0.1 mg/d) 后16~22 d才开始恢复, 但此时LH浓度仍低于生理水平(0.09~1.9 IU/L) , 即使早在卵泡早期就停用Gn RHa, 虽然黄体期LH的分泌可部分恢复, 但是孕酮的生成并未增加。子宫内膜活检证实在应用Gn RHa后的黄体中期, 子宫内膜发育落后, 腺体细胞发育停滞。孕酮水平的降低不仅会影响子宫内膜发育, 而且影响子宫收缩。用超声观察子宫收缩频率和方向, 可发现在ET时高频率的子宫收缩可影响胚胎定位, 干扰着床, 降低妊娠率。
8.3 Gn RH拮抗剂(Gn RHA) 与黄体功能不全
目前对应用Gn RHA的ART周期是否需要黄体支持存在争议。与Gn RHa不同, 其垂体功能在数小时后就能恢复对Gn RH的反应。正常妇女使用Gn RHA后黄体期长度和孕酮浓度均正常, 表明其对自然周期黄体期无不良影响。故有学者主张卵泡晚期使用Gn RHA不需要黄体支持。初步观察在宫腔内人工授精周期中, 使用Gn RHA时不加黄体支持是安全的。但体外实验显示, Gn RHA虽不影响人黄体颗粒细胞分泌类固醇激素, 但减少血管内皮生长因子(VEGF) 的分泌, 而VEGF对维持黄体功能有重要作用, 可增强卵泡的微血管网, 促成正常黄体的形成。多项研究认为在IVF周期中使用Gn RHA会导致黄体期功能缺陷。Beckers等证实在使用Gn RHA的IVF周期中, 没有黄体支持会导致黄体期LH水平低下, 孕酮浓度降低, 溶黄体提早发生, 妊娠率下降。Tavaniotou等对赠卵者使用Gn RHA超促排卵周期的黄体期与自然周期的黄体期进行比较, 发现LH浓度降低, 黄体期缩短, 因此认为有必要黄体支持。
目前尚无公认的最佳黄体支持的方案, 各个中心药物的选择、剂量、剂型和时间各异。使用的药物有hCG、孕酮、雌激素等。
8.4 药物的选择
8.4.1 hCG诱发排卵后第3, 6和9天用1500/2500IU, 或1 500 IU隔天使用。
在应用Gn RHa的ART周期, hCG作为黄体支持能有效提高孕酮浓度, 延长黄体寿命, 增加妊娠率, 降低流产率, 改善ART的结局, 其作用得到公认。与孕酮相比, 其优点是不仅刺激雌激素、孕酮持续分泌, 而且可刺激其他尚未明确的影响胚胎种植的黄体产物的分泌, 延长黄体寿命, 改善超促排卵引起的黄体功能不足, 其作用机制更符合生理, 且不需要每天使用。但最近有研究表明, hCG在妊娠率和流产率上与孕酮无差异, 没有优越性, 反而增加卵巢过度刺激综合征(OHSS) 的风险, 而且会干扰妊娠试验, 现多数已被孕酮取代。至于在孕酮基础上加用hCG的价值, 有学者总结了59个研究后认为孕酮联合hCG与单用孕酮无差别。
8.4.2 孕酮目前多数生殖中心以孕酮为首选药物。
剂型有口服、针剂、阴道制剂多种, 最佳剂型仍未统一(1) 口服制剂。微粒化孕酮胶囊(Utrogest) , 常用剂量为100 mg, 3次/d。由于肝脏首过效应, 口服微粒化孕酮90%以上被完全代谢, 因此, 需要加大口服剂量才能达到使子宫内膜转变的组织最小孕酮浓度。与其他剂型相比, 口服制剂妊娠率低, 效果较差, 且会引起催眠、镇静、嗜睡、恶心、面色潮红等不良反应, 故多不主张口服用药(2) 针剂。常用剂量20~100 mg/d。孕酮针剂能提高黄体期血清孕酮浓度, 改善黄体功能, 提高胚胎移植率和妊娠率, 改善IVF结局, 其疗效已较为肯定。但针剂需要每天给药, 且因为是油剂, 会引起疼痛、局部红肿、过敏, 甚至无菌性脓肿, 患者耐受性较差。另外, 因卵巢黄体分泌的孕酮为17-α羟孕酮, 故认为用17-α羟孕酮作为黄体支持更符合生理。Unfer等比较17-α羟孕酮已酸盐(17-OHPc) 针剂(341 mg/次, 每3 d 1次) 和孕酮阴道制剂(90 mg/d) 后, 认为17-OHPc更优, 且接受性好, 可能为黄体支持更好的选择(3) 阴道制剂。根据孕酮阴道制剂的药代动力学, 经阴道吸收可达到黄体期所需的血清孕酮水平。并且由于孕酮阴道吸收的子宫首过效应, 在子宫内膜组织中可产生较高的局部效应, 从而避免血清高药物浓度而引起的药物全身不良反应。虽有meta分析认为孕酮肌注效果优于阴道给药, 但是目前很多研究认为, 孕酮阴道制剂与针剂在黄体支持中具有相似的疗效。Schoolcraft等比较孕酮阴道制剂和针剂在IVF-ET中的使用, 发现总妊娠率、临床妊娠率、出生率两组相似。Penzias等亦证实使用孕酮阴道给药和肌内注射行黄体支持, 两组的妊娠率相似。阴道用药患者的全身反应小, 可避免肌注带来的痛苦, 耐受性好, 但也有阴道分泌物增多、会阴不适等不良反应。目前临床使用的阴道制剂剂型有栓剂(Cyclogest) 、胶囊(Utrogest) 、凝胶(8%Crinone) 、片剂(Endometrin) 等。其中, 凝胶制剂(8%Crinone) 由于剂型特殊, 可持续恒定剂量释放, 避免每日多次用药的不便。Simunic等比较了凝胶(8%Crinone) 90 mg/次, 1次/d与胶囊(Utrogestan) 200 mg/d, 3次/d, 发现两组的临床妊娠率无统计学差异。经阴道孕酮凝胶制剂与胶囊或栓剂的不良反应无差异, 但多数认为凝胶剂型使用简单, 阴道分泌物少, 患者更容易接受。
8.4.3 孕酮衍生物地屈孕酮是孕酮的立体异构体, 具有内源性孕酮的生物学活性及临床特性。
但化学结构的微小改变, 使得地屈孕酮的代谢更稳定, 口服后胃肠道吸收好, 生物利用度高, 而且地屈孕酮的安全性好, 在发挥促孕作用的同时, 不产生雄激素或抗雄激素活性, 对性别发育的影响小。Domitrz等比较地屈孕酮片剂(10 mg/次, 3次/d) 和孕酮针剂(25 mg/d) 在IVF-ET中的疗效, 发现两组的妊娠率和胚胎着床率相似, 自然流产率在两组之间的差别也无显著性, 认为地屈孕酮使用简单方便, 并且与孕酮针剂的疗效相当。Chakravarty等比较了地屈孕酮片剂(10 mg/次, 2次/d) 和微粒化阴道栓剂(200 mg/次, 3次/d) , 发现妊娠率、流产率及出生率两组无显著差异, 且相对于阴道栓剂而言, 地屈孕酮片口服方便, 无阴道局部不良反应, 患者耐受性与依从性好, 但是医疗费用较高。因该研究地屈孕酮组例数较少(79/351) , 临床使用时间尚短, 其安全性有待进一步研究。
8.4.4 雌激素戊酸雌二醇(estradiolvalerate, E2valerate) , 口服2~6 mg/d。
有学者发现在使用Gn RHa超促排卵的周期中, 黄体期血清雌激素水平低下, 因此有不少生殖中心联合雌孕激素行黄体支持。Lukaszuk等研究孕酮加用不同剂量的E2(0, 2, 6 mg/d) 后, 认为较高剂量的E2(6 mg/d) 最为合适, 并建议黄体期E2水平低的患者加用E2行黄体支持。2002年的meta分析也支持雌激素的使用。但另一方面, 有meta分析认为雌孕激素联合与单用孕酮相比, 妊娠率和流产率无差别。Tav等研究孕酮加用E2行黄体支持的疗效, 认为黄体期加用E2会抑制内源性孕酮的分泌, 有溶黄体作用, 对IVF-ET的结局没有好处。而在使用Gn RHA的周期中, Fatemi等研究表明在孕酮支持的同时补充E2(4 mg/d) 不能提高妊娠可能性, 两组的妊娠率无差异。
8.5. Gn RHa
天然Gn RH曾被用于低促性腺激素及性腺功能减退患者的黄体支持, 但是这需要每60~120 min用携带式泵静脉注射或皮下注射, 因不方便故无法作为常规使用。而Gn RHa因其作用时间较长, 故可望成为黄体支持的新选择。但面临的问题是Gn RHa能很快诱导垂体脱敏。20年前就有研究发现, 在黄体期单次或2次应用0.5 mg buserelin均会引起黄体功能的损害。因为Gn RHa的垂体脱敏与用药的剂量和时间有关, 故有学者提出Gn RHa按照一定的剂量和频率使用, 则有可能在整个黄体期维持其“上调”效应, 从而维持血清LH浓度, 作为黄体支持。
Tesarik等先后在赠卵研究和胞浆内单精子注射(ICSI) 周期中, 在受精后第6天单次给予0.1 mg Gn RHa(triptorelin) 作为黄体支持, 与安慰剂组比, 可提高移植率、妊娠率及出生率, 并认为可能归因于Gn RHa对胚胎和黄体的联合作用。Pirard等先后在宫腔内人工授精和IVF-ET周期中使用Gn RHa(buserelin) 作为黄体支持, 认为Gn RHa在ART中提供黄体支持可能有效。
Gn RHa制剂经鼻使用或单次使用, 比每天肌内注射孕酮或阴道用药使用更为方便。与单纯提高孕酮和E2浓度相比, 可提高血清LH浓度, 并刺激其他与妊娠有关的黄体分泌的多肽, 如松弛素。而LH可能直接作用于子宫内膜, 刺激血管生长因子及细胞因子的释放, 有益于胚胎着床。另外, 因滋养细胞有Gn RH受体存在, 故可能直接作用于胚胎, 促进其发育。
因此, Gn RHa有望成为一种新的黄体支持药物, 但仍需进一步研究。
九、hCG的制备方法
9.1 利凡诺沉淀法
称取hCG样品100 mg溶于蒸馏水50 mL中, 边搅拌, 边滴加1%利凡诺溶液, 直至无新沉淀产生。3 000 r/min离心15 min, 收集上清。用5倍体积95%乙醇沉淀, 静置过夜。吸除大部上清, 3 000 r/min离心10 min。沉淀物用无水乙醇脱水3次, 真空干燥, 测定效价。
9.2 BaCO3吸附法
取真空干燥的hCG样品, 用0.2 mol/L Na2CO3溶液30 mL溶解。然后, 边搅拌边滴加2 mol/L Ba(Ac) 2溶液20 mL, 可见有白色沉淀出现。离心去除沉淀物。上清液装透析袋, 用蒸馏水3 L透析过夜。透析液冷冻干燥。所得hCG冻干粉加蒸馏水50 mL溶解。然后, 边搅拌边滴加2 mol/L Na2SO4溶液, 直至无BaSO4沉淀产生。3 000 r/min离心10 min。除去BaSO4, 上清液装透极袋用蒸馏水1.5 L透析过夜。透析液冷冻干燥。冻干粉称重、检测效价。
9.3 活性检测
按照中国药典规定的方法检测生物活性。按照测试药框说明书规定的操作步骤检测放射免疫活性。
十、讨论
目前关于COH中hCG注射日P水平对胚胎发育及IVF-ET妊娠结局的影响尚无一致意见。有认为妊娠结局与黄体期P水平无关, 而取决于卵母细胞质量。但有人提出, P水平可影响IVF妊娠率, P值过高(>9.54 nmol/L) , 妊娠率明显降低。Fanchin等 和Ozcakir等 认为, P水平升至2.86~3.18 nmol/L并持续2d, 可使子宫内膜提前向分泌期转变, 种植窗移动, 影响胚胎种植, 临床妊娠率较低。但都认为P值并不影响胚胎质量, 而Yovel等则认为P提前升高对卵子和胚胎质量会产生负面作用。本资料提示, 随P值升高, 妊娠率逐渐下降, 尤其P>9.54 nmol/L时, 下降显著。其原因可能P值过高, 腺体和间质发育不同步, 胚胎滞后于子宫内膜发育而影响胚胎植入, 最终影响妊娠率。因此有研究者认为根据P值决定hCG注射时间是影响胚胎与内膜发育同步的重要因素之一。但本资料提示, P值较低时, 卵裂率、优质胚胎率都显著增高, 可能与P值升高引起过早黄素化有关。研究证明过早黄素化可使卵子及胚胎质量降低。
hCG注射日血清P水平升高原因也是近年探讨热点。血清P由颗粒黄体细胞和泡膜黄体细胞分泌, 进入靶细胞后与胞内特异受体结合发挥生理效应, 使子宫内膜向分泌期转变, 准备接纳孕卵着床及早期胚胎发育。在自然周期, 排卵前卵泡分泌微量P协助LH峰出现。经垂体降调节, hCG注射前P轻微升高却是因多个卵泡膜细胞正常排卵前分泌的P总和进入血液形成, 故P水平与卵泡发育数目有关。本研究证明了P水平与获卵数呈正相关。血清P增加可能是大剂量外源性FSH促使卵巢类固醇合成途径遭到某种程度破坏 , 或是潜在早期卵巢储备降低的表现之一。
虽血清P升高机制尚不明确, 但IVF周期COH过程中, 血清P水平明显升高可影响IVF-ET的卵裂率、优质胚胎率, 引起妊娠率明显下降。提示适当减少促性腺素剂量, 避免多个卵泡发育, 密切动态监测血清P水平, 合理掌握hCG注射时机, 降低过早黄素化发生, 使IVF周期中血清P水平位于合适范围, 而得到理想卵子数及较高卵裂率、优质胚胎率, 改善卵子质量、胚胎发育潜能, 提高妊娠率。因此, hCG注射日血清P水平可作为决定hCG注射时间, 指导选择黄体支持方案及预测IVF妊娠结局的指标之一, 联合雌二醇(E2) 应用, 更可提高准确率。
在女性自然周期中, LH峰通常在月经周期的第12~16天出现, 持续1~2 d。通常在检测到LH峰后的36 h会排卵。IVF-ET治疗周期中通常以外源性Gn行控制性促排卵, 实现同一排卵周期中多卵泡发育, 以提高每周期的妊娠概率。在控制性促排卵周期中, 往往内源性的LH峰不能自发产生, 或者产生的时间和强度不合适, 不能诱发排卵。所以, 需要外源性的促性腺激素来替代内源性的LH峰。最常用的外源性激素是h CG。在ART周期中, h CG可以起到内源性LH峰的作用, 并能够诱导取卵前卵泡的最后成熟。在LH峰出现后或者诱导排卵的h CG注射后会发生一系列的变化, 这些变化主要包括雌激素和前列腺激素的合成、卵母细胞减数分裂成熟的恢复、卵丘扩散、卵丘细胞与卵母细胞耦联的减少、排卵前期酶的合成。LH峰距离排卵的时间在不同物种存在差异, 在啮齿动物中约为12~15 h, 而在猪中却长达42 h。人的排卵通常在血清中检测到E2峰后的40~63 h, 也就是说在LH峰后的16~39 h排卵。Peters等的数据将这个时间范围进一步缩小, 认为人类通常在LH峰出现后的28~36 h排卵。
理论上注射h CG与取卵手术间隔时间越长会获得越多的卵子, 且得到的卵子的成熟率也会越高。且有研究表明, 成熟了的卵子由于卵丘细胞充分扩散, 会更容易从卵泡中冲洗出来, 有较高的获卵率, 并可以避免多精受精, 正常受精率也会相应的增加。但是, 卵子成熟后随着卵龄的增加谷胱甘肽含量被消耗, 可能损害雄原核的发育, 从而造成受精率降低;而注射卵龄大的卵子可能增加损伤纺锤体的机会, 纺锤体的损伤会降低ICSI胚胎的发育潜能。据此推测, h CG注射后过度延长取卵时间将影响卵子、胚胎质量。而且, 随着间隔时间的延长, 会出现取卵手术前卵子自发排掉, 导致获取卵子数减少, 甚至不能获取卵子。所以, h CG注射后取卵时间的选择, 是获得优质卵子的至关重要的条件。
众所周知, IVF周期中使用GnRH-a进行卵巢抑制调节时, 会有一个LH抑制, 并且卵子体内成熟较未使用GnRH晚一些。通过制造一个促性腺激素分泌不足的状态, 从而能够更好的控制卵泡的发育。而h CG到取卵之间的时间间隔一直存在着争议。最初在GnRH降调方案实施前, 大部分中心选择在距离h CG注射后32~36 h进行取卵。这是基于之前有报道显示在克罗米芬(CC) 和(或) human menopausal gonadotropin(h MG) 治疗周期中, 在间隔时间>35 h时术前排卵率较高。而Edwards等证明, 术前排卵很少发生在36 h前, 所以在>36 h范围内进行适当延迟是避免卵子不成熟和减少术前排卵的折中方法。也有报道指出, 当取卵时间延迟(>36 h) 时, 卵子的受精率和胚胎的卵裂率会有所增加。
基于这些争论, 各中心进行了大量的回顾性、前瞻性分析, 而这些分析也存在着一定的局限性。或者集中于对某时间点的讨论, 如Bokal等在20例PCOS患者中进行过h CG后34 h或38 h取卵的前瞻性临床研究;或者注射h CG后到取卵的时间跨度较大, 如Raziel等选择该中心在2003年1月—2005年6月期间行ICSI周期的72例患者进行研究。将72例患者随机分为两组, B组在注射h CG后34.5~36.0 h进行取卵, C组在注射h CG后38.5~40.0 h进行取卵。而我们则针对人们忽略的35.0~36.5 h之间的时间, 以0.5 h作为间隔, 对2012年8月—2013年6月在本中心行ART治疗患者的获卵率、卵子成熟率、正常受精率及优质胚胎率进行分析, 试图找到最佳的取卵时间。
本研究显示, 在女方年龄、体质量指数(BMI) 、不孕年限、血清基础性激素水平[FSH、雌二醇(E2) ]、Gn使用、h CG日激素水平[LH、雌二醇(E2) ]及内膜厚度间无统计学差异的情况下, 长长方案的患者在注射h CG后35.0~36.5 h之内取卵时, 患者的获卵率、2PN胚胎卵裂率、优质胚胎率比较无统计学差异(P>0.05) ;而随着取卵时间的延迟, 卵子的成熟率和正常受精率有所提高, 且差异有统计学意义(P<0.05) 。所以, 我们认为, 为提高获取卵子的成熟率及正常受精率, 可以适当的延迟取卵时间。但在不影响胚胎质量的情况下, 能够延长的极限是什么呢?
Gudmundsson等将39 h作为避免自发排卵的临界时间。他们发现延长h CG注射到取卵手术的间隔时间会增加卵丘完全扩散的卵细胞的数量, 也就是说, 卵子的成熟度得到了改善。他们认为, 随后卵子的受精率、合子的卵裂率也会得到改善, 也就是说, 延长h CG注射与取卵手术的间隔时间能够通过优化卵子的体内成熟来改善配子的质量。De Vits等的报道指出, 相对于注射h CG后36 h取卵而言, 注射h CG后38 h取卵获得的卵子在受精后能卵裂为质量更好的胚胎。他们推测, 最长的间隔时间能够使卵子发育的各个阶段都得到充分的完成, 因此更有可能发展成2PN的受精卵和正常卵裂的胚胎。
总之, 在注射h CG后34.5~36.5 h之间取卵时, 为获得较多的成熟卵子及更好的受精情况, 可以适当的延迟取卵时间。但在不影响胚胎质量的情况下, 能够延长的极限是什么, 尚需进行大规模、前瞻性、随机对照的研究方可得出更有力的结论。